Журнал "Медицинский совет" №18/2020
DOI: 10.21518/2079-701X-2020-18-142-150
И.Н. Захарова1, А.Н. Цуцаева2, В.А. Курьянинова2, Л.Я. Климов2,С.В. Долбня2, А.Л. Заплатников1, Н.Е. Верисокина2, Ш.О. Кипкеев2, А.А. Дятлова2, Д.В. Бобрышев2, М.Е. Пономарёва2
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Ставропольский государственный медицинский университет; 355017, Россия, Ставрополь, ул. Мира, д. 310
Введение. Несколько десятилетий назад впервые появились данные о наличии рецепторов к витамину D (VDR) на поверхности различных клеток организма человека, что послужило предпосылкой к исследованиям об изучении роли витамина D в развитии ряда заболеваний, в т. ч. и инфекционных.
Цель работы. Оценка взаимосвязи между приемом препаратов холекальциферола, синтезом дефензинов, а также частотой и структурой заболеваемости острыми респираторными инфекциями у детей раннего возраста.
Материал и методы. Обследовано 108 здоровых детей в возрасте от 1 мес. до 3 лет, из которых адекватно обеспеченных витамином D – 34 (31,5%), с недостаточностью – 40 (37,0%), дефицитом витамина D –27 (25,0%) и тяжелым дефицитом – 7 (6,5%) детей. После курса коррекции гиповитаминоза D лечебными дозами всем пациентам назначалась профилактическая доза препаратов холекальциферола (1000 МЕ/сут) курсом 6 мес.
Результаты. Лечебные дозы холекальциферола способствовали приросту β1- и β2- дефензина, между суточной дозой витамина D и приростом β2-дефензина выявлена прямая корреляционная связь (г = 0,34, р < 0,05). Прием профилактической дозы холекальциферола 1000 МЕ/сут в течение 6 мес. сопровождался дальнейшим увеличением продукции АМП – уровень β1-дефензина вырос в 2,4 раза (р < 0,001), а уровень β2-дефензина – в 2,5 раза (р < 0,001) по сравнению с исходными значениями. На фоне проводимой дотации препаратами холекальциферола частота респираторной заболеваемости составила 1,7 ± 0,2 раза в 6 мес. В группе детей с оптимальной обеспеченностью витамином D имелось достоверно большее число неболевших по сравнению с группами детей с недостаточностью и дефицитом витамина D.
Выводы. Прием препаратов витамина D способствует приросту уровней антимикробных пептидов и снижает частоту и тяжесть острых респираторных инфекций у детей раннего возраста.
Для цитирования: Захарова И.Н., Цуцаева А.Н., Курьянинова В.А., Климов Л.Я., Долбня С.В., Заплатников А.Л., Верисокина Н.Е., Кипкеев Ш.О., Дятлова А.А., Бобрышев Д.В., Пономарёва М.Е. Влияние комплаенса приема холекальциферола на частоту респираторных инфекций у детей раннего возраста. Медицинский Совет. 2020;(18):142-150. https://doi.org/10.21518/2079-701X-2020-18-142-150
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Impact of compliance with cholecalciferol administration on the incidence of respiratory infections in young children
Irina N. Zakharova1,Anna N. Tsutsaeva2, Victoriya A. Kuryaninova2, Leonid Ya. Klimov2, Svetlana V. Dolbnya2, Andrey L. Zaplatnikov1, Natalia E. Verisokina2, Shamil O. Kipkeev2, Anna A. Dyatlova2, Dmitry V. Bobryshev2, Maria E. Ponomareva2
1 Russian Medical Academy of Continuing Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Stavropol State Medical University; 310, Mir St., Stavropol, 355017, Russia
Introduction. Data on the vitamin D receptors (VDR) found on the surface of a large number of cell types of the human body were first published several decades ago, which served as a prerequisite to study the role of vitamin D in the development of some diseases, including infections.
Objective of the study. Evaluate the relationship between administration of cholecalciferol supplements, the synthesis of defensins, and the incidence and morbidity patterns of acute respiratory infections (ARI) in young children.
Material and methods.108 healthy children aged 1 month to 3 years were examined, of which 34 (31.5%) were vitamin D sufficient, 40 (37.0%) had a vitamin D insufficiency, 27 (25.0%) had a vitamin D deficiency and 7 (6.5%) children had severe vitamin D deficiency. After the course of treatment of vitamin D deficiency with therapeutic doses, all patients were prescribed prophylactic doses of cholecalciferol supplements (1000 IU/day) for a 6-month course.
Results. Therapeutic doses of cholecalciferol promoted β1 and β2-defensin expression; a direct correlation was found between the daily dose of vitamin D and the increase of β2-defensin expression (r = 0.34, p <0.05). Administration of cholecalciferol in the prophylactic dose of 1000 IU/day for 6 months was accompanied by the further increase in antimicrobial peptide (AMP) production, which resulted in the increase of the β1-defensin level by 2.4 times (p <0.001) and β2-defensin level by 2.5 times (p <0.001) as compared with the baseline levels. The incidence of respiratory morbidity amounted to 1.7 ± 0.2 episodes every 6 months against the background of ongoing cholecalciferol supplementation. The number of patients, who were not infected, was significantly more in the group of children with optimal vitamin D status, than in the groups of children with vitamin D insufficiency and deficiency.
Conclusions. Administration of vitamin D supplements induces antimicrobial peptide expression and reduces the frequency and severity of acute respiratory infections in young children.
For citation: Zakharova I.N., Tsutsaeva A.N., Kuryaninova V.A., Klimov L.Y., Dolbnya S.V., Zaplatnikov A.L., Verisokina N.E., Kipkeev S.O., Dyatlova A.A., Bobryshev D.V., Ponomareva M.E. Impact of compliance with cholecalciferol administration on the incidence of respiratory infections in young children. Meditsinskiy sovet = Medical Council. 2020;(18):142-150. (In Russ.) https://doi.org/10.21518/2079-701X-2020-18-142-150
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
На сегодняшний день все более актуально встает вопрос о профилактике инфекционных и неинфекционных заболеваний, в связи с чем современные исследования направлены на поиск новейших механизмов формирования иммунологической защиты организма человека от различных заболеваний. Несколько десятилетий назад впервые появились данные о наличии рецепторов к витамину D (VDR) на поверхности различных клеток организма человека, что послужило предпосылкой к исследованиям об изучении роли витамина D в развитии ряда заболеваний, в т. ч. и инфекционных [1–4].
В конце прошлого столетия VDR были обнаружены на поверхности клеток иммунной системы, что способствовало созданию идеи о влиянии витамина D на функцию иммунной системы человека, включая звенья как врожденного, так и приобретенного иммунитета [5]. Учитывая тот факт, что иммунные клетки также экспрессируют CYP27В1, это позволяет локально обеспечивать преобразование 25(ОН)D в 1,25(ОН)2D [6, 7]. В исследованиях продемонстрировано прямое влияние активных метаболитов витамина D на пролиферацию, дифференцировку и функциональную активность клеток иммунной системы [8–12]. Однако помимо прямого модулирующего действия иммунотропные эффекты витамина D заключаются в его положительном влиянии на продукцию антимикробных пептидов (АМП) за счет его взаимодействия с рецепторами VDR в промоторных частях генов, ответственных за синтез определенных АМП [13–16].
АМП представлены различными семействами катионных белковых молекул, которые являются эволюционно старейшими факторами врожденного иммунитета [16, 17]. В организме человека имеется большое разнообразие АМП, но наибольшее значение имеют семейства дефензинов и кателицидина.
АМП из семейства дефензинов обладают широким спектром действия в отношении многих вирусов, бактерий и грибков [13, 14, 17–19], в т. ч. и возбудителей респираторных инфекций. Продемонстрирована активность β2-дефензинов в отношении H. influenzae, в частности, показано, что происходит ингибирование адгезии возбудителя к эпителиальным клеткам среднего уха [17]. H.Y. Lee et al. продемонстрировали роль β2-дефензинов в снижении частоты наиболее распространенных возбудителей ОРИ в детском возрасте: H. influenzae, S. pneumoniae, M. catarrhalis [18].
Говоря о клиническом значении витамина D, необходимо отметить его роль в снижении частоты развития ряда инфекционных заболеваний, в т. ч. респираторных. Наиболее изученным среди противоинфекционных эффектов витамина D является его роль в снижении частоты туберкулеза. В многочисленных исследованиях, посвященных данному вопросу, показано, что среди больных туберкулезом существенно чаще встречается дефицит витамина D, при этом тяжесть заболевания также коррелирует со статусом витамина D [20–23].
Именно на примере взаимодействия молекулы кателицидина с M. tuberculоsis был открыт путь витамин-Dзависимой продукции АМП: после проникновения микобактерии в макрофаги и активации их γ-интерфероном происходит взаимодействие активных форм витамина D с рецепторами, после чего активируется синтез АМП по TLR2/1-ассоцированному пути [21]. Исследования среди взрослого населения показали зависимость между недостаточностью витамина D и увеличением частоты инфекции верхних дыхательных путей [24, 25]. Исследования среди детей, в основном касающиеся инфекций нижних дыхательных путей (подтвержденные пневмонии и бронхиолиты), продемонстрировали взаимосвязь между низким уровнем кальцидиола сыворотки и более высоким риском ИНДП у детей в Индии [26], Бангладеш [27] и Турции [28].
Результаты проведенного в 2013 г. метаанализа, включавшего 11 плацебо-контролируемых исследований с участием 5 660 пациентов в возрасте от 6 мес. до 75 лет, доказали защитный эффект приема препаратов витамина D против инфекций дыхательных путей (грипп, пневмония, ОРИ, ОР = 0,64, 95% ДИ 0,49–0,84) [29].
Недавний метаанализ 8 исследований, включающий 20 966 субъектов, продемонстрировал, что лица с дефицитом витамина D имели существенно больший риск развития пневмонии (ОР 1,64, 95% ДИ: 1,00, 2,67) [30]. Рандомизированное контролируемое исследование с участием 960 детей продемонстрировало значимый эффект оптимального статуса витамина D у детей, заключающийся в снижении частоты развития ИНДП (ОР: 1,26, 95% ДИ: 1,03–1,55) [31].
Систематический обзор и метаанализ с участием детей старшего возраста и взрослых, включивший 19 исследований, выявил значительную обратную связь между концентрацией 25(OH)D и риском развития ОРИ у детей [32]. В некоторых обсервационных исследованиях была продемонстрирована отрицательная корреляционная зависимость между уровнем кальцидиола сыворотки крови и тяжестью ОРИ, которая определялась продолжительностью заболевания, госпитализацией и степенью тяжести [33, 34], однако метаанализ этих результатов не проводился.
Цель работы – оценка взаимосвязи между приемом препаратов холекальциферола, синтезом дефензинов, а также частотой и структурой заболеваемости острыми респираторными инфекциями у детей раннего возраста.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В рамках регионального фрагмента фармакоэпидемиологического исследования РОDНИЧОК-2, проводившегося в Северо-Кавказском федеральном округе, выполнен анализ зависимости уровней АМП из семейства β-дефензинов (β1- и β2-дефензины) от обеспеченности витамином D у детей раннего возраста.
В исследовании приняли участие 108 условно здоровых детей в возрасте от 1 мес. до 3 лет жизни, из которых 50 (46,3%) – первого года жизни, 30 (27,8%) – второго и 28 (25,9%) – третьего года жизни.
После получения результатов первого определения концентрации кальцидиола и АМП сыворотки общая группа пациентов была распределена на подгруппы в зависимости от исходной на момент начала исследования обеспеченности витамином D: пациенты с адекватной обеспеченностью витамином D – 34 (31,5%), с недостаточностью – 40 (37,0%) детей, дефицитом витамина D – 27 (25,0%) детей и тяжелым дефицитом – 7 (6,5%) пациентов.
Назначение лечебных доз холекальциферола происходило дифференцированно в зависимости от исходной обеспеченности витамином D. На этапе коррекции статуса витамина D (второй этап исследования) детьми с гиповитаминозом D в течение 30 дней принимались т. н. лечебные дозировки препаратов холекальциферола, а детьми, у которых на первом этапе уровень обеспеченности соответствовал нормальному (более 30 нг/мл), профилактическая доза составила 1000 МЕ/сут.
На третьем этапе исследования детям назначалась профилактическая доза водного раствора холекальциферола 1000 МЕ/сут длительностью курса 6 мес., после чего пациенты вновь приглашались на визит, во время которого проводился повторный сбор анамнестических данных, в т. ч. сведения о количестве перенесенных острых респираторных заболеваниях в течение 6 мес., их тяжести, а также оценка параметров физического развития ребенка. К концу третьего этапа исследования численность выборки составила 72 ребенка, что составило 66,7% от исходного числа детей, вошедших в группу.
Обеспеченность витамином D оценивалась на основании определения концентрации кальцидиола (25(ОН)D) сыворотки крови методом конкурентного хемилюминесцентного иммуноанализа (CLIA), выполненного в лаборатории научного центра «ЭФиС» г. Москвы.
Оценку результатов обеспеченности витамином D осуществляли в соответствии с критериями, отраженными в Национальной программе «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции (2018)»: концентрация кальцидиола сыворотки менее 10 нг/мл (менее 25 нмоль/л) – тяжелый дефицит витамина D; уровень кальцидиола сыворотки от 10 до 20 нг/мл (25–50 нмоль/л) – дефицит; концентрация 25(ОН)D от 21 до 30 нг/мл (51–75 нмоль/л) – недостаточность; адекватный уровень витамина D определялся как концентрация 25(ОН)D более 30 нг/мл (более 75 нмоль/л); уровень с возможным проявлением токсичности – более 100 нг/л (более 250 нмоль/л); абсолютно токсичный уровень – концентрация 25(ОН)D более 200 нг/мл (более 500 нмоль/л) [35].
Содержание β1- и β2-дефензинов в образцах сыворотки крови определяли иммуноферментным методом (сэндвич-метод) с использованием набора реактивов SEB373Hu и SEA072Hu фирмы Cloud-Clone-Corp.® (США/КНР) соответственно на мультимодальном ридере Varioskan Flash “Thermo Fisher Scientific” (США) в научно-исследовательской лаборатории «Нанобиотехнология и биофизика» Центра биотехнологического инжиниринга СевероКавказского федерального университета г. Ставрополя. Для оценки уровней β1- и β2-дефензинов нет общепринятых референсных значений.
Статистическая обработка и анализ результатов исследования проводились с использованием пакета программ AtteStat, STATISTICA 10.0. Для параметрических количественных данных определяли среднее арифметическое значение (M) и ошибку средней арифметической величины (m).
Для непараметрических количественных данных определяли медиану (Ме), а также 25-й и 75-й квартили (25Q-75Q). В случае нормального распределения для оценки межгрупповых различий при анализе количественных параметрических данных использовали t-критерий Стьюдента, при аномальном распределении в группах с количественными непараметрическими данными –U-критерий Манна – Уитни. Для выявления статистической значимости различий между качественными данными использовали критерий Пирсона (χ2) с поправками для малых выборок и точный критерий Фишера (если один из показателей был менее 4, а общее число показателей менее 30). Для оценки связи между показателями использовали коэффициенты парной корреляции Пирсона (r) и Кендалла. Различия считались статистически достоверными при р ≤ 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На фоне профилактического приема препаратов витамина D в общей группе пациентов произошло снижение концентрации 25(ОН)D сыворотки крови относительно результатов после курса коррекции лечебными дозами: медиана в третьей точке составила 28,9 (24,7–36,8) нг/мл по сравнению с результатами во второй точке исследования – 49,1 (39,7–69,75) нг/мл (р < 0,001). Обнаруженная динамика прежде всего обусловлена снижением комплаенса приема препаратов холекальциферола родителями детей [36].
В частности, к моменту заключительного забора крови лишь 12 (17,1%) из 70 дошедших до конца третьего этапа исследования детей продолжали принимать рекомендованные профилактические дозы препаратов холекальциферола, в то время как 58 (82,9%), несмотря на рекомендации, прервали профилактический прием препаратов витамина D. Закономерно, что между комплаентными пациентами и детьми, прервавшими курс профилактики, выявлена существенная разница в уровне 25(ОН)D в третьей точке исследования: 45,15 (29,8–51,3) и 27,3 (24,3–34,9) нг/мл соответственно (р < 0,01). В табл. 1 представлена динамика исследуемых параметров на каждом этапе исследования.
Таблица 1. Динамика 25(ОН)D, β1- и β2-дефензинов на фоне приема лечебных (1 мес.) и профилактических (6 мес.) доз холекальциферола
Table 1. Changes in 25(OH)D, β1- and β2-defensin levels during administration of therapeutic (1 month) and prophylactic (6 months) doses of cholecalciferol
I – исходный уровень | 24,8 [17,6–32,5] | 3,3 [2,2–5,9] | 240,7 [86,8–686,6] |
II – через 1 мес. | 49,1** [39,7–69,8] | 3,7* [2,3-6,3] | 514,2** [468,2–1 105,0] |
III – через 6 мес. | 28,9** [24,7–36,8] | 7,8** [6,2–10,4] | 586,0** [475,5–1 135,9] |
Примечание. Статистическая значимость различий по сравнению с предыдущим этапом исследования: *p < 0,05 – **p < 0,001.
Концентрация АМП на фоне профилактического курса холекальциферола продолжала возрастать. Прием витамина D способствовал увеличению концентрации β1-дефензина в 2,4 раза по сравнению с исходным значением – с 3,3 (2,24–5,85) до 7,8 (6,24–10,39) пг/мл (р < 0,001). По сравнению с результатами после курса коррекции прирост β1-дефензина составил 4,82 (1,07–7,6) пг/мл (р < 0,001). Уровень β2-дефензина на фоне профилактического приема витамина D также увеличился с 514,2 (344,08–1 038,8) до 586,0 (475,52–1 135,58) пг/мл (р < 0,001).
При этом прием детьми раннего возраста холекальциферола на протяжении полугода способствовал увеличению концентрации β2-дефензина практически в 2,5 раза по сравнению с исходными значениями (р < 0,001). По-видимому, в комплексе факторов, необходимых для инициации синтеза АМП, необходимо создание оптимальной обеспеченности 25(ОН)D, что в нашем исследовании произошло на фоне месячного курса коррекции гиповитаминоза D и было зафиксировано во второй точке исследования.
Дальнейший прием профилактических доз холекальциферола, несмотря на постепенное снижение 25(ОН)D, не приводит к падению уровней АМП, что, по всей видимости, объясняется возможностью создания некоторого пула дефензинов на фоне оптимального статуса витамина D.
Детальный анализ показал различия в уровнях АМП у детей, прервавших и не прерывавших профилактический курс приема витамина D. В частности, медиана β1-дефензина в группе детей, не прерывавших курс приема витамина D, составила 7,8 (6,63–9,61) пг/мл, в то же время в группе некомплаентных пациентов медиана β1-дефензина составила 7,5 (5,98–8,7) пг/мл. Концентрации β2-дефензина в группе комплаентных детей были статистически значимо выше – 673,0 (504,51–1 876,01) пг/мл (1 021,1 ± 179,96 пг/мл) по сравнению с детьми, прервавшими прием холекальциферола, – 580,0 (454,29–1 046,0) пг/мл (782,2 ± 65,73 пг/мл) (р < 0,05). Анализа частоты заболеваемости ОРИ на фоне пролонгированного приема профилактических доз препаратов холекальциферола демонстрирует следующее.
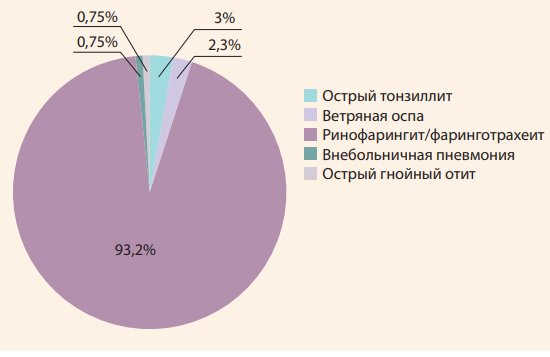
Суммарное число эпизодов ОРИ за 6 мес. исследования в общей группе детей составило 133. За период интервенционной фазы из 72 завершивших исследование пациентов у 51 (70,8%) зарегистрирован хотя бы один эпизод ОРИ. Средняя частота ОРИ на фоне приема препаратов витамина D за 6 мес. после предшествовавшего курса коррекции составила 1,7 ± 0,2 раза. При этом из числа болевших детей большая часть перенесла не более 2 эпизодов ОРИ – 34 (66,7%); до 4 эпизодов ОРИ перенесли 13 (25,5%) детей и более 4 эпизодов – 4 (7,8%) пациента. На рис. 1 представлена структура ОРИ среди болевших в период 6 мес. детей.
Анализ показывает, что более 95% эпизодов ОРИ представлены инфекциями верхних дыхательных путей, преимущественно вирусной этиологии, имевшими неосложненный характер, и лишь в двух (1,5%) случаях ОРИ протекали с осложнениями в виде внебольничной пневмонии и острого среднего гнойного отита.
Рисунок 1. Структура ОРИ среди перенесших заболевание детей
Figure 1. ARI patterns in children, who had a disease
В табл. 2 представлены данные о количестве эпизодов ОРИ у детей раннего возраста на третьем этапе исследования на фоне приема профилактической дозы холекальциферола.
Таблица 2. Распределение пациентов в зависимости от обеспеченности витамином D и частотой эпизодов ОРИ за 6 мес.
Table 2. Distribution of patients according to vitamin D status and frequency of ARI episodes over 6 months
| более 30 нг/мл, n = 61 | 20 (32,8%) | 30 (49,2%) | 10 (16,4%) | 1 (1,6%) |
| 21–30 нг/мл, n = 6 | 1 (16,7%)* | 3 (50,0%) | 2 (33,3%)* | 0 (0%) |
| менее 20 нг/мл, n = 5 | 0 (0%) | 1 (20,0%)* | 1 (20,0%) | 3 (60,0%)** |
Примечание. Статистическая значимость различий с группой оптимального статуса: * р < 0,05. – **p < 0,01.
При сравнительном анализе распространенности ОРИ в группах детей в зависимости от их обеспеченности витамином D выявлено, что в группе с оптимальной обеспеченностью имелось достоверно большее число неболевших по сравнению с группами детей с недостаточностью и дефицитом витамина D в третьей точке исследования.
При этом если число болевших 1–2 раза детей не отличалось в группах с оптимальной и недостаточной обеспеченностью витамином D, то в группе с дефицитом таких детей было существенно меньше. В то же время в группе детей с дефицитом витамина D было достоверно большее число пациентов, переболевших 4 и более раза за период 6 мес.
При этом концентрация 25(ОН)D у ребенка, перенесшего внебольничную пневмонию, находилась в диапазоне выраженного дефицита – 9,2 нг/мл. Ребенок, перенесший ОРИ с осложнением в виде острого гнойного среднего отита, имел несколько лучшие, однако тоже не отвечающие рекомендованным значениям показатели обеспеченности витамином D – 22,4 нг/мл. В целом средний уровень 25(ОН)D среди болевших детей был ниже, хотя и недостоверно, по сравнению с не болевшими за 6 мес. детьми: 48,7 (37,1–68,6) и 51,4 (40,0–79,6) нг/мл соответственно (p = 0,21). Среднее количество эпизодов ОРИ у детей с оптимальным статусом витамина D составило 1 (1–2) за 6 мес. (1,57 ± 0,17 эпизода/6 мес.); у детей с недостаточной обеспеченностью витамином D – 1,5 (0,5–2,5) эпизода (1,5 ± 0,5 эпизода/6 мес.); дети с дефицитом в среднем перенесли 3 (2–4) эпизода ОРИ за полгода исследования (3,0 ± 0,83 раза/6 мес.).
Корреляция между уровнем 25(ОН)D сыворотки и частотой ОРИ у детей раннего возраста составила r = -0,24, p = 0,038. Концентрация β1-дефензина среди неболевших детей была выше по сравнению с пациентами, перенесшими ОРИ за 6 мес., независимо от частоты эпизодов – 4,02 (2,75–6,51) и 3,39 (2,1–7,25) пг/мл (р > 0,05).
Уровни β2-дефензина в группе неболевших детей были также выше, хотя и несущественно: 480,13 (263,84– 915,5) и 477,8 (381,24–642,77) пг/мл (р > 0,05). В табл. 3 представлена сравнительная характеристика значений исследуемых лабораторных параметров в группе болевших детей в зависимости от частоты эпизодов ОРИ за 6 мес.
Таблица 3. Уровень 25(ОН)D и АМП в сыворотке крови у детей с различной частотой ОРИ на фоне профилактического курса приема холекальциферола
Table 3. Serum 25(OH)D and AMP levels in children with different incidence of ARI during the prophylactic course of cholecalciferol supplementation
| 25(ОН)D, нг/мл | 53,8 [43,7–75,5] | 49,1 [37,05–63,6] | 10,53** [9,2–13,6] |
| β1-дефензин, пг/мл | 7,66 [5,1–7,45] | 3,19* [1,64–5,73] | 2,92* [2,34–3,72] |
| β2-дефензин, пг/мл | 568,79 [224,31–1 588,4] | 452,52* [263,84–778,7] | 534,0* [289,0–423,5] |
Примечание. Статистическая значимость различий с группой детей, болевших 1–2 раза: *р < 0,05. – ** p < 0,001.
Анализ полученных данных демонстрирует, что в группе детей, перенесших не более двух эпизодов ОРИ, наблюдаются достоверно большие значения как кальцидиола, так и АМП по сравнению с группами детей, болевшими более 2 раз в течение шестимесячного профилактического курса. В концентрациях β1- и β2-дефензина имелась аналогичная тенденция. Так, при частоте ОРИ 1–2 раза средние концентрации β1- и β2-дефензина составляли 8,8 ± 2,35 и 1 069,0 ± 368,45 пг/мл, что было статистически значимо выше по сравнению со средними значениями АМП в группах болевших 3–4 раза (р = 0,032 и р = 0,034) и более 4 раз (р = 0,05 и р = 0,044).
Очевидно, что снижение концентрации АМП, являющихся важнейшими факторами врожденного иммунитета, происходящее параллельно снижению уровня 25(ОН)D, сопровождается увеличением заболеваемости ОРИ у детей. В целом 10 (7,5%) эпизодов ОРИ у 8 (15,7%) детей потребовали госпитализации в стационар.
При этом концентрации кальцидиола сыворотки у детей, которым потребовалась госпитализация, были несколько ниже, чем у детей, лечившихся в амбулаторных условиях, – 47,8 (38,0–58,8) и 53,4 (49,2–71,4) нг/мл (р > 0,05). Антибактериальную терапию хотя бы один раз за 6 мес. получили 25 (49,0% от числа болевших) детей. Средняя частота приема антибактериальных препаратов в группе болевших детей составила 0,7 ± 0,1 раза/6 мес. На рис. 2 представлено сопоставление частоты использования антибиотиков у детей в зависимости от уровня кальцидиола по итогам исследования.
Рисунок 2. Частота использования антибактериальных препаратов в зависимости от обеспеченности витамином D
Figure 2. The frequency of use of antibiotics depending on the vitamin D status
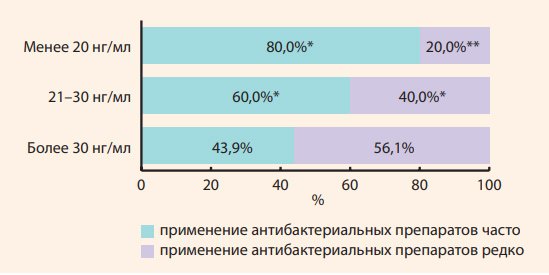
В группе болевших детей с оптимальной обеспеченностью витамином D частота применения антибактериальных препаратов была существенно ниже по сравнению с группами детей с недостаточностью и дефицитом витамина D: в группе детей с концентрацией кальцидиола сыворотки > 30 нг/мл антибиотики получили 18 (43,9%) детей, в то время как в группе с недостаточностью и дефицитом – 3 (60,0%) и 4 (80,0%) человека соответственно (р < 0,05). В табл. 4 представлены результаты сравнительного анализа лабораторных показателей у детей, получавших и не получавших антибактериальную терапию на фоне профилактического курса холекальциферола.
Таблица 4. Концентрации кальцидиола и АМП у получавших и не получавших антибактериальные препараты детей
Table 4. Calcidiol and AMP levels in children, who received and did not receive antibiotics
| 25(ОН)D, нг/мл | 53,0 [43,1–79,6] | 50,0 [38,0–66,8] |
| β1-дефензин, пг/мл | 3,32 [1,8–3,87] | 4,83 [2,52–7,29] |
| β2-дефензин, пг/мл | 450,46 [345,6–607,7] | 713,6 [238,2–825,0] |
Обеспеченность витамином D в группе болевших детей, которым не потребовалась антибактериальная терапия, была несколько лучше по сравнению с группой получавших антибактериальные препараты – 53,0 (43,1–79,6) и 50,0 (38,0–66,8) нг/мл соответственно (р > 0,05). Значимых различий в уровнях АМП между группами детей, получавших и не получавших антибактериальные препараты, не выявлено.
Тем не менее уровни как β1-, так и β2-дефензинов в группе детей, которым потребовалось назначение антибактериальных препаратов, были несколько выше по сравнению с группой детей, где лечение было симптоматическим.
Вполне логичным объяснением также может являться точка зрения, согласно которой инфекции респираторного тракта бактериального генеза являются гораздо более мощными индукторами синтеза АМП, чем вирусы, поэтому в тех клинических ситуациях, когда потребовалось назначение антибиотиков, именно бактериальный возбудитель острого респираторного заболевания служил важным триггером синтеза АМП, вероятно превосходящим по индуцирующему эффекту витамин D.
В некоторых зарубежных исследованиях предлагается использовать повышение уровня АМП в качестве маркера бактериальных инфекций [14, 37].
ЗАКЛЮЧЕНИЕ
Иммунотропные и противоинфекционные эффекты витамина D, активно изучаемые во всем мире в последние десятилетия, являются важнейшими аргументами в пользу сапплементации этим микронутриентом рационов детей и взрослых на всем протяжении жизни. Влияние на врожденный и адаптивный иммунитет, на координацию и предотвращение избыточного иммунного ответа, показанное, в частности, в последние месяцы на примере тяжелых и критических форм течения инфекции COVID-19, должно с точки зрения общественного здоровья гораздо шире использоваться в популяции.
У подавляющего большинства детей при соблюдении комплаенса с помощью профилактического приема препаратов холекальциферола, рекомендованных в национальной программе «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции», возможно поддержание уровня 25(ОН)D в диапазоне от 30 до 100 нг/мл, соответствующем нормальной обеспеченности витамином D.
Продемонстрированные в нашей работе механизмы взаимосвязи повышения и поддержания уровня кальцидиола с продукцией АМП и, как следствие, с частотой респираторных инфекций у детей раннего возраста позволяют утверждать, что регулярный прием профилактических доз витамина D позитивно влияет на заболеваемость в детской популяции. Расширение практики использования профилактического приема витамина D в дошкольном и школьном возрасте, которое необходимо и для реализации кальциемических эффектов (сокращение рисков остеопении и остеопороза), и в еще большей степени для повышения популяционного здоровья, обусловлено некальциемическими эффектами, в частности сокращением инфекционной заболеваемости.
Для поддержания достаточного уровня витамина D у детей предпочтительно использование его в виде холекальферола (витамина D3). Холекальциферол на российском фармацевтическом рынке зарегистрирован как в качестве лекарственных средств, так и в качестве биологических добавок к пище, имеющих различные формы выпуска: масляный и водный раствор, капсулы, таблетки. Удобную форму выпуска холекальциферола представляет собой БАД Детримакс® Бэби. Детримакс® Бэби – это чистый масляный раствор (среднецепочечные триглицериды из кокосового масла), содержащий в одной капле 200 МЕ (5 мкг) холекальциферола.
Особенностью Детримакс® Бэби является специальный помповый дозатор, позволяющий точно и быстро отмерить необходимую дозу витамина D. При дозировании нет необходимости переворачивать флакон, что снижает возможность проливания его содержимого. Помпа-дозатор минимизирует случайное увеличение дозы, что особенно важно у детей младшего возраста.
Дальнейшие исследования, которые проводятся и планируются в ближайшее время, должны стать новыми аргументами для широкого внедрения сапплементации рациона питания холекальциферолом в профилактическую работу детского здравоохранения нашей страны.
Список литературы / References
Holick M.F. Vitamin D: extraskeletal health. Rheum Dis Clin North Am. 2012;38(1):141-160. https://doi.org/10.1016/j.rdc.2012.03.013.- Захарова И.Н., Климов Л.Я., Касьянова А.Н., Курьянинова В.А., Долбня С.В., Иванова А.В. и др. Современные представления об иммунотропных эффектах витамина D. Вопросы практической педиатрии. 2019;14(1):7-17. https://doi.org/10.20953/1817-7646-2019-1-7-17.
- Peelen E., Knippenberg S., Muris A.H., Thewissen M., Smolders J., Telvaert J. et al. Effects of vitamin D on the peripheral adaptive immune system: a review. Autoimmun Rev. 2011;10(12):733-743. https://doi.org/10.1016/j.autrev.2011.05.002.
- Долбня С.В., Дятлова А.А., Климов Л.Я., Кондратьева Е.И., Курьянинова В.А., Цуцаева А.Н. и др. Особенности обеспеченности витамином D детей с муковисцидозом, проживающих на Юге России, в летнее время года. Медицинский вестник Северного Кавказа. 2020;15(2):215-219. https://doi.org/10.14300/mnnc.2020.15051.
- Provvedini D.M., Tsoukas C.D., Deftos L.J., Manolagas S.C. 1,25-dihydroxyvitamin D3 receptors in human leukocytes. Science. 1983;221(4616):1181-1183. https://doi.org/10.1126/science.6310748.
- Carlberg C. Nutrigenomics of vitamin D. Nutrients. 2019;11(3):E676. https://doi.org/10.3390/nu11030676.
- Dankers W., Colin E.M., van Hamburg J.P., Lubberts E. Vitamin D in autoimmunity: molecular mechanisms and therapeutic potential. Front Immunol. 2017;7:697. https://doi.org/10.3389/fimmu.2016.00697.
- Захарова И.Н., Мальцев С.В., Заплатников А.Л., Климов Л.Я., Пампура А.Н., Курьянинова В.А. и др. Влияние витамина D на иммунный ответ. Педиатрия. Consilium Medicum. 2020;(2):29-37. https://doi.org/10.26442/26586630.2020.2.200238.
- Chen Y., Liu W., Sun T., Huang Y., Wang Y., Deb D.K. et al. 1,25- dihydroxyvitamin D promotes negative feedback regulation of TLR signaling via targeting microRNA-155-SOCS1 in macrophages. J Immunol. 2013;190(7):3687-3695. https://doi.org/10.4049/jimmunol.1203273.
- Van der Aar A.M., Sibiryak D.S., Bakdash G., van Capel T.M., van der Kleij H.P., Opstelten D.J. et al. Vitamin D3 targets epidermal and dermal dendritic cells for induction of distinct regulatory T cells. J Allergy Clin Immunol. 2011;127(6):1532-1540. https://doi.org/10.1016/j.jaci.2011.01.068.
- Von Essen M.R., Kongsbak M., Schjerling P., Olgaard K., Odum N., Geisler C. Vitamin D controls T-cell antigen receptor signaling and activation of human T cells. Nat Immunol. 2010;11(4):344-349. https://doi.org/10.1038/ni.1851.
- Мальцев С.В., Мансурова Г.Ш. Витамин D: новое время, новый взгляд. Педиатрия. Журнал им. Г.Н. Сперанского. 2020;99(4):195-200. Режим доступа: https://pediatriajournal.ru/archive?show=377§ion=5968.
- Захарова И.Н., Климов Л.Я., Касьянова А.Н., Ягупова А.В., Курьянинова В.А., Долбня С.В. и др. Роль антимикробных пептидов и витамина D в формировании противоинфекционной защиты. Педиатрия. Журнал им. Г.Н. Сперанского. 2017;96(4):171-179. Режим доступа: https://cyberleninka.ru/article/n/rol-antimikrobnyh-peptidov-i-vitamina-d-v-formirovaniiprotivoinfektsionnoy-zaschity.
- Agier J., Brzezinska-Blaszczyk E. Cathelicidins and defensins regulate mast cell antimicrobial activity. Postepy Hig Med Dosw (Online). 2016;70(0):618-636. https://doi.org/10.5604/17322693.1205357.
- Захарова И.Н., Цуцаева А.Н., Климов Л.Я., Курьянинова В.А., Долбня С.В., Заплатников А.Л. и др. Витамин D и продукция дефензинов у детей раннего возраста. Медицинский совет. 2020;(1):158-169. https://doi.org/10.21518/2079-701X-2020-1-158-169.
- Wang T.T., Nestel F.P., Bourdeau V., Nagai Y., Wang Q., Liao J. et al. Cutting edge: 1,25-dihydroxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J Immunol. 2004;173(5):2909-2012. https://doi.org/10.4049/jimmunol.173.5.2909.
- Woo J.I., Kil S.H., Brough D.E., Lee Y.J., Lim D.J., Moon S.K. Therapeutic potential of adenovirus-mediated delivery of β-defensin 2 for experimental otitis media. Innate Immun. 2015;21(2):215-224. https://doi.org/10.1177/1753425914534002.
- Lee H.Y., Andalibi A., Webster P., Moon S.K., Teufert K., Kang S.H. et al. Antimicrobial activity of innate immune molecules against Streptococcus pneumoniae, Moraxella catarrhalis and nontypeable Haemophilus influenza. BMC Infect Dis. 2004;4:12. https://doi.org/10.1186/1471-2334-4-12.
- Kota S., Sabbah A., Chang T.H., Harnack R., Xiang Y., Meng X., Bose S. Role of human beta-defensin-2 during tumor necrosis factor-alpha/NF-kappa B-mediated innate antiviral response against human respiratory syncytial virus. J Biol Chem. 2008;283(33):22417-22429. https://doi.org/10.1074/jbc.M710415200.
- Aibana O., Huang C.-C., Aboud S., Arnedo-Pena A.C., Becerra M.C., BellidoBlasco J.B. et al. Vitamin D status and risk of incident tuberculosis disease: A nested case-control study, systematic review, and individual-participant data meta-analysis. PLoS Med. 2019;16(9):e1002907. https://doi.org/10.1371/journal.pmed.1002907.
- Gou X., Pan L., Tang F., Gao H., Xiao D. The association between vitamin D status and tuberculosis in children: A meta-analysis. Medicine (Baltimore). 2018;97(35):e12179. https://doi.org/10.1097/MD.0000000000012179.
- Захарова И.Н., Климов Л.Я., Касьянова А.Н., Курьянинова В.А., Долбня С.В., Горелов А.В. и др. Взаимосвязь инфекционной заболеваемости и недостаточности витамина D: современное состояние проблемы. Инфекционные болезни. 2018;16(3):69-78. https://doi.org/10.20953/1729-9225-2018-3-69-78.
- Iftikhar R., Kamran S.M., Qadir A., Haider E., Bin Usman H. Vitamin D deficiency in patients with tuberculosis. J Coll Physicians Surg Pak. 2013;23(10):780-783. https://doi.org/11.2013/jcpsp.780783.
- Sabetta J.R., DePetrillo P., Cipriani R.J., Smardin J., Burns L.A., Landry M.L. Serum 25-hydroxyvitamin d and the incidence of acute viral respiratory tract infections in healthy adults. PLoS One. 2010;5(6):e11088. https://doi.org/10.1371/journal.pone.0011088.
- Berry D.J., Hesketh K., Power C., Hyppönen E. Vitamin D status has a linear association with seasonal infections and lung function in British adults. Br J Nutr. 2011;106(9):1433-1440. https://doi.org/10.1017/S0007114511001991.
- Wayse V., Yousafzai A., Mogale K., Filteau S. Association of subclinical vitamin D deficiency with severe acute lower respiratory infection in Indian children under 5 y. Eur J Clin Nutr. 2004;58(4):563-567. https://doi.org/10.1038/sj.ejcn.1601845.
- Roth D.E., Shah R., Black R.E., Baqui A.H. Vitamin D status and acute lower respiratory infection in early childhood in Sylhet, Bangladesh. Acta Paediatr. 2010;99(3):389-393. https://doi.org/10.1111/j.1651-2227.2009.01594.
- Karatekin G., Kaya A., Salihoğlu Ö., Balci H., Nuhoğlu A. Association of subclinical vitamin D deficiency in newborns with acute lower respiratory infection and their mothers. Eur J Clin Nutr. 2009;63(4):473-477. https://doi.org/10.1038/sj.ejcn.1602960.
- Bergman P., Lindh A.U., Björkhem-Bergman L., Lindh J.D. Vitamin D and respiratory tract infections: a systematic review and meta-analysis of randomized controlled trials. PLoS One. 2013;8(6):e65835. https://doi.org/10.1371/journal.pone.0065835.
- Zhou Y.F., Luo B.A., Qin L.L. The association between vitamin D deficiency and community-acquired pneumonia: A meta-analysis of observational studies. Medicine (Baltimore). 2019;98(38):e17252. https://doi.org/10.1097/MD.0000000000017252.
- Chowdhury R., Taneja S., Bhandari N., Sinha B., Upadhyay R.P., Bhan M.K., Strand T.A. Vitamin-D deficiency predicts infections in young north Indian children: A secondary data analysis. PLoSOne. 2017;12(3):e0170509. https://doi.org/10.1371/journal.pone.0170509.
- Furlong K., Omand J., Pitino M., Science M., O’Connor D., Maguire J., Tran D. Vitamin D status and respiratory tract infections: a systematic review and meta-analysis of observational evidence. FASEB J. 2015;29:252-255. https://doi.org/10.1096/fasebj.29.1_supplement.252.5.
- Lu D., Zhang J., Ma C., Yue Y., Zou Z., Yu C., Yin F. Link between communityacquired pneumonia and vitamin D levels in older patients. Z Gerontol Geriatr. 2018;51(4):435-439. https://doi.org/10.1007/s00391-017-1237-z.
- Pletz M.W., Terkamp C., Schumacher U., Rohde G., Schütte H., Welte T., Bals R. Vitamin D deficiency in community-acquired pneumonia: Low levels of 1,25(OH)2D are associated with disease severity. Respir Res. 2014;15(1):53. https://doi.org/10.1186/1465-9921-15-53.
- Захарова И.Н., Боровик Т.Э., Вахлова И.В., Горелов А.В., Гуменюк О.И., Гусев Е.И. и др. Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции». М.: ПедиатрЪ; 2018. 96 с. Режим доступа: https://eLibrary.ru/item.asp?id=34881251.
- Захарова И.Н., Климов Л.Я., Долбня С.В., Курьянинова В.А., Мальцев С.В., Малявская С.И. и др. Пролонгированный прием холекальциферола - основа эффективной профилактики гиповитаминоза D в раннем возрасте. Медицинский совет. 2020;(10):16-26. https://doi.org/10.21518/2079-701X-2020-10-16-26.
- Georgieva V., Kamolvit W., Herthelius M., Lüthje P., Brauner A., Chromek M. Association between vitamin D, antimicrobial peptides and urinary tract infection in infants and young children. Acta Paediatr. 2019;108(3):551-556. https://doi.org/10.1111/apa.14499.
- Захарова И.Н., Климов Л.Я., Касьянова А.Н., Курьянинова В.А., Долбня С.В., Иванова А.В. и др. Современные представления об иммунотропных эффектах витамина D. Вопросы практической педиатрии. 2019;14(1):7-17. https://doi.org/10.20953/1817-7646-2019-1-7-17.
