
Журнал "Медицинский совет" №1/2023
DOI: 10.21518/ms2022-023
А.Т. Камилова, ORCID: 0000-0003-1695-0978
С.И. Геллер, ORCID: 0000-0002-1210-6633
Д.Х. Дустмухамедова, Л.Х. Насирова
Республиканский специализированный научно-практический медицинский центр педиатрии; 100179, Республика Узбекистан, Ташкент, ул. 2-й Чимбай, проезд Талант, д. 3
Представлен анализ клинического случая ребенка с синдромом дистальной интестинальной непроходимости при муковисцидозе. Пациентка в возрасте 9,5 года поступила в отделение гастроэнтерологии Республиканского специализированного научно-практического медицинского центра педиатрии (Республика Узбекистан) с жалобами на увеличение окружности живота, усиленную перистальтику, слабость, вялость, отеки конечностей, жидкий стул и снижение массы тела. Из анамнеза: у девочки с 6 лет наблюдалась периодическая рвота, не связанная с приемом пищи. В 8 лет состояние ухудшилось, к рвоте присоединилось вздутие живота. По месту жительства был поставлен диагноз «острая кишечная непроходимость; заворот сигмовидной кишки». В течение последующих 6 мес. состояние было относительно удовлетворительным, затем начались нарушения стула – 3–4 раза в день и вздутие живота. Учитывая наличие стеатореи, изменений поджелудочной железы на УЗИ и МСКТ, ребенок направлен к генетику, результат потового теста – 86,0 мЭкв/л. Был поставлен диагноз «муковисцидоз, смешанная форма; синдром дистальной интестинальной обструкции; частичная кишечная непроходимость; белково-энергетическая недостаточность тяжелой степени». Исключены целиакия и ВИЧ. На фоне проводимой терапии состояние ребенка относительно улучшилось. В течение месяца после выписки состояние было удовлетворительным, затем вновь ухудшилось. Через 3 мес. девочка была повторно госпитализирована с теми же жалобами. После консультации хирургов были даны рекомендации о проведении операции в связи с появлением признаков частичной нижнекишечной непроходимости, но родственники подписали добровольный отказ от операции, ребенка под расписку забрали домой. Девочка была выписана с окончательным диагнозом «муковисцидоз, смешанная форма, тяжелое течение; синдром дистальной интестинальной обструкции; частичная нижнекишечная непроходимость; синдром экссудативной энтеропатии; белково-энергетическая недостаточность тяжелой степени». Через 2 нед. после выписки девочка скончалась. Синдром дистальной интестинальной непроходимости может быть неправильно оценен специалистами, не знакомыми с муковисцидозом. Детские гастроэнтерологи и хирурги должны быть насторожены при обнаружении данного состояния в сочетании с другими симптомами, указывающими на муковисцидоз.
Для цитирования: Камилова А.Т., Геллер С.И., Дустмухамедова Д.Х., Насирова Л.Х. Синдром дистальной интестинальной обструкции у ребенка с муковисцидозом. Медицинский совет. 2023;17(1):233–239. https://doi.org/10.21518/ms2022-023.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Согласие пациента на публикацию: получено письменное информированное согласие на использование материалов от матери пациентки.
Distal intestinal obstruction syndrome in a child with cystic fibrosis
Altinoy T. Kamilova, ORCID: 0000-0003-1695-0978
Svetlana I. Geller, ORCID: 0000-0002-1210-6633
Dinora Kh. Dustmukhamedova, Lazokat Kh. Nasirova
Republican Specialized Scientific and Practical Medical Center of Pediatrics; 3, 2nd Chimbay St., Talant Proezd, Tashkent, 100179, Republic of Uzbekistan
The aim of the study – to analyze the clinical case of a child with distal intestinal obstruction syndrome in cystic fibrosis. A 9.5 year old patient was admitted to the Gastroenterology Department of the Republican Specialized Scientific and Practical Center of Pediatrics with complaints of an increase in abdominal circumference, increased peristalsis, weakness, lethargy, swelling in the limbs, loose stools, and weight loss. From the anamnesis: from the age of 6 years it was observed periodic vomiting, not associated with food intake. At the age of 8 years, the condition worsened, bloating joined the vomiting. At the place of residence, the diagnosis was made “Acute intestinal obstruction. Volvulus of the sigmoid colon”. Over the next 6 months, the condition was relatively satisfactory, and then stool disorders began – 3–4 times a day and bloating. Considering the presence of steatorrhea, changes in the pancreas on ultrasound and MSCT, the child was referred to a geneticist, the result of a sweat test was 86.0 mEq/l. The diagnosis was made: Cystic fibrosis, mixed form. Syndrome of distal intestinal obstruction. Partial intestinal obstruction. Severe PEI, celiac disease and HIV were excluded. On the background of the therapy, the child’s condition improved relatively. Within a month after discharge, the condition was satisfactory, and then worsened again. After 3 months, the girl was re-hospitalized with the same complaints. After consulting the surgeons, recommendations were given to perform the operation due to the appearance of signs of partial lower intestinal obstruction, but the relatives signed a voluntary refusal of the operation, the child was taken home against receipt. The girl was discharged with the final diagnosis: Cystic fibrosis, mixed form, severe course. Syndrome of distal intestinal obstruction. Partial lower intestinal obstruction. Syndrome of exudative enteropathy, severe PEI. The girl died 2 weeks after discharge. Distal intestinal obstruction syndrome (DIOS) may be misunderstood by those who are not familiar with cystic fibrosis. Pediatric gastroenterologists, surgeons should be alert when this condition is detected in combination with other symptoms indicating cystic fibrosis.
For citation: Kamilova A.T., Geller S.I., Dustmukhamedova D.Kh., Nasirova L.Kh. Distal intestinal obstruction syndrome in a child with cystic fibrosis. Meditsinskiy Sovet. 2023;17(1):233–239. (In Russ.) https://doi.org/10.21518/ms2022-023.
Conflict of interest: authors declare no conflict of interest.
Basic patient privacy consent: written informed consent for the use of materials was obtained from the patient’s mother.
Введение
Муковисцидоз (МВ), или кистофиброз, поджелудочной железы – это аутосомное заболевание, вызванное мутацией регулятора трансмембранной проводимости МВ-белка канала клеточной мембраны для транспорта хлорид-ионов [1].
МВ поражает множество органов, в том числе желудочно-кишечный тракт, дыхательную систему. Синдром дистальной кишечной непроходимости (синдром дистальной инстестинальной обструкции – СДИО) – редкое осложнение у больных МВ, характеризующееся накоплением вязких каловых масс, прикрепленных к стенке кишечника, в сочетании с липким слизистым секретом, локализующимся в дистальном отделе подвздошной кишки [2, 3].
Рабочая группа ESPGHAN дает определение СДИО как состоянию полной кишечной непроходимости, о чем свидетельствует рвота желчным содержимым, боль в животе и его вздутие. При обследовании тонкой кишки можно увидеть уровни жидкости и воздуха, соответствующие кишечной непроходимости из-за калового сдавления в подвздошно-слепой области [4]. Частота СДИО составляет 23,3–35,5 эпизода на 1000 пациентов с МВ в год [5, 6].
В литературе описано лишь несколько случаев СДИО у детей. Цель этого исследования состоит в том, чтобы сообщить о случае СДИО у 9-летней девочки, диагноз МВ которой был выставлен впервые при поступлении.
Проведенное исследование обобщается в соответствии с рекомендациями SCARE [7].
Клинический случай
Пациентка Н., проживающая в сельской местности Республики Узбекистан, в возрасте 9,5 года поступила в отделение гастроэнтерологии Республиканского специализированного научно-практического медицинского центра педиатрии (РСНПМЦ педиатрии) с жалобами на увеличение окружности живота, усиленную, видимую на глаз перистальтику кишечника, слабость, вялость, отеки на стопах, жидкий стул до 4–5 раз в сутки и снижение массы тела. Из анамнеза: ребенок от 2-й беременности, 2-х родов, родилась в срок с массой тела 3500 г. Кормилась грудью до 1,5 года, часто не болела. Со слов матери, до 6 лет развивалась нормально. В возрасте 6 лет у девочки стала наблюдаться периодическая рвота, 2–3 раза в неделю, не связанная с приемом пищи, склонность стула к запорам. Амбулаторно получала лечение ферментами поджелудочной железы, прокинетиками, но выраженного эффекта от проводимой терапии не было, рвота и тошнота повторялись каждый месяц с промежутком в полгода в возрасте 7 лет. В 8 лет состояние ухудшилось, к рвоте присоединилось выраженное вздутие живота. Девочка госпитализирована в больницу по месту жительства, где был установлен диагноз «острая кишечная непроходимость (низкая); заворот сигмовидной кишки; распространенный серозный перитонит». Была проведена лапаротомия, ход операции неизвестен, выписка не предоставлена. В течение последующих 6 мес. состояние пациентки было относительно удовлетворительным, затем начались нарушения стула – 3–4 раза в день и вздутие живота. Обратились к врачу по месту жительства, был назначен ферментный препарат, однако улучшения не было. За 3 мес. до госпитализации вздутие стало более выраженным, стул постоянно жидкий, девочка была отправлена в Ташкент и госпитализирована в отделение гастроэнтерологии РСНПМЦ педиатрии.
Наследственность: отец был несколько раз прооперирован в связи с повторяющейся непроходимостью кишечника и скончался во время одной из операций в возрасте 35 лет.
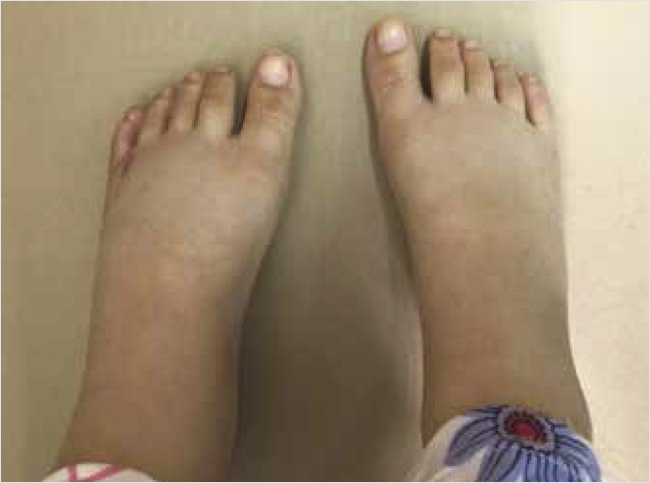
Состояние при поступлении тяжелое, тяжесть обусловлена выраженной нутритивной недостаточностью, вялостью. Масса тела – 25 кг (–1 стандартное отклонение (СО)), рост – 126 см (–1 СО), массо-ростовой индекс – 3 СО по критериям Всемирной организации здравоохранения1. Девочка ослаблена, в контакт вступает неохотно, аппетит снижен. Кожные покровы чистые, бледного цвета, телосложение астеническое. На стопах выраженные отеки (рис. 1).
Рисунок 1. Выраженные отеки на нижних конечностях
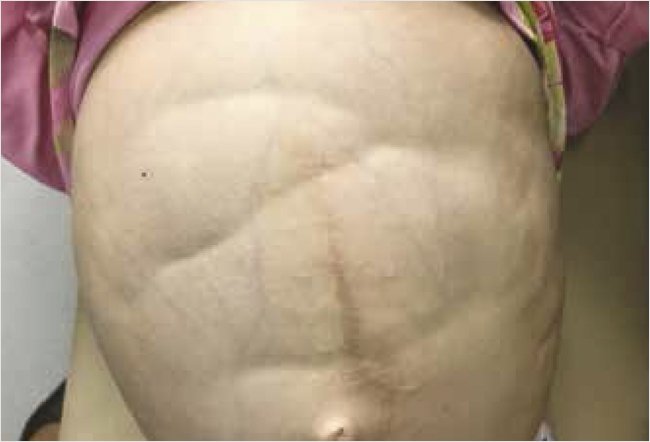
Периферические лимфоузлы увеличены, размером с крупную горошину. Дыхание свободное, кашля нет, в легких аускультативно жесткое дыхание, хрипов нет. Тоны сердца приглушены, аритмичны, частота сердечных сокращений – 88 уд/мин. Живот увеличен в объеме, окружность 85 см, симметричен, участвует в акте дыхания, на передней брюшной стенке послеоперационные рубцы. Живот при пальпации напряжен, видна и слышна на расстоянии перистальтика кишечных петель (рис. 2). В связи с выраженным вздутием живота пальпация печени и селезенки не представлялась возможной. Стул 4 раза в день, жидкий. Диурез не нарушен.
Рисунок 2. Вздутие живота и видимая на расстоянии перистальтика кишечных петель
Диагностический поиск проводился по выявлению причины синдрома мальабсорбции и признаков частичной кишечной непроходимости. В общем анализе крови: анемия легкой степени (гемоглобин 104,0 г/л), лейкоцитоз (10,4 × 109/л), остальные показатели были без патологических изменений. Биохимическое исследование крови установило наличие гипопротеинемии (общий белок 45 г/л) и гипоальбуминемии (альбумин 21 г/л). Значения трансфераз и билирубина были в пределах референсных значений. Общий анализ кала: стеаторея 1-го типа +++, слизь +, лейкоциты 2–3/1. Антитела к тканевой трансглутаминазе были в пределах референсных значений при нормальных показателях иммуноглобулина А (IgA), что позволило исключить диагноз целиакии (антитела к тканевой трансглутаминазе IgA 0,6 Ед/мл, суммарные IgA 6,7 г/л).
Иммуноферментный анализ на вирус иммунодефицита человека показал отрицательный результат. Ультразвуковое исследование (УЗИ) органов брюшной полости: расширение петель кишечника, содержимое кишечника неоднородное, выраженный метеоризм, затрудняющий визуализацию других органов.
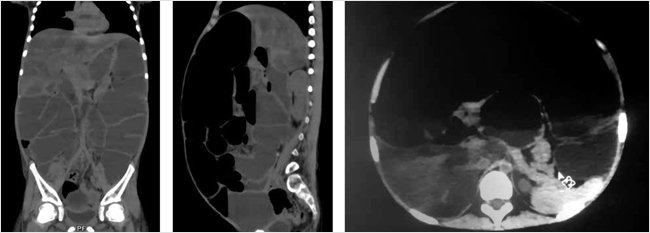
Результаты мультиспиральной компьютерной томографии (МСКТ) (рис. 3) показали следующее. Легочный рисунок усилен, местами деформирован, особенно в проекции нижних долей легких. Бронхиальное дерево проходимо на всем протяжении. Корни легких умеренно расширены, уплотнены. На серии снимков органов грудной клетки и брюшной полости с мультипланарной реконструкцией на коронарном и сагиттальном срезе в абдоминальном окне определяется снижение плотности печени – +28–32 едН. Поджелудочная железа: головка 1,2 см, тело 1,1 см, хвост 1,3 см, однородной структуры, уплотнена. Также отмечается неравномерная гаустрация петель толстого кишечника с дилатацией, множественные горизонтальные уровни с наличием жидкостного содержимого. Отмечается высокое стояние купола диафрагмы. На рисунке с 3D-моделированием также можно увидеть дилатацию петель толстого кишечника (рис. 3).
Рисунок 3. МСКТ-картина реактивных изменений поджелудочной железы, частичной кишечной непроходимости (?)
Учитывая наличие выраженной стеатореи в копрограмме, изменений поджелудочной железы на МСКТ, было решено определить значения хлоридов пота, уровень которых составил 86,0 мЭкв/л, на основании чего был установлен диагноз МВ. К сожалению, генетическое исследование провести не удалось ввиду его высокой стоимости. Значения фекальной эластазы 1 составили 56 мЭкв/л.
Окончательный диагноз имел следующий вид: МВ, смешанная форма; состояние после операции по поводу кишечной непроходимости; безбелковые отеки; астенизация центральной нервной системы; СДИО; осложнение – частичная кишечная непроходимость (?); белково-энергетическая недостаточность тяжелой степени; анемия легкой степени.
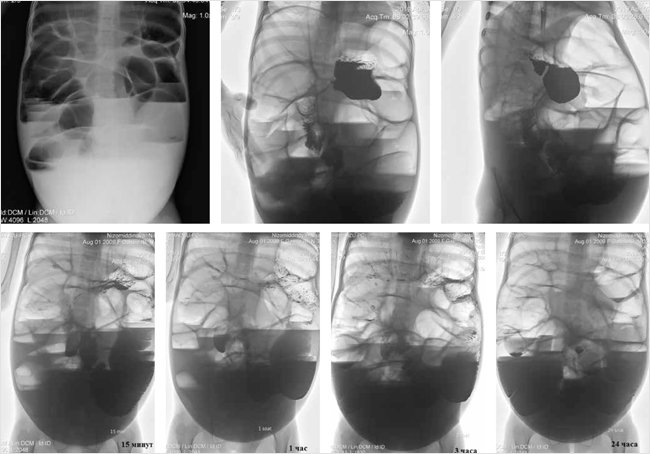
В ходе лечения девочка получила 2 раза 20%-й альбумин по 100 мл, кишечный антисептик нифуроксазид, верошпирон, доза креона была увеличена до 5000 Ед/кг массы тела по липазе, проводилось также частичное парентеральное питание. На фоне проводимой терапии состояние ребенка относительно улучшилось: исчезли отеки, нормализовался стул (1 раз в день, оформленный), окружность живота уменьшилась с 85 до 70 см, живот стал менее напряженным. Пациентка была выписана под наблюдение участкового врача с рекомендациями по соблюдению безглютеновой и безмолочной диеты сроком на 3 мес., применять ферментный препарат поджелудочной железы в дозе 5000 Ед/кг, препараты полиэтиленгликоля (2 г/кг/день), витамины А, Е, D, фолиевую кислоту. В течение месяца после выписки состояние было удовлетворительным, затем вновь ухудшилось в связи с нарушениями диеты и нерегулярным приемом назначенных препаратов. Через 3 мес. девочка была повторно госпитализирована с теми же жалобами. За прошедшее время пациентка потеряла 5 кг массы тела. При поступлении состояние тяжелое, выражены признаки мальабсорбции, отеки на ногах, живот увеличен в объеме, стул жидкий, 3 раза в сутки. В анализах: анемия средней степени (гемоглобин 86 г/л, эритроциты 3,4 × 1012), относительный лимфоцитоз (52%), гипопротеинемия (общий белок 55 г/л), снижение альбумина (29 г/л), гипербилирубинемия за счет прямой фракции (11,6 мкмоль/л), незначительная гиперферментемия (аланинаминотрансфераза 42 U/l, аспартатаминотрасфераза 57 U/l). Анализ кала: стеаторея 1-го и 2-го типа ++. УЗИ брюшной полости: расширение петель кишечника до 6 см, усиленная перистальтика. Был выполнен контрастный рентген-пассаж по желудочно-кишечному тракту (рис. 4). На обзорной рентгенограмме брюшной полости отмечается повышенный интралюминальный газ кишечника. В нижних квадрантах живота отмечаются множественные горизонтальные уровни. Свободный газ не визуализируется. Рентген-признаки толстокишечной непроходимости. Пассаж желудочно-кишечного тракта с барием: рентген-картина частичной кишечной непроходимости. На протяжении исследования сохраняются множественные горизонтальные уровни в просвете кишечника. Контраст также сохраняется в нижней части живота на всех снимках.
Рисунок 4. Рентген картина частичной кишечной непроходимости
Пациентка была проконсультирована хирургом, и были даны рекомендации о проведении операции в связи с появлением признаков частичной нижнекишечной непроходимости, но родственники подписали добровольный отказ от операции и забрали девочку домой под расписку.
Пациентка была выписана с окончательным диагнозом «МВ, смешанная форма, тяжелое течение; СДИО; состояние после операции по поводу кишечной непроходимости; частичная нижнекишечная непроходимость; безбелковые отеки; белково-энергетическая недостаточность тяжелой степени; анемия средней степени».
Через 2 нед. после выписки девочка скончалась.
Обсуждение
СДИО включает обструкцию дистальной части тонкого кишечника утолщенным кишечным содержимым, впервые описан в 1941 г. Rasor и Stevenson, а в 1962 г. Jensen был назван эквивалентом мекониального илеуса (MIE) [8].
В 2010 г. рабочей группой ESPGHAN было дано следующее определение СДИО у пациентов с МВ [9]:
- полная кишечная непроходимость, о чем свидетельствует рвота желчью и (или) уровень жидкости в тонком кишечнике при рентгенографии брюшной полости;
- каловые массы в подвздошной кишке;
- боль и (или) вздутие живота.
Оценки распространенности среди детей колеблются от 5 до 12 эпизодов на 1000 пациентов в год, более высокие показатели отмечаются у взрослых [2, 9].
Нарушение моторики кишечника, его воспаление, мальабсорбция жиров и нарушение секреции ионов и воды в просвете кишечника могут способствовать развитию СДИО. Более 90% пациентов со СДИО страдают недостаточностью поджелудочной железы, 50% имеют в анамнезе меконеальный илеус [10].
Есть несколько факторов, связанных с повышенным риском СДИО: генотип МВ, ассоциированный с тяжелым фенотипом, неадекватное дозирование ферментов поджелудочной железы [9, 11]. Возможное объяснение развития СДИО панкреатической недостаточностью может быть связано с неабсорбированным жиром, который поступает в дистальный отдел подвздошной кишки и тормозит опорожнение желудка, а также продлевает кишечный транзит через активацию подвздошного тормоза и таким образом может индуцировать СДИО [2]. Существует мало доказательств того, что экзокринная недостаточность поджелудочной железы является основной причиной, вызывающей обструкцию, поскольку СДИО также наблюдается у пациентов с нормальной функцией поджелудочной железы [10]. Однако существует исследование, описывающее развитие СДИО при нормальных значениях панкреатической амилазы.
СДИО характеризуется скоплением вязких каловых масс в просвете кишечника в сочетании с липким слизистым кишечным содержимым, спаянным со стенкой терминального отдела подвздошной и слепой кишки. Эта масса прочно связана с криптами и ворсинками, и ее трудно удалить. Во многих случаях это постоянное состояние, иногда усугубляемое скоплением новых фекальных масс, что объясняет прерывистое течение симптомов. СДИО может остро проявляться кишечной непроходимостью или чаще подостро с периодическими болями в животе, как правило, в сочетании со вздутием живота [2]. Еще одним фактором риска СДИО является воспаление кишечника. Возможно, воспаление задерживает время кишечного транзита и способствует развитию кишечной непроходимости [12].
Кроме того, в кишечнике при МВ есть и другие факторы, которые влияют либо на вязкость содержимого просвета, либо на перистальтику кишечника [2] и могут предрасполагать к обструкции или объяснять локализацию обструктивного процесса в терминальном отделе подвздошной кишки. Например, есть убедительные доказательства того, что транзит по кишечнику удлиняется при МВ: это влияет на опорожнение желудка, а также транзит через подвздошную и толстую кишку. Также наблюдается утолщение стенки кишечника. Это затрагивает слизистую оболочку мускулатуры и может быть следствием нарушения моторики и (или) воздействия вязкого кишечного содержимого [13].
Нарушения всасывания желчных кислот могут объяснить локализацию обструктивного процесса. В норме желчные кислоты активно реабсорбируются в терминальном отделе подвздошной кишки через котранспортер, управляемый градиентом натрия, транспортер подвздошной желчной кислоты (IBAT) [2]. Оба эти аспекта функции желчных кислот в кишечнике, стимуляция их секреции и их активное повторное поглощение терминальным отделом подвздошной кишки затрагиваются при МВ и предлагают возможный механизм СДИО и объяснение места поражения в дистальном отделе подвздошной кишки.
Обычная рентгенограмма брюшной полости выполняется для подтверждения СДИО, другие же исследования, такие как УЗИ брюшной полости и КТ, необходимы для дифференциальной диагностики и выявления осложнений [14].
Тактика ведения острых проявлений СДИО различается в зависимости от того, имеется ли у пациента полная или частичная непроходимость. Если у пациентов нет стула или отделения газов через прямую кишку, повторяется рвота или она с желчью, и особенно если присутствуют признаки раздражения брюшины, следует предположить, что у пациента имеется полная непроходимость. В таком случае рекомендуются осмотр хирурга, декомпрессия назогастральным зондом, запрет на прием жидкости или пищи через рот, получение внутривенного доступа и определение жидкостного статуса. В случае полной непроходимости следует очистить пораженные каловые массы снизу с помощью небариевых гиперосмолярных контрастных клизм, таких как гастрографин (меглумина диатризоат, натрия диатризоат) [15]. Обычно требуется большое количество контраста, чтобы достичь желаемой цели свободного рефлюкса в терминальном отделе подвздошной кишки. При отсутствии раздражения брюшины контрастные вещества, не содержащие бария, можно применять два раза в день в течение нескольких дней. Хирургическое вмешательство остается крайней мерой, когда медикаментозное лечение оказывается неэффективным или имеются признаки ишемии кишечника [2].
Если обструкция частичная или неполная, то фармакологическое лечение сосредоточено на регидратации просвета с помощью осмотических слабительных для мобилизации слизи и устранения непроходимости. В европейском обсервационном исследовании лаваж растворами полиэтиленгликоля (ПЭГ), пероральные слабительные (лактулоза, магний-содержащие слабительные) или лечение клизмами с гастрографином со слабительными средствами или без них были эффективны почти у всех пациентов со СДИО, что позволяет использовать ряд подходов [9]. ПЭГ можно вводить через назогастральный зонд в дозе 2 г/кг/день, максимум 80–100 г/день или в виде готового к использованию изоосмотического раствора ПЭГ в дозе 20–40 мл/кг/ч, максимум до 1 л/ч за 8 ч. Цель – добиться оттока фекалий до состояния прозрачной воды и уменьшения боли, вздутия живота и рвоты. Возможно использование per os или через назогастральный зонд гастрографина в дозе 50 мл на 200 мл воды или сока для детей младше 6 лет и 100 мл в 400 мл для пациентов старшего возраста в первый день и половинные дозы в последующие дни, если это потребуется. Клизмы с гипертоническим раствором данного вещества (100 мл, четырехкратно разведенные в воде) могут быть полезны, когда непроходимость кишечника более дистальна и не улучшается при энтеральной терапии [16].
Особое внимание уделяется профилактике повторных эпизодов СДИО путем повторного информирования пациентов о важности соблюдения режима заместительной ферментной терапии при каждом приеме пищи и перекусе, а также о необходимости ежедневной дефекации. Пероральный ПЭГ от 0,5–1 г/кг/день до максимума 40 г/день в течение 6–12 мес. является лучшим выбором. Лактулоза также широко используется, но она может вызывать боль в животе и метеоризм, особенно в высоких дозах [16].
Другие меры включают коррекцию сосуществующего избыточного бактериального роста в тонкой кишке и возможное использование лубипростона в рефрактерных случаях у взрослых пациентов. Предполагается, что лубипростон работает путем активации хлоридных каналов 2-го типа в желудочно-кишечном тракте, что увеличивает содержание жидкости и сокращает время транзита [16]. В нашем случае из-за нерегулярности приема ПЭГ исход заболевания был неблагоприятным.
Рецидив СДИО может возникнуть у 77% пациентов, поэтому рекомендуется поддерживающая терапия во избежание новых эпизодов. Для предотвращения рецидива предлагается использовать пероральное осмотическое слабительное, ПЭГ или лактулозу с N-ацетилцистеином или смазывающее слабительное, такое как минеральное масло [3, 17].
Заключение
Таким образом, детские гастроэнтерологи, хирурги, педиатры должны быть насторожены при обнаружении состояния СДИО в сочетании с другими симптомами, указывающими на МВ. СДИО может быть диагностирован на основании анамнеза и рентгенографического изображения брюшной полости, но КТ часто используется, чтобы отличить его от хирургических причин болей в животе, включая аппендицит. Не существует единой проверенной стратегии лечения или профилактики СДИО у пациентов с МВ. По возможности необходимо проводить консервативную терапию, оставляя оперативное вмешательство крайней мерой, так как каждая операция увеличивает риск повторного СДИО в будущем.
1 WHO Multicentre Growth Reference Study (MGRS). Available at: https://www.who.int/.
Список литературы / References
- Green J., Carroll W., Gilchrist F.J. Interventions for treating distal intestinal obstruction syndrome (DIOS) in cystic fibrosis. Cochrane Database Syst Rev. 2018;8(8):CD012798. doi: 10.1002/14651858.cd012798.pub2.
- Colombo C., Ellemunter H., Houwen R., Munck A., Taylor C., Wilschanski M. Guidelines for the diagnosis and management of distal intestinal obstruction syndrome in cystic fibrosis patients. J Cyst Fibros. 2011;10(Suppl. 2):S24–28. doi: 10.1016/S1569-1993(11)60005-2.
- Munck A., Alberti C., Colombo C., Kashirskaya N., Ellemunter H., Fotoulaki M. et al. International prospective study of distal intestinal obstruction syndrome in cystic fibrosis: Associated factors and outcome. J Cyst Fibros. 2016;15(4):531–539. doi: 10.1016/j.jcf.2016.02.002.
- Houwen R.H., van der Doef H.P., Sermet I., Munck A., Hauser B., Walkowiak J. et al. Defining DIOS and constipation in cystic fibrosis with a multicentre study on the incidence, characteristics, and treatment of DIOS. J Pediatr Gastroenterol Nutr. 2010;50(1):38–42. doi: 10.1097/MPG.0b013e3181a6e01d.
- Andersen H.O., Hjelt K., Waever E., Overgaard K. The age-related incidence of meconium ileus equivalent in a cystic fibrosis population: the impact of high-energy intake. J Pediatr Gastroenterol Nutr. 1990;11(3):356–360. doi: 10.1097/00005176-199010000-00012.
- Van der Doef H.P., Kokke F.T., van der Ent C.K., Houwen R.H. Intestinal obstruction syndromes in cystic fibrosis: meconium ileus, distal intestinal obstruction syndrome, and constipation. Curr Gastroenterol Rep. 2011;13(3):265–270. doi: 10.1007/s11894-011-0185-9.
- Agha R.A., Fowler A.J., Saeta A., Barai I., Rajmohan S., Orgill D.P. The SCARE Statement: Consensus-based surgical case report guidelines. Int J Surg. 2016;34:180–186. doi: 10.1016/j.ijsu.2016.08.014.
- Minkes R.K., Langer J.C., Skinner M.A., Foglia R.P., O’Hagan A., Cohen A.H. et al. Intestinal obstruction after lung transplantation in children with cystic fibrosis. J Pediatr Surg. 1999;34(10):1489–1493. doi: 10.1016/s0022-3468(99)90110-0.
- Houwen R.H., van der Doef H.P., Sermet I., Munck A., Hauser B., Walkowiak J. et al. Defining DIOS and constipation in cystic fibrosis with a multicentre study on the incidence, characteristics, and treatment of DIOS. J Pediatr Gastroenterol Nutr. 2010;50(1):38–42. doi: 10.1097/MPG.0b013e3181a6e01d.
- Kelly T., Buxbaum J. Gastrointestinal Manifestations of Cystic Fibrosis. Dig Dis Sci. 2015;60(7):1903–1913. doi: 10.1007/s10620-015-3546-7.
- Dray X., Bienvenu T., Desmazes-Dufeu N., Dusser D., Marteau P., Hubert D. Distal intestinal obstruction syndrome in adults with cystic fibrosis. Clin Gastroenterol Hepatol. 2004;2(6):498–503. doi: 10.1016/s1542-3565(04)00169-7.
- Werlin S.L., Benuri-Silbiger I., Kerem E., Adler S.N., Goldin E., Zimmerman J. et al. Evidence of intestinal inflammation in patients with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2010;51(3):304–308. doi: 10.1097/MPG.0b013e3181d1b013.
- Gelfond D., Borowitz D. Gastrointestinal complications of cystic fibrosis. Clin Gastroenterol Hepatol. 2013;11(4):333–342. doi: 10.1016/j.cgh.2012.11.006.
- Sandy N.S., Lomazi E.A. Incomplete Distal Intestinal Obstruction Syndrome Complicated by Oligosymptomatic Intussusception. ACG Case Rep J. 2018;5:e53. doi: 10.14309/crj.2018.53.
- O’Halloran S.M., Gilbert J., McKendrick O.M., Carty H.M., Heaf D.P. Gastrografin in acute meconium ileus equivalent. Arch Dis Child. 1986;61(11):1128–1130. doi: 10.1136/adc.61.11.1128.
- O’Brien C.E., Anderson P.J., Stowe C.D. Lubiprostone for constipation in adults with cystic fibrosis: a pilot study. Ann Pharmacother. 2011;45(9):1061–106. doi: 10.1345/aph.1Q219.
- Holsclaw D.S., Rocmans C., Shwachman H. Intussusception in patients with cystic fibrosis. Pediatrics. 1971;48(1):51–58. Available at: https://pubmed.ncbi.nlm.nih.gov/.