Журнал "Медицинский совет" №10/2023
DOI: 10.21518/ms2023-186
А.А. Кулеш 1,2, А.В. Белопасова3, Д.А. Демин 4, С.А. Мехряков 2, Л.И. Сыромятникова 1,2, О.И. Виноградов5
1 Пермский государственный медицинский университет имени академика Е.А. Вагнера; 614000, Россия, Пермь, ул. Петропавловская, д. 26
2 Городская клиническая больница № 4; 614107, Россия, Пермь, ул. КИМ, д. 2
3 Научный центр неврологии; 125367, Россия, Москва, Волоколамское шоссе, д. 1
4 Федеральный центрально-сосудистой хирургии; 414004, Россия, Астрахань, ул. Покровская Роща, д. 4
5 Национальный медико-хирургический центр имени Н.И. Пирогова; 105203, Россия, Москва, ул. Нижняя Первомайская, д. 70
Криптогенный эмболический инсульт (эмболический инсульт неустановленного возникновения, ESUS) представляет собой промежуточный диагноз у пациентов с неизвестной этиологией инсульта и наличием больших источников кардиоэмболии и значительных экстра- и интракраниальных стенозов и вероятный эмболический патогенез обнаружения сердца. В предыдущих частях статьи мы обсудили вопросы диагностики и вторичной профилактики при ESUS на фоне аорто-аортальных источников эмболии, парадоксальной эмболии и предсердной кардиопатии. В рамках рассмотрения вопросов эпидемиологии, патогенеза, диагностики и вторичной профилактики ишемического инсульта на фоне антифосфолипидного синдрома (АФС) и раково-ассоциированного инсульта (РАИ). Оба механизма инсульта обнаруживаются гиперкоагуляцией, часто проявляются многоочаговыми нарушениями коры головного мозга и нарушениями при терапии антикоагулянтами. Затем как АФС следует подозревать в первую очередь у молодых женщин с патологией беременности, артериальными и венозными тромбозами, а также с сетчатым ливедо (livedo reticularis) гроздевидным (racemosa), РАИ не имеет специфической клинической картины, однако может манифестировать выявленными кортикальными инфарктами (симптом трех бассейнов) в завышении с повышением уровня Д-димера. При подозрении на АФС необходим соответствующий гематологический скрининг с последующим применением Сиднейских диагностических проявлений. Диагноз возможного РАИ часто требует проведения чреспищеводной эхокардиографии (исключение небактериального тромбэндокардита) и онкопоиска. Вторичная профилактика АФС соблюдается в наблюдениях варфарина с целевым МНО 2,0–3,0. При РАИ используются антикоагулянты, при этом выбор препарата и дозы определяются балансом тромботических / тромбоэмболических и геморрагических рисков.
Для цитирования:
Кулеш А.А., Белопасова А.В., Демин Д.А., Мехряков С.А., Сыромятникова Л.И., Виноградов О.И. Криптогенный инсульт. Часть 4: Антифосфолипидный синдром и рак. Медицинский Совет. 2023;(10):21–31. https://doi.org/10.21518/ms2023-186
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Cryptogenic stroke. Part 4: Antiphospholipid syndrome and cancer
Aleksey A. Kulesh 1,2, Anastasia V. Belopasova3, Dmitry A. Demin 4, Sergey A. Mekhryakov 2,
Lyudmila I. Syromyatnikova1,2, Oleg I. Vinogradov 5
1 Vagner Perm State Medical University; 26, Petropavlovskaya St., Perm, 614990, Russia
2 City Clinical Hospital No. 4; 2, KIM St., Perm, 614107, Russia
3 Research Center of Neurology; 80, Volokolamskoe Shosse, Moscow, 125367, Russia
4 Federal Center for Cardiovascular Surgery; 4, Pokrovskaya Roshcha St., Аstrakhan, 414011, Russia
5 National Medical and Surgical Center named after N.I. Pirogov; 70, Nizhnyaya Pervomayskaya St., Moscow, 105203, Russia
Cryptogenic embolic stroke (embolic strokes of undetermined source, ESUS) is an intermediate diagnosis in patients with unknown etiology of stroke and implies the absence of large sources of cardioembolism and significant extra- and intracranial stenoses and probably embolic pathogenesis of cerebral infarction. In the previous parts of the article, we discussed the issues of diagnosis and secondary prevention of ESUS with underlying potential aortoaortic sources of embolism, paradoxical embolism and atrial cardiopathy. This article discusses the issues of epidemiology, pathogenesis, diagnosis and secondary prevention of ischemic stroke with underlying antiphospholipid syndrome (APS) and cancer-associated stroke (RAI). Both mechanisms of stroke are associated with hypercoagulability, often manifest as multifocal cortical brain lesions, and respond to anticoagulant therapy. While APS should be suspected primarily in young women with pathology of pregnancy, arterial and venous thrombosis, as well as livedo reticularis (racemosa), RAI does not have a specific clinical picture, but can manifest as diffuse cortical infarcts (symptom of three pools) combined with increased D-dimer level. If APS is suspected, appropriate haematological screening is required, followed by the use of the Sydney diagnostic criteria. Possible diagnosis of RAI often requires transesophageal echocardiography (ruling out non-bacterial thromboendocarditis) and oncological screening. Secondary prevention of APS consists in prescribing warfarin with the target international normalized ratio (INR) of 2.0 to 3.0. RAI is treated with anticoagulants, but the choice of a drug and dose is determined by the balance between thrombotic/thromboembolic and hemorrhagic risks.
For citation: Kulesh A.A., Belopasova A.V., Demin D.A., Mekhryakov S.A., Syromyatnikova L.I., Vinogradov O.I. Cryptogenic stroke. Part 4: Antiphospholipid syndrome and cancer. Meditsinskiy Sovet. 2023;17(10):21–31. (In Russ.) https://doi.org/10.21518/ms2023-186.
Conflict of interest: the authors declare no conflict of interest.
Введение
Криптогенный эмболический инсульт (эмболические инсульты неустановленного происхождения, ESUS) представляет собой промежуточный диагноз у пациентов с неизвестной этиологией инсульта и наличием больших источников кардиоэмболии и значительных экстрах- и интракраниальных стенозов и вероятный эмболический патогенез поражения головного мозга [1]. В предыдущих частях статьи мы обсудили вопросы диагностики и вторичной профилактики при ЭУЗИ на фоне аорто-аортальных источников эмболии [2], парадоксальной эмболии [3] и предсердной кардиопатии [4]. В рамках настоящей публикации будут рассмотрены особенности диагностики и вторичной профилактики ESUS при антифосфолипидном синдроме (АФС) и злокачественных новообразованиях.
Антифосфолипидный синдром
АФС представляет собой системное аутоиммунное нарушение, характеризующееся выработкой патогенетически значимых антифосфолипидных антител (аФЛ) с возможным протромботическим состоянием, проявляющимся тромбозами и акушерской патологией. Формирование наблюдений АФС и его измерении относится к 80-м годам. прошлого века, когда были разработаны и внедрены в клинику радиоиммунный и иммуноферментный методы определения антител к кардиолипину (аКЛ) [5–7]. В нашей стране изучение неврологических аспектов синдрома впервые было начато также в конце 80-х годов в НИИ ревматологии РАМН в тесном сотрудничестве с НИИ неврологии РАМН (в настоящее время Научный центр неврологии). Профессор Л.А. Калашниковой сохранены высокие достижения в области патогенеза, методов лечения и лечения данных заболеваний [8]. АФС может быть первичным (самостоятельно заболевшим) или вторичным – возникать на фоне другого аутоиммунного заболевания, чаще всего системной красной волчанки (СКВ). АФС встречается у 36% пациентов с СКВ и 5% у пациентов с волчаночноподобным синдромом [9]. Исследование 1000 пациентов с СКВ в течение 10 лет показало, что общая смертность повысилась на 4,5%, наиболее частыми случаями явились активная СКВ (28,9%), инфекция (28,9%) и тромбозы (26,7%) [10]. ].
Эпидемиология. Согласно эпидемиологическим исследованиям, проведенным среди населения США и Италии, распространенность АФС в популяции в пределах от 17–50 человек на 100 тыс. населения, ежегодная заболеваемость − 2,1 человека на 100 тыс. населения в год [11]. Как и другие аутоиммунные ревматические заболевания, АФС чаще встречается у женщин, чем у мужчин (соотношение 5 : 1 обычно), развивается в среднем возрасте (около 35 лет). При вторичном АФС соотношение женщин и мужчин составляет 7,5 : 1, а при первичном – 3,5 : 1 [9, 12].
Патогенез. Антифосфолипидные антитела встречаются у гетерогенной группы аутоиммунных классов IgG и IgM, действие направлено против основных компонентов клеточных мембран – фосфолипидов, а также фосфолипид-связывающих белков [13]. Тесты на выявление аФЛ (входят в определение АФС) Включают иммуноферментный анализ (ИФА) на антитела к кардиолипину (анти-КЛ; IgG или IgM), ИФА на антитела к бета2-гликопротеину (анти-бета2ГП; IgG или IgM) и анализ на волчаночный антикоагулянт (ВА). Существуют и другие аФЛ, не включенные в определение АФС (например, антитела, направленные против протромбина, фосфатидилсерина или фосфатидилинозитола), которые не выделяются из-за обусловленности стандартизированными тестами и неопределенностью их клинической заболеваемости [14]. Основой тромбообразования при АФС является способность воздействовать на большинство процессов регуляции гемостаза, изменение которых проявляется гиперкоагуляцией. Нарушение коагуляционного каскада, взаимодействие с тромбоцитами, моноцитами и эндотелием сосудов, передача к инактивации системы естественного антикоагулянта протеина С; активация тканевого воспаления, которое инициирует тромбообразование; повышенному выделению активатора тканевого плазминогена; усиление агрегации тромбоцитов; выделение провоспалительных цитокинов; экспрессии молекул адгезии эндотелием, а также некоторым другим изменениям в системе коагуляции, развитию артериальных и венозных тромбозов [15–17]. взаимодействие с тромбоцитами, моноцитами и эндотелием сосудов, приводящих к инактивации системы естественного антикоагулянта протеина С; активация тканевого воспаления, которое инициирует тромбообразование; повышенному выделению активатора тканевого плазминогена; усиление агрегации тромбоцитов; выделение провоспалительных цитокинов; экспрессии молекул адгезии эндотелием, а также некоторым другим изменениям в системе коагуляции, развитию артериальных и венозных тромбозов [15–17]. взаимодействие с тромбоцитами, моноцитами и эндотелием сосудов, приводящих к инактивации системы естественного антикоагулянта протеина С; активация тканевого воспаления, которое инициирует тромбообразование; повышенному выделению активатора тканевого плазминогена; усиление агрегации тромбоцитов; выделение провоспалительных цитокинов; экспрессии молекул адгезии эндотелием, а также некоторым другим изменениям в системе коагуляции, развитию артериальных и венозных тромбозов [15–17].
Критерии диагностики. В соответствии с пересмотром на 11-м Международном конгрессе по аФЛ в 2006 г. в Сиднее диагностическими критериями АФС (Сиднейские критерии) [18] является рядом крупных и лабораторных признаков. Диагноз АФС пациентов, которые составляют не менее одного из наблюдаемых и не менее одного из лабораторных приемов (табл. 1).
Таблица 1. Сиднейские диагностические характеристики антифосфолипидного синдрома
Критерии | Описание |
Клинические | |
Сосудистый тромбоз | Один или несколько эпизодов тромбоза вен, артерий или мелких сосудов (периферические венозные тромбозы, инфаркт, ишемический инсульт, инфаркт внутренних органов и т. д.), объективизированные визуализационными (ультразвуковое исследование, ангиография) или гистологическими методами |
Акушерская патология | – Необъяснимая гибель плода (≥1) после 10 нед. беременности при отсутствии его морфологической оценки по данным ультразвукового исследования или морфологии. – Передвременные роды (≥1) – до 34-й нед. беременность из-за эклампсии (тяжелой преэклампсии) или плацентарной недостаточности при морфологически нормальном плоде. – Повторные (≥3) спонтанные аборты (до 10 нед. беременности) при отсутствии хромосомных аномалий, гормональной или анатомической болезни у матери |
Лабораторные | |
Наличие позитивных аФЛ 2 или более исследований с интервалом не менее 12 нед. | – Положительного ВА, исследованного в соответствии с рекомендациями Международного общества по тромбозам и гемостазу. – Положительных анти-КЛ IgG и/или IgM в умеренном или высоком титре (>40 единиц GPL или MPL, соответственно, или титр >99-го процентиля для диагностической лаборатории), измеренных со стандартизированным ИФА (ELISA). – Положительных анти-бета2ГП IgG и/или IgM в умеренном или высоком титре (>40 единиц GPL или MPL, соответственно, или титр >99-го процентиля для диагностической лаборатории), измеренных с помощью стандартизированного ИФА (ELISA) |
Начальное лабораторное тестирование обычно проводится после клинических событий – тромбоза или неблагоприятного исхода беременности. Однако в случае положительного результата предполагаемое тестирование выполняется не ранее, чем через 3 месяца после начала, поскольку острое тромботическое событие может показаться ложной нормализации активированного частичного тромбопластинового времени (АЧТВ) и, соответственно, результаты анализа ВА. Удлинение АЧТВ на фоне лечения антикоагулянтами прямого и непрямого действия приводит к получению ложноположительного результата на ВА. Таким образом, проведение тестов на ВА у пациентов, принимающих антикоагулянты, нецелесообразно. На иммунологические анализы (аКЛ или анти-бета2ГП) острые тромботические явления или антикоагулянты исследование не оказывает. У пациентов с первоначальным назначением теста на аФЛ тестирование следует проводить через ≥12 недель, подтверждая наличие персистирующих аФЛ или ВА. Временно повышенные уровни аФЛ несут с собой выработку антител в ответ на инфекционное (бактериальный сепсис, сифилис, боррелиоз, туберкулез, инфекционный эндокардит, стрептококковая инфекция; гепатиты А и В, цитомегаловирус, опоясывающий герпес, вирус Эпштейна – Барр и коронавирус-ассоциированный тяжелый очаг респираторный синдром 2 (SARS-CoV-2) и прочее) или злокачественное заболевание (солидные опухоли легких, толстой кишки, шейки матки, предстательной железы, почек, яичников, молочной железы и костей; первичный миелофиброз, истинная полицитемия; миелоидные и лимфоцитарные лейкозы ) [19, 20], а также прием лекарственных средств ( для обнаружения персистирующих аФЛ или ВА. Временно повышенные уровни аФЛ несут с собой выработку антител в ответ на инфекционное (бактериальный сепсис, сифилис, боррелиоз, туберкулез, инфекционный эндокардит, стрептококковая инфекция; гепатиты А и В, цитомегаловирус, опоясывающий герпес, вирус Эпштейна – Барр и коронавирус-ассоциированный тяжелый очаг респираторный синдром 2 (SARS-CoV-2) и прочее) или злокачественное заболевание (солидные опухоли легких, толстой кишки, шейки матки, предстательной железы, почек, яичников, молочной железы и костей; первичный миелофиброз, истинная полицитемия; миелоидные и лимфоцитарные лейкозы ) [19, 20], а также прием лекарственных средств ( для обнаружения персистирующих аФЛ или ВА. Временно повышенные уровни аФЛ несут с собой выработку антител в ответ на инфекционное (бактериальный сепсис, сифилис, боррелиоз, туберкулез, инфекционный эндокардит, стрептококковая инфекция; гепатиты А и В, цитомегаловирус, опоясывающий герпес, вирус Эпштейна – Барр и коронавирус-ассоциированный тяжелый очаг респираторный синдром 2 (SARS-CoV-2) и прочее) или злокачественное заболевание (солидные опухоли легких, толстой кишки, шейки матки, предстательной железы, почек, яичников, молочной железы и костей; первичный миелофиброз, истинная полицитемия; миелоидные и лимфоцитарные лейкозы ) [19, 20], а также прием лекарственных средств ( сифилис, боррелиоз, туберкулез, инфекционный эндокардит, стрептококковая инфекция; гепатит А и В, цитомегаловирус, опоясывающий герпес, вирус Эпштейна – Барр и коронавирус-ассоциированный тяжелый острый респираторный синдром 2 (SARS-CoV-2) и прочее) или злокачественное заболевание (солидные опухоли легких, толстой кишки, шейки матки, предстательной железы) , почек, яичников, молочной железы и костей, первичный миелофиброз, истинная полицитемия, миелоидные и лимфоцитарные лейкозы) [19, 20], а также прием лекарственных средств ( сифилис, боррелиоз, туберкулез, инфекционный эндокардит, стрептококковая инфекция; гепатит А и В, цитомегаловирус, опоясывающий герпес, вирус Эпштейна – Барр и коронавирус-ассоциированный тяжелый острый респираторный синдром 2 (SARS-CoV-2) и прочее) или злокачественное заболевание (солидные опухоли легких, толстой кишки, шейки матки, предстательной железы) , почек, яичников, молочной железы и костей, первичный миелофиброз, истинная полицитемия, миелоидные и лимфоцитарные лейкозы) [19, 20], а также прием лекарственных средств ( шейки матки, предстательной железы, почек, яичников, молочной железы и костей; первичный миелофиброз, истинная полицитемия; миелоидные и лимфоцитарные лейкозы) [19, 20], а также прием лекарственных средств ( шейки матки, предстательной железы, почек, яичников, молочной железы и костей; первичный миелофиброз, истинная полицитемия; миелоидные и лимфоцитарные лейкозы) [19, 20], а также прием лекарственных средств (хлорпромазин , фенитоин , прокаинамид , альфа-интерферон, амоксициллин , пропранолол , пероральные контрацептивы и др.) [19, 21]. Пациенты с тройным диагнозом АФК (т. е. Наличие ВА, анти-КЛ и анти-бета2ГП) имеют самый высокий риск развития рецидивирующих тромбозов [22].
В клиническом анализе крови у пациентов с АФС может наблюдаться умеренная тромбоцитопения с тромбоцитами в снижении от 100 000 до 140 000 в мкл [23], в биохимическом анализе – повышение уровня креатинина в случае выявления заболевания (особенно при АФС на фоне СКВ). Важным является определение исходного уровня протромбинового времени (ПВ) и АЧТВ до антикоагулянтной терапии, особенно если эти стадии в развитии будут использованы для мониторинга антикоагулянтной терапии и исследования ВА.
Клиническая картина. Артериальные тромбозы, приводящие к ишемическим инсультам (ИИ), транзиторным ишемическим атакам (ТИА) и сосудистой деменции, являются серьезными неврологическими проявлениями АФС. Доля ИИ в группе цереброваскулярных групп при АФС достигает 90%, причем в 2/3 случаев он является наиболее многочисленной группой цереброваскулярных групп при АФС. ИИ и ТИА в большинстве случаев проявляются в молодом (18–45 лет) возрасте, значительно уменьшаются в детском или пожилом возрасте. ИИ чаще развиваются у женщин (81%), при этом провоцирующими факторами часто являются гормональные изменения - беременность, послеродовый период, дисменорея, преклимакс, играющие роль в реализации прокоагулянтного состояния [8, 15].
ИИ развивается в различных сосудистых бассейнах, чаще всего в бассейне средней мозговой артерии. Отличительной особенностью инсультов при АФС является их сочетание с поражением интракраниальных, а не экстракраниальных артерий. Кроме того, характерна склонность к рецидивам и сочетанию с ТИА, что обнаруживается у больных прокоагулянтного состояния [15, 24]. механизмом развития ИИ и ТИА при АФС является тромбоз артерий мозга, острое гиперкоагуляционное состояние, индуцированного выработкой аФЛ. Обсуждается роль воздействия клапанов сердца − утолщения и/или узловых вегетаций митрального, реже аортального клапанов (небактериальный тромботический эндокардит Либмана – Сакса) [25, 26].
В контексте АФС синдрома синдрома Снеддона [27], характеризующимся сочетанием 2 признаков – цереброваскулярных объединений и распространенного ливедо – (livedo reticularis или Livedo racemosa) – неравномерной синюшной окраской кожи за счет сетчатого рисунка промывающихся волокон. В конце 80-х гг. 20 в. профессором Л.А. Калашниковой впервые в мире было показано, что выявлены цереброваскулярные нарушения и ливедо у части больных с синдромом Снеддона, имеющиеся и другие системные и неврологические проявления. К ним относятся кардиальная патология (поражение клапанов сердца, ишемическая болезнь сердца), периферические венозные тромбозы, тромбоцитопения, изменения почек (легкая протеинурия, изменение мочевого осадка), внутриутробная гибель плода или спонтанные аборты, головные боли, эпилептические припадки и др. − спектр проявлений, аналог АФС [28]. Несмотря на клиническое сходство синдрома Снеддона и АФС, аФЛ (аКЛ, ВА, анти-бета2ГП) встречается примерно у полов с синдромом Снеддона – серонегативный вариант АФС [29].
Клинический пример синдрома Снеддона представлен на рис. 1. Пациентка 46 лет. Анамнез трудно собрать по случайным случаям когнитивных расстройств. Насколько известно, в течение нескольких лет у пациентов наблюдаются когнитивные функции. На протяжении 2–3 лет наблюдаются эпилептические приступы. Из 6 беременностей 5 невыношенных. При объективном осмотре обращает внимание широко распространенное ливедо рацемоза. При нейропсихологическом тесте выявлены нарушения регуляторных функций, а также легкая дисфазия, дислексия и дискалькулия; память при этом сохранна. Проведена МРТ головного мозга, визуализируются последствия инфарктов мозга и гиперинтенсивность белков в пораженных полушариях, а также церебральные микрокровоизлияния. По данным МР-ангиографии, внутримозговые артерии проходимы. При появлении трансторакальной эхокардиографии возникло подозрение на миксоматозные изменения митрального клапана, которые визуализируются при чреспищеводной эхокардиографии. Скрининг на АФС продемонстрировал возможные результаты: антитела к кардиолипину 1,4 МЕ/мл (норма), антитела к бета-2-гликопротеину 9,9 МЕ/мл (верхняя граница нормы), волчаночный антикоагулянт не обнаружен. Концентрация Д-димера 50 нг/мл (норма), протеина С 70% (норма), антитромбина III 88% (норма). Установлен серонегативный вариант синдрома Снеддона, с последующей профилактикой варфарина. 9 МЕ/мл (верхняя граница нормы), волчаночный антикоагулянт не обнаружен. Концентрация Д-димера 50 нг/мл (норма), протеина С 70% (норма), антитромбина III 88% (норма). Установлен серонегативный вариант синдрома Снеддона, с последующей профилактикой варфарина. 9 МЕ/мл (верхняя граница нормы), волчаночный антикоагулянт не обнаружен. Концентрация Д-димера 50 нг/мл (норма), протеина С 70% (норма), антитромбина III 88% (норма). Установлен серонегативный вариант синдрома Снеддона, с последующей профилактикой варфарина.
По мере прогрессирования заболеваний в период отсутствия случая лечения у пациентов нарастают когнитивные нарушения, связанные с образованием множественных микроинфарктов в коре и возникновением случаев заболевания головного мозга. Следствием мультиинфарктного состояния становится разобщение функционально-значимых зон коры больших полушарий и нарушение высших корковых функций. Признаки когнитивного дефицита могут измеряться от наблюдаемой когнитивной дисфункции до стойкой деменции [30].
Нарушение венозного кровоснабжения мозга при АФС встречается редко. Тромбоз венозных синусов головного мозга и церебральных вен в широкой цереброваскулярной группе при АФС составляет не более 3% [8]. К другим неврологическим проявлениям АФС, обусловленным не тромбозами, а, наиболее вероятно, иммунологически опосредованным поражением вещества головного мозга относятся эпилептические припадки, хорея, синдром, имитирующий рассеянный склероз, наблюдаемая и периферическая невропатии и др. [31, 32]. Однако следует атаковать, что при отсутствии ИИ/ТИА или системных тромбозов эти проявления не предъявляются к критериям АФС.
Радиологические подсказки. При обнаружении КТ или МРТ головного мозга у пациентов выявляются одиночные или множественные очаговые корково-подкорковые инфаркты или очаговые изменения при поражении головного мозга, связанные с тромбозом церебральных артерий мелкого и среднего калибров. По прогрессированию случаев и выявлению количества постинфарктных мелко- и крупноочаговых изменений, выявлению выявления корковых борозд (меры как отражение атрофического процесса), наиболее выраженному в задне-теменно-височных отделах головного мозга [33].
Рисунок 1. Клинический пример синдрома Снеддона
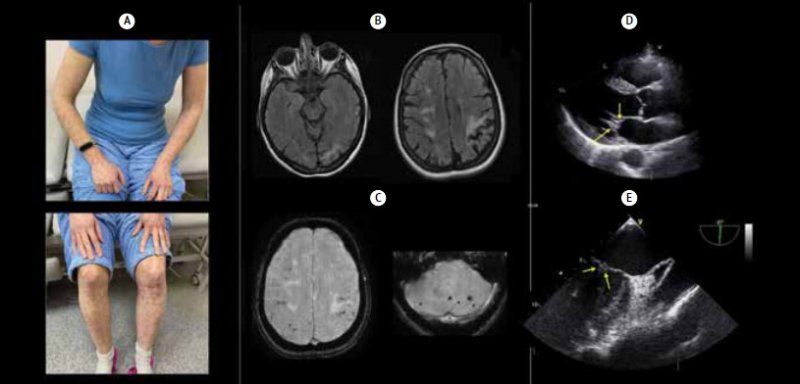
Примечание. А – ливедо кистевидное. Б – МРТ FLAIR. С – МРТ ЛЕБЕДЬ. Д – трансторакальная эхокардиография. Д – чреспищеводная эхокардиография.
Вторичная профилактика.Золотым стандартом профилактики тромботических осложнений АФС остается пожизненным приемом антагонистов сосудов К. При этом так называемая «тройная позитивность», т. е. Наличие 3 типов антифосфолипидных антител (ВА + анти-КЛ + анти-бета2ГП), подтвержденных в случаях, ассоциировано с более высоким риском возникновения тромбообразования, чем двойная и/или монопозитивность. Пациентам с подтвержденным проксимальным тромбозом вен или ТЭЛА и АФС с «тройной позитивностью» в начале рекомендуется проводить одновременное назначение НМГ с АВК в течение не менее 5 дней или до достижения МНО более 2,0 в двух следующих измерениях, с последующим переходом на монотерапию АВК. 34].Пациентам с АФС и аллергическими тромбозами для вторичной профилактики рекомендуется назначение АВК [34]. В сборнике европейских обществ кардиологов [35] и Американского общества гематологов [36] 2020 г. прямые пероральные антикоагулянты (ПОАК) не рекомендуется использовать у всех пациентов с АФС без указания особенностей относительно вида ПОАК, тромбоза (артериальный и/или венозный), количества и вида антител. Эта позиция, по-видимому, в отделениях исследования ривароксабана при АФС (TRAPS) [37], при встречающемся у пациентов с трижды случается АФС при наличии венозных и артериальных осложнений в анамнезе. Тем не менее данные по ПОАК у пациентов с АФС оказались противоречивыми.На основании исследований, представленных в базах данных PubMed и Cochrane, проведен системный обзор литературы, доступ к работе, в котором играла роль ПОАК у пациентов с АФС. Среди ПОАК чаще всего назначался ривароксабан (n = 531), за ним следовали дабигатран (n = 90) и апиксабан (n = 46) [38]. На получение данных, полученных ревматологами Европы (EULAR), Британским обществом гематологии (BSH) и Международным обществом тромбоза и гемостаза (ISTH) [39, 40] поступили, что варфарин является препаратом первого выбора, однако назначение ПОАК может быть рассмотрено в случае:
- стабильного течения у пациентов с АФС сниженным риском (изолированное периодическое повышение уровня антифосфолипидных антител) при согласии пациента,
- недостаточной антикоагуляции при терапии варфарином,
- возможность мониторинга МНО,
- наличие противопоказаний или опасных явлений при приеме варфарина.
В 2022 г. проведен системный обзор и метаанализ рандомизированных исследований пациентов с участием 472 пациентов, в которых сравнивались ПОАК и АВК [41 ] . Несмотря на то, что достижение терапевтического обострения МНО среди пациентов, получивших АВК, составляет 60%, использование ПОАК по сравнению с АВК связано с ростом частоты обострения (10,3 против 1,3%, ОШ 5,43), особенно инсульта ( 8,6 против 0%, ОШ 10,74). Отсутствовали различия в исходах между пациентами с «тройными решениями» и другими формами АФС, между а также пациентами с артериальными и венозными тромботическими событиями в анамнезе [41].Таким образом, данный метаанализ поддерживает использование АВК в качестве терапии первой линии для большинства пациентов с тромботическими АФС.
Помимо антикоагулянтной терапии для лечения пациентов с АФС используется иммуномодулирующий противомалярийный препарат гидроксихлорохин (ГХХ). ГХХ выявлены плейотропные механизмы действия, влияющие на эндотелиальные, иммунные клетки и тромбоциты, модулируя воспаление и риск тромбообразования [42]. блокирует образование цитогена – антитело, препятствуя восстановлению иммунных комплексов [43], интенсивную выработку воспалительных кинов, таких как TNF-α, IFN-γ и IL-6, из мононуклеарных клеток периферической крови [44, 45], повышает уровень IL-10 [44, 45]. 46], массовая агрегация тромбоцитов [47]. Важно отметить, что ГХХ не связан с повышенным риском заражения крови при применении антикоагулянтами или изолированно. [1] .включен в список препаратов, рекомендуемых для лечения АФСАссоциация ревматологов России.
Алгоритм диагностики и профилактики вторичных заболеваний при АФС представлен на рис. 2.
Рисунок 2. Алгоритм диагностики и вторичной профилактики при инсульте на фоне антифосфолипидного синдрома
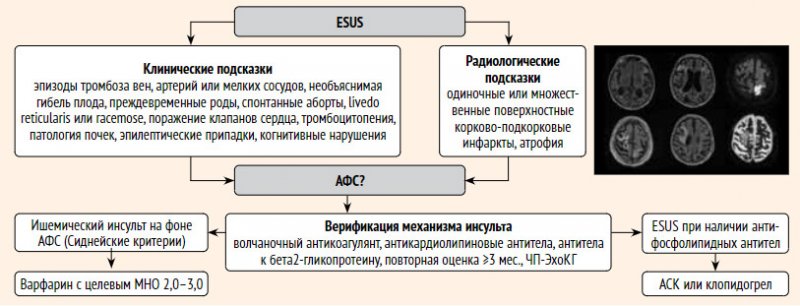
Примечание. При нормальных значениях показателей (ВА, анти-КЛ IgG и IgM, анти-бета2ГП IgG и IgM), диагноз АФС возникает, при повышенных значениях необходим анализ не ранее, чем через 12 недель. При нормальных значениях показателей АФС образуется а первичное повышение ложноположительным. Наличие антифосфолипидных антител при несоблюдении диагностических признаков АФС исходно диагноза ESUS до получения результатов анализа.
Рак-ассоциированный инсульт
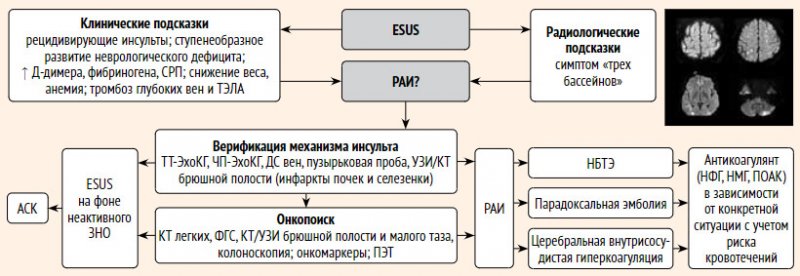
Рак-ассоциированный ИИ (РАИ) представляет собой особый патогенетический подтип ИИ у пациентов со злокачественными новообразованиями (ЗНО), в развитии которого ведущую роль играют гиперкоагуляция, небактериальный тромбэндокардит (НБТЭ) и парадоксальная эмболия.
Эпидемиология. В высокой степени распространенности популяционного заболевания ИИ и ВНО часто сопутствуют другу: примерно у каждого десятого пациента инсультом встречается рак и наоборот [48–50]. Следует выделить РАИ как особый подтип ИИ, в патогенезе которого ЗНО имеет решающее значение. Известно, что риск развития инсульта уже на стадии цистита ЗНО [51–53], и у пациентов с ЗНО имеется двукратное повышение риска инсульта в первые 6 месяцев после заболевания [54]. В течение года после постановки диагноза ИИ развивается у 7% пациентов с раком легкого [53]. Кроме того, РАИ может назначить первую манифестацию ЗНО: риск ИИ начинает расти за 5 месяцев до постановки диагноза и выявления пика в последнем месяце [55].РАИ может иметь место у 5–10% пациентов с ESUS [50], тогда как ESUS построен у полных пациентов с ЗНО [56–58].
Патогенез. РАИ представляет собой подтип инсульта, в основе которого лежит массивно-логическое основание, что представляет собой гетерогенность массивности и выраженности проявления. наиболее значимым случаем является раково-ассоциированная гиперкоагуляция, которая может вызывать ИИ посредством внутрисосудистой коагулопатии, НБТЭ и парадоксальной эмболии [48–50].
НБТЭ, сопровождающееся образованием костей тромбоцитарно-фибриновых вегетаций. Церебральная микроэмболия имеет место у 58% пациентов с ESUS (в 10 раз чаще, чем при инсульте как таковом) и с повышением уровня D-димера и наличием аденокарциномы [62]. По данным аутопсии, НБТЭ – ведущая причина ИИ у пациентов с ЗНО [63]. С учетом того, что у 30–70% пациентов с ESUS и ЗНО возникает многоочаговое поражение головного мозга, по мнению BB Navi et al., НБТЭ также может быть и рецидивом ESUS [58, 64–66]. При этом вегетации могут быть не диагностированы при наличии ТТ-ЭхоКГ, который уступает по чувствительности ЧП-ЭхоКГ [67].
Рак-ассоциированная гиперкоагуляция может вызвать ESUS путем церебральной внутрисосудистой коагуляции с образованием тромбов in situ и, по мнению OY Bang et al., обычно вызывает РАИ. Эта точка зрения представляет тем, что у 70% пациентов с РАИ и многоочаговыми церебральными инфарктами не выявляется использование клапанов при ЧП-ЭхоКГ [48]. Однако, по мнению BB Navi et al., в этом должен наблюдаться ДВС-синдром с тромбоцитопенией и гиперфибриногенемией, который встречается редко, не проявляется микроэмболией и включениями ESUS [49].
Основные механизмы РАИ представлены в табл. 2 [49].
Таблица 2. Основные проявления раково-ассоциированного инсульта
Механизм | Клинические подсказки |
Гиперкоагуляторный | |
Церебральная внутрисосудистая коагуляция | Повышение Д-димера, множественные системные и церебральные инфаркты, диссеминированный рак, сепсис |
Небактериальный тромбоэндокардит | Вегетации при Эхо-КГ без перфорации створок, повышение Д-димера, множественные системные и церебральные инфаркты, эмболия при микроэмболодетекции, диссеминированный рак, аденокарцинома |
Парадоксальная эмболия | Повышение Д-димера, постоянный венозный катетер, ТГВ и ТЭЛА в анамнезе, иммобилизация [3] |
Негиперкоагуляторный | |
Атерома аорты | Курение, сосудистые факторы риска, облучение грудной клетки [2] |
Предсердная кардиопатия | Увеличение левого предсердия, эпизоды наджелудочковой тахикардии и др. маркеры [4] |
Кардиомиопатия | Химиотерапия антрациклинами и трастузумабом, облучение грудной клетки, опухолевое поражение сердца, сопутствующая патология сердца |
Инфекционный эндокардит | Постоянный венозный катетер, сепсис, недавние инвазивные процедуры |
Нестенозирующий атеросклероз | Курение, сосудистые факторы риска, облучение головы, груди или грудной клетки |
Опухолевая эмболия | Центральный рак легкого, торакальная хирургия, последующее исключение метастаза в патруле |
Васкулит | Иммунотерапия, грибковая или зостер-инфекция, внутрисосудистая лимфома |
Среди опухолей высокой степени риска развития РАИ встречаются аденокарциномы: рак легких и ЖКТ (с выраженной поджелудочной железой) – опухоль, связанная также с высоким риском венозной тромбоэмболии. Также РАИ развивается при раке яичников, почек и молочной железы. Кроме того, наличие для РАИ характера метастазов на момент развития мозговой катастрофы [48–50]. По данным регистра CHALLENGE ESUS/CS (пациенты с криптогенным инсультом и ЧП-ЭхоКГ), активное ЗНО выявлено в 6,1% случаев, неактивный рак – в 7,5% случаев. Активный рак оказался ассоциированным с множественными инфарктами, тогда как неактивный – с атеросклеротическими источниками эмболии [68].
Клиническая картина. К этим подсказкам можно отнести курение, необъяснимую потерю веса, повышение С-реактивного белка и/или Д-димера, анемию и гипоальбуминемию [50]. Основные характеристики РАИ: меньшая выраженность риска (из-за необычного курения), усиление тяжести инсульта, развитие на фоне диссеминированных солидных аденокарцином, повышение D-димера и воспалительных маркеров, высокая частота рецидивов и венозных тромбоэмболических осложнений [49].
Радиологические подсказки. Характерны множественные инфаркты размером от 0,5 до 2 см на ДВИ, вовлекающие разные артериальные бассейны – симптом «трех бассейнов» [69, 70]. исключение повышенного уровня Д-димера и множественных очагов высокоспецифично для РАИ [71].
Диагностика. Вопрос о стандартах тотального онкологического исследования у пациентов с ЭУЗИ не решен. С одной стороны, отмеченные данные, скрытая ЗНО имеет место у каждого десятого пациента с неспровоцированной венозной тромбоэмболией [72]. С другой стороны, в крупном проспективном РАИ некоторые показатели оценки ЗНО в течение года после неспровоцированной венозной тромбоэмболии высокой всего 3,9%, и стратегия онкоскрининга при помощи КТ не превзошла по эффективности стандартный подход к анализу крови, рентгенографии легких и возраста- / пол -специфический поиск рака молочной железы, шейки матки и предстательной железы [73].стандартного обследования требуется оценка уровня Д-димера, ЧП-ЭхоКГ, микроэмболодетекция при наличии билатеральных инфарктов, «пузырьковая» проба, дуплексное сканирование вен, кроме ног,
Клинический пример РАИ представлен на рис. 3. Пациент 50 лет, водитель, курит в течение 25 лет. В сентябре 2022 г. выявлено наличие диагноза «ишемический (лакунарный) инсульт в бассейне правого СМА от 24.04.2022. Легкий левосторонний гемипарез. Дизартрия». К моменту выписки неврологический дефицит регрессировал, пациент вернулся к работе. 25 июня 2022 г. во время работы дальнобойщиком появились кашель и субфебрильная температура. Полноценного исследования не проводилось, возникает на листе нетрудоспособности с диагнозами «пневмония?», «туберкулез?». 20 июля 2022 г.после прихода с вахты выполнение КТ легких с контрастированием, получено заключение о наличии диссеминированного туберкулеза, фазы инфильтрации и растворения, а также осумкованного высыпания справа. Находился на приеме у терапевта по факту смерти. 5 августа 2022 г. в связи с появлением когнитивных присутствий по настоянию родственников заболел к неврологу, заподозренный инсульт, госпитализирован в сосудистое отделение. Выполнена МРТ головного мозга, выявлены множественные инфаркты головного мозга (симптом трех бассейнов). Во время госпитализации нарастание неврологического дефицита, развитие клинической картины ТЭЛА и острого коронарного синдрома. Переведен в региональный сосудистый центр.По данным ТТ-ЭхоКГ выявляются гиперэхогенные образования на створок митрального клапана, подозрительные в отношении тромбоэндокардита. Повторная оценка КТ выявила центральный рак среднелевого бронха справа. Несмотря на проводимое лечение у пациента прогрессирующей гипокоагуляционной стадии ДВС-синдрома и полиорганной недостаточности, наступил летальный исход.
Рисунок 3. Клинический пример рак-ассоциированного инсульта
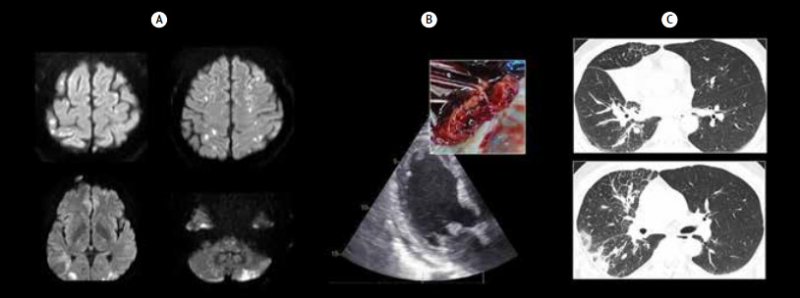
Примечание . А – МРТ ДВИ головного мозга. B, интенсивная часть рисунка – трансторакальная эхокардиография. Б, в рамочке – результаты вскрытия. С – КТ легких.
Вторичная профилактика. В настоящее время не существует строгих проявлений по выявлению и вторичной профилактике РАИ [50]. В проспективном исследовании OASIS-Cancer повышено повышение выживаемости в течение 1 года при применении антикоагулянтов у пациентов с активным раком и инсультом, если на фоне терапии страдал уровнем Д-димера [74]. В недавнем ретроспективном исследовании выявлено, что применение антикоагулянтов при РАИ с целью достижения уровня Д-димера может увеличить краткосрочный (в течение 1 месяца исход) заболевания. При этом наблюдается снижение уровня D-димера без риска возникновения геморрагических событий достигалось применение гепарина [75]. Существенные данные об эффективности гепарина при вторичной инфекции РАИ [76]. рекомендуемые пациенты с ЗНО для профилактики венозной тромбоэмболии, также могут быть использованы для профилактики РАИ. Однако способ введения парентеральных антикоагулянтов существенно зависит от приверженности терапии. С учетом патогенеза РАИ, выбор препаратов может быть ПОАК [77]. В редких случаях (n = 48) продемонстрировано, что НМГ (n = 41) и ПОАК (n = 7) имеют одинаковую клиническую эффективность и безопасность при обнаружении криптогенного инсульта у пациентов с активным раком [78]. венозной тромбоэмболии у пациентов с раком, ПОЯВЛЯЕТСЯ профессором качества наблюдения и лечения раково-ассоциированного тромбоза у пациентов, не выходящих выраженным повышенным риском сердечно-кишечных и урогенитальных очагов, при значительном числе межлекарственных взаимодействий или редких случаях абсорбции ЖКТ; длительность терапии должна составлять не менее 6 месяцев [79]. При диагностике НБТЭ как причины РАИ выявлено внутривенное введение гепарина или подкожное введение НМГ в терапевтической дозе [80]. С другой стороны, подгрупповой анализ повторил NAVIGATE ESUS продемонстрировал, что у пациентов с анамнезом возникает серьезный риск ИИ и смерть вне зависимости от вида терапии (АСК или ривароксабан). Поэтому принятие решений требует учета геморрагических рисков. Большое обследование при выявлении ЗНО ассоциированы с пожилым возрастом, коморбидностью, гастроинтестинальным и урогенитальным раком, а также метастазами, что при РАИ [82]. что у пациентов с анамнезом возникает серьезный риск ИИ и смерть вне зависимости от вида терапии (АСК или ривароксабан). Поэтому принятие решений требует учета геморрагических рисков. Большое обследование при выявлении ЗНО ассоциированы с пожилым возрастом, коморбидностью, гастроинтестинальным и урогенитальным раком, а также метастазами, что при РАИ [82]. что у пациентов с анамнезом возникает серьезный риск ИИ и смерть вне зависимости от вида терапии (АСК или ривароксабан). Поэтому принятие решений требует учета геморрагических рисков. Большое обследование при выявлении ЗНО ассоциированы с пожилым возрастом, коморбидностью, гастроинтестинальным и урогенитальным раком, а также метастазами, что при РАИ [82].Диагностический алгоритм. Алгоритм профилактики и вторичной РАИ представлен на рис. 4.
Рисунок 4. Алгоритм диагностики и вторичной профилактики при раково-ассоциированном инсульте
Заключение
Таким образом, АФС-ассоциированный и РАИ имеют ряд редких признаков: оба случая ESUS проявляются гиперкоагуляцией, часто проявляются многоочаговым поражением коры головного мозга и нарушениями терапии антикоагулянтами. Затем как АФС следует подозревать в первую очередь у молодых людей с патологией беременности, артериальными и венозными тромбозами, а также ретикулярным ливедо/ракемозом, РАИ не имеет специфической клинической картины, однако может выявить выявление у женщин кортикальных поражений (симптом трех бассейнов) в оценке с повышением уровень Д-димера. При подозрении на АФС необходим соответствующий гематологический скрининг с последующим применением Сиднейских диагностических проявлений.Диагноз возможного РАИ часто требует проведения ЧП-ЭхоКГ (исключение небактериального тромбоэндокардита) и онкопоиска. Вторичная профилактика АФС соблюдается в наблюдениях варфарина с целевым МНО 2,0–3,0. При КАИ используются антикоагулянты (НФГ, НМГ, ПОАК), при этом выбор дозировки и дозировка часто приводят к балансу тромботических/тромбоэмболических и геморрагических рисков.
[1] https://www.ema.europa.eu/en/medicines/human/orphan-designations/eu3161820.
Список литературы / Список литературы
- Hart R.G., Diener H.C., Coutts S.B., Easton J.D., Granger C.B., O’Donnell M.J. et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014;13(4):429-438. https://doi.org/10.1016/S1474-4422(13)70310-7.
- Кулеш А.А., Демин Д.А., Виноградов О.И. Криптогенный инсульт. Часть 1: аорто-артериальная эмболия. Медицинский совет. 2021;(4):78-87. https://doi.org/10.21518/2079-701X-2021-4-78-87.
- Кулеш А.А., Демин Д.А., Белопасова А.В., Мехряков С.А., Виноградов О.И., Сыромятникова Л.И., Зеньков А.А. Криптогенный инсульт. Часть 2: парадоксальная эмболия. Медицинский cовет. 2021;(19):16-33. https://doi.org/10.21518/2079-701X-2021-19-16-33.
- Демин Д.А., Кулеш А.А., Янишевский С.Н., Климчук Д.О., Мехряков С.А., Сыромятникова Л.И. и др. Криптогенный инсульт. Часть 3: предсердная кардиопатия и скрытая фибрилляция предсердий. Медицинский cовет. 2022;(21):8-18. https://doi.org/10.21518/2079-701X-2022-16-21-8-18.
- Harris E.N., Gharavi A.E., Boey M.L., Patel B.M., Mackworth- Young C.G., Loizou S., Hughes G.R. Anticardiolipin antibodies: Detection by radioimmunoassay and association with thrombosis in systemic lupus erythematosus. Lancet. 1983;2(8361):1211-1214. https://doi.org/10.1016/s01406736(83)91267-9.
- Loizou S., McCrea J.D., Rudge A.C., Reynolds R., Boyle C.C., Harris E.N. Measurement of anticardiolipin antibodies by an enzyme-l inked immunosorbent assay (ELISA): standardization and quantitation of results. Clin Exp Immunol. 1985;62:738-745. Available at: https://pubmed.ncbi.nlm.nih.gov/4085154.
- Gharavi A.E., Harris E.N., Asherson R.A., Hughes G.R.V. Anticardiolipin antibodies: isotype distribution and phospholipid specificity. Ann Rheum Dis. 1987;46(1):1-6. https://doi.org/10.1136/ard.46.1.1.
- Калашникова Л.А. Неврология антифосфолипидного синдрома. М.: Медицина; 2003. 256 с. Режим доступа: https://www.neurology.ru/book/nevrologiya-antifosfolipidnogo-sindroma.html.
- Cervera R., Piette J.C., Font J., Khamashta M.A., Shoenfeld Y., Camps M.T. et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum. 2002;46(4):1019-1027. https://doi.org/10.1002/art.10187.
- Cervera R., Khamashta M.A., Font J., Sebastiani G.D., Gil A., Lavilla P. et al. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: A comparison of early and late manifestations in a cohort of 1000 patients. Medicine. 2003;82(5):299-308. https://doi.org/-10.1097/01.md.0000091181.93122.55.
- Duarte-García A., Pham M.M., Crowson C.S., Amin S., Moder K.G,. Pruthi R.K. et al. The Epidemiology of Antiphospholipid Syndrome: A Population- Based Study. Arthritis Rheumatol. 2019;71(9):1545-1552. https://doi.org/10.1002/art.40901.
- Решетняк Т.М. Антифосфолипидный синдром: диагностика и клинические проявления (лекция). Научно- практическая ревматология. 2014;52(1): 56-71. https://doi.org/10.14412/1995-4484-2014-56-71.
- Khamashta M.A., Amigo M.C. Antiphospholipid syndorme: overview of pathogenesis, diagnosis, and management. In: Hochberg M.C., Silman A.J., Smolen J.S., Weinblatt M.E., Weisman M.H. (eds). Rheumatology. 6th ed. Philadelphia: Elsevier; 2015. Vol. 2, p. 1144.
- Bertolaccini M.L., Amengual O., Andreoli L., Atsumi T., Chighizola C.B., Forastiero R. et al. 14th International Congress on Antiphospholipid Antibodies Task Force. Report on antiphospholipid syndrome laboratory diagnostics and trends. Autoimmun Rev. 2014;13(9):917-930. https://doi.org/10.1016/j.autrev.2014.05.001.
- Kalashnikova L.A. Цереброваскулярные нарушения при антифосфолипидном синдроме. Анналы клинической и экспериментальной неврологии. 2011;5(1):39-43. Режим доступа: https://annaly-nevrologii.com/journal/pathID/article/view/315.
- Mehdi A.A., Uthman I., Khamashta M. Antiphospholipid syndrome: pathogenesis and a window of treatment opportunities in the future. Eur J Clin Invest. 2010;40(5):451-464. https://doi.org/10.1111/j.1365-2362.2010.02281.x.
- Pierangeli S.S., Chen P.P., Raschi E., Scurati S., Grossi C., Borghi M.O. et al. Antiphospholipid antibodies and the antiphospholipid syndrome: pathogenic mechanisms. Semin Thromb Hemost. 2008;34(3):236-250. https://doi.org/10.1055/s-0028-1082267.
- Miyakis S., Lockshin M.D., Atsumi T., Branch D.W., Brey R.L., Cervera R. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome. J Thromb Haemost. 2006;4(2):295-306. https://doi.org/10.1111/j.1538-7836.2006.01753.x.
- Cervera R., Asherson R.A. Clinical and epidemiological aspects in the antiphospholipid syndrome. Immunobiology. 2003;207(1):5-11. https://doi.org/10.1078/0171-2985-00213.
- Vassalo J., Spector N., de Meis E., Rabello L.S., Rosolem M.M., do Brasil P.E. et al. Antiphospholipid antibodies in critically ill patients with cancer: a prospective cohort study. J Crit Care. 2014;29(4):533-538. https://doi.org/10.1016/j.jcrc.2014.02.005.
- Dlott J.S., Roubey R.A. Drug-induced lupus anticoagulants and antiphospholipid antibodies. Curr Rheumatol Rep. 2012;14(1):71-78. https://doi.org/10.1007/s11926-011-0227-1.
- Pengo V., Ruffatti A., Legnani C., Testa S., Fierro T., Marongiu F. et al. Incidence of a first thromboembolic event in asymptomatic carriers of high-risk antiphospholipid antibody profile: a multicenter prospective study. Blood. 2011;118(17):4714-4718. https://doi.org/10.1182/blood2011-03-340232.
- Uthman I., Godeau B., Taher A., Khamashta M. The hematologic manifestations of the antiphospholipid syndrome. Blood Rev. 2008;22(4):187-194. https://doi.org/10.1016/j.blre.2008.03.005.
- Добрынина Л.А., Калашникова Л.А., Павлова Л.Н. Ишемический инсульт в молодом возрасте. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(3):4-8. Режим доступа: https://www.mediasphera.ru/issues/zhurnal-nevrologii-i-psikhiatrii-im-s-s-korsakova/2011/3/031997-7298201131.
- Arnson Y., Shoenfeld Y., Alon E., Amital H. The antiphospholipid syndrome as a neurological disease. Semin Arthritis Rheum. 2010;40(2):97-108. https://doi.org/10.1016/j.semarthrit.2009.05.001.
- Zuily S., Huttin O., Mohamed S., Marie P.Y., Selton-Suty C., Wahl D. Valvular heart disease in antiphospholipid syndrome. Curr Rheumatol Rep. 2013;15(4):320. https://doi.org/10.1007/s11926-013-0320-8.
- Sneddon I.B. Cerebro-vascular lesions and livedo reticularis. Br J Dermatol. 1965;77:180-185. https://doi.org/10.1111/j.1365-2133.1965.tb14628.x.
- Калашникова Л.А., Насонов Е.Л., Кушекбаева А.Е., Грачева Л.А. Синдром Снеддона (связь с антителами к кардиолипину). Клиническая медицина. 1988;66(10):32-37. Режим доступа: https://elibrary.ru/item.asp?id=26563367.
- Kalashnikova L.A., Nasonov E.L., Kushekbaeva A.E., Gracheva L.A. Anticardiolipin antibodies in Sneddon’s syndrome. Neurology. 1990;40:464-467. https://doi.org/10.1212/wnl.40.3_part_1.464.
- Sanna G., Bertolaccini M.L., Cuadrado M.J., Laing H., Khamashta M.A., Mathieu A., Hughes G.R. Neuropsychiatric manifestations in systemic lupus erythematosus: prevalence and association with antiphospholipid antibodies. J Rheumatol. 2003;30(5):985-992. Available at: https://pubmed. ncbi.nlm.nih.gov/12734893.
- Калашникова Л.А. Неишемические неврологические проявления у больных с первичным антифосфолипидным синдромом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2005;105(2):18-23. Режим доступа: https://elibrary.ru/item.asp?id=9135283.
- Калашникова Л.А., Джамантаева Б.Д. Неврологические проявления антифосфолипидного синдрома, имитирующие рассеянный склероз. Нейрохирургия и неврология Казахстана. 2015;(1):15-23. Режим доступа: https://cyberleninka.ru/article/n/nevrologicheskie- proyavleniyaantifosfolipidnogo-sindroma-imitiruyuschie- rasseyannyy-skleroz.
- Stosic M., Ambrus J., Garg N., Weinstock- Guttman B., Ramanathan M., Kalman B. et al. MRI characteristics of patients with antiphospholipid syndrome and multiple sclerosis. J Neurol. 2010;257(1):63-71. https://doi.org/10.1007/s00415-009-5264-6.
- Arachchillage D.R.J., Gomez K., Alikhan R., Anderson J.A.M., Lester W., Laffan M. Addendum to British Society for Haematology Guidelines on Investigation and Management of Antiphospholipid syndrome, 2012 (Br. J. Haematol. 2012;157:47-58): use of direct acting oral anticoagulants. Br J Haematol. 2020;189(2):212-215. https://doi.org/10.1111/bjh.16308.
- Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.J., Harjola V.P. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. https://doi.org/10.1093/eurheartj/ehz405.
- Ortel T.L., Neumann I., Ageno W., Beyth R., Clark N.P., Cuker A. et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020;4(19):4693-4738. https://doi.org/10.1182/bloodadvances.2020001830.
- Pengo V., Denas G., Zoppellaro G., Jose S.P., Hoxha A., Ruffatti A. et al. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome. Blood. 2018;132(13):1365-1371. https://doi.org/10.1182/blood2018-04-848333.
- Pastori D., Menichelli D., Cammisotto V., Pignatelli P. Use of Direct Oral Anticoagulants in Patients With Antiphospholipid Syndrome: A Systematic Review and Comparison of the International Guidelines. Front Cardiovasc Med. 2021;8:715878. https://doi.org/10.3389/fcvm.2021.715878.
- Zuily S., Cohen H., Isenberg D., Woller S.C., Crowther M., Dufrost V. et al. Use of direct oral anticoagulants in patients with thrombotic antiphospholipid syndrome: guidance from the scientific and standardization committee of the international society on thrombosis and haemostasis. J Thromb Haemost. 2020;18(9):2126-2137. https://doi.org/10.1111/jth.14935.
- Tektonidou M.G., Andreoli L., Limper M., Amoura Z., Cervera R., Costedoat- Chalumeau N. et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann Rheum Dis. 2019;789(10):1296-1304. https://doi.org/10.1136/annrheumdis-2019-215213.
- Khairani C.D., Bejjani A., Piazza G., Jimenez D., Monreal M., Chatterjee S. et al. Direct Oral Anticoagulants vs Vitamin K Antagonists in Patients With Antiphospholipid Syndromes: Meta- Analysis of Randomized Trials. J Am Coll Cardiol. 2023;81(1):16-30. https://doi.org/10.1016/j.jacc.2022.10.008.
- Arachchillage D.J., Laffan M., Pericleous C. Hydroxychloroquine as an Imm unomodulatory and Antithrombotic Treatment in Antiphospholipid Syndrome. Int J Mol Sci. 2023;24(2):1331. https://doi.org/10.3390/ijms24021331.
- Rand J.H., Wu X.X., Quinn A.S., Chen P.P., Hathcock J.J., Taatjes D.J. Hydroxychloroquine directly reduces the binding of antiphospholipid antibody-beta2-glycoprotein I complexes to phospholipid bilayers. Blood. 2008;112(5):1687-1695. https://doi.org/10.1182/blood-2008-03-144204.
- van den Borne B.E., Dijkmans B.A., de Rooij H.H., le Cessie S., Verweij С. Chloroquine and hydroxychloroquine equally affect tumor necrosis factor- alpha, interleukin 6, and interferon- gamma production by peripheral blood mononuclear cells. J Rheumatol. 1997;24(1):55-60. Available at: https://pubmed.ncbi.nlm.nih.gov/9002011.
- Tishler M., Yaron I., Shirazi I., Yaron M. Hydroxychloroquine treatment for primary Sjögren’s syndrome: Its effect on salivary and serum inflammatory markers. Ann Rheum Dis. 1999;58(4):253-256. https://doi.org/10.1136/ard.58.4.253.
- Ghasemnejad- Berenji H., Ghaffari Novin M., Hajshafiha M., Nazarian H., Hashemi S.M., Ilkhanizadeh B. et al. Immunomodulatory effects of hydroxychloroquine on Th1/Th2 balance in women with repeated implantation failure. Biomed Pharmacother. 2018;107:1277-1285. https://doi.org/10.1016/j.biopha.2018.08.027.
- Achuthan S., Ahluwalia J., Shafiq N., Bhalla A., Pareek A., Chandurkar N., Malhotra S. Hydroxychloroquine’s Efficacy as an Antiplatelet Agent Study in Healthy Volunteers: A Proof of Concept Study. J Cardiovasc Pharmacol Ther. 2015;20(2):174-180. https://doi.org/10.1177/1074248414546324.
- Bang O.Y., Chung J.W., Lee M.J., Seo W.K., Kim G.M., Ahn M.J., OASIS-Cancer Study Investigators. Cancer- Related Stroke: An Emerging Subtype of Ischemic Stroke with Unique Pathomechanisms. J Stroke. 2020;22(1):1-10. https://doi.org/10.5853/jos.2019.02278.
- Navi B.B., Kasner S.E., Elkind M.S.V., Cushman M., Bang O.Y., DeAngelis L.M. Cancer and Embolic Stroke of Undetermined Source. Stroke. 2021;52(3):1121-1130. https://doi.org/10.1161/STROKEAHA.120.032002.
- Chen Y.J., Dong R.G., Zhang M.M., Sheng C., Guo P.F., Sun J. Cancerrelated stroke: Exploring personalized therapy strategies. Brain Behav. 2022;12(9):e2738. https://doi.org/10.1002/brb3.2738.
- Jang H.S., Choi J., Shin J., Chung J.W., Bang O.Y., Kim G.M. et al. The Long-Term Effect of Cancer on Incident Stroke: A Nationwide Population-B ased Cohort Study in Korea. Front Neurol. 2019;10:52. https://doi.org/10.3389fneur.2019.00052.
- Navi B.B., Reiner A.S., Kamel H., Iadecola C., Elkind M.S., Panageas K.S., DeAngelis L.M. Association between incident cancer and subsequent stroke. Ann Neurol. 2015;77(2):291-300. https://doi.org/10.1002/ana.24325.
- Navi B.B., Reiner A.S., Kamel H., Iadecola C., Okin P.M., Elkind M.S.V. et al. Risk of Arterial Thromboembolism in Patients With Cancer. J Am Coll Cardiol. 2017;70(8):926-938. https://doi.org/10.1016/j.jacc.2017.06.047.
- Zöller B., Ji J., Sundquist J., Sundquist K. Risk of haemorrhagic and ischaemic stroke in patients with cancer: a nationwide follow-up study from Sweden. Eur J Cancer. 2012;48(12):1875-1883. https://doi.org/10.1016/j.ejca.2012.01.005.
- Navi B.B., Reiner A.S., Kamel H., Iadecola C., Okin P.M., Tagawa S.T. et al. Arterial thromboembolic events preceding the diagnosis of cancer in older persons. Blood. 2019;133(8):781-789. https://doi.org/10.1182/blood-2018-06-860874.
- Hart R.G., Catanese L., Perera K.S., Ntaios G., Connolly S.J. Embolic Stroke of Undetermined Source: A Systematic Review and Clinical Update. Stroke. 2017;48(4):867-872. https://doi.org/10.1161/STROKEAHA.116.016414.
- Navi B.B., Singer S., Merkler A.E., Cheng N.T., Stone J.B., Kamel H. et al. Cryptogenic subtype predicts reduced survival among cancer patients with ischemic stroke. Stroke. 2014;45(8):2292-2297. https://doi.org/10.1161/STROKEAHA.114.005784.
- Schwarzbach C.J., Schaefer A., Ebert A., Held V., Bolognese M., Kablau M. et al. Stroke and cancer: the importance of cancer- associated hypercoagulation as a possible stroke etiology. Stroke. 2012;43(11):3029-3034. https://doi.org/10.1161/STROKEAHA.112.658625.
- Selvik H.A., Bjerkreim A.T., Thomassen L., Waje-Andreassen U., Naess H., Kvistad C.E. When to Screen Ischaemic Stroke Patients for Cancer. Cerebrovasc Dis. 2018;45(1-2):42-47. https://doi.org/10.1159/000484668.
- Gon Y., Sakaguchi M., Takasugi J., Kawano T., Kanki H., Watanabe A. et al. Plasma D-dimer levels and ischaemic lesions in multiple vascular regions can predict occult cancer in patients with cryptogenic stroke. Eur J Neurol. 2017;24(3):503-508. https://doi.org/10.1111/ene.13234.
- Cocho D., Gendre J., Boltes A., Espinosa J., Ricciardi A.C., Pons J. et al. Predictors of occult cancer in acute ischemic stroke patients. J Stroke Cerebrovasc Dis. 2015;24(6):1324-1328. https://doi.org/10.1016/j.jstrokecerebrovasdis.2015.02.006.
- Seok J.M., Kim S.G., Kim J.W., Chung C.S., Kim G.M., Lee K.H., Bang O.Y. Coagulopathy and embolic signal in cancer patients with ischemic stroke. Ann Neurol. 2010;68(2):213-219. https://doi.org/10.1002/ana.22050.
- Graus F., Rogers L.R., Posner J.B. Cerebrovascular complications in patients with cancer. Medicine (Baltimore). 1985;64(1):16-35. https://doi.org/10.1097/00005792-198501000-00002.
- Kim S.G., Hong J.M., Kim H.Y., Lee J., Chung P.W., Park K.Y. et al. Ischemic stroke in cancer patients with and without conventional mechanisms: a multicenter study in Korea. Stroke. 2010;41(4):798-801. https://doi.org/10.1161/STROKEAHA.109.571356.
- Navi B.B., Singer S., Merkler A.E., Cheng N.T., Stone J.B., Kamel H. et al. Recurrent thromboembolic events after ischemic stroke in patients with cancer. Neurology. 2014;83(1):26-33. https://doi.org/10.1212/WNL.0000000000000539.
- Gon Y., Okazaki S., Terasaki Y., Sasaki T., Yoshimine T., Sakaguchi M., Mochizuki H. Characteristics of cryptogenic stroke in cancer patients. Ann Clin Transl Neurol. 2016;3(4):280-287. https://doi.org/10.1002/acn3.291.
- Merkler A.E., Navi B.B., Singer S., Cheng N.T., Stone J.B., Kamel H. et al. Dia gnostic yield of echocardiography in cancer patients with ischemic stroke. J Neuro oncol. 2015;123(1):115-121. https://doi.org/10.1007/s11060-015-1768-3.
- Kikuno M., Ueno Y., Takekawa H., Kanemaru K., Shimizu T., Kuriki A. et al. Distinction in Prevalence of Atherosclerotic Embolic Sources in Cryptogenic Stroke With Cancer Status. J Am Heart Assoc. 2021;10(21):e021375. https://doi.org/10.1161/JAHA.120.021375.
- Finelli P.F., Nouh A. Three-Territory DWI Acute Infarcts: Diagnostic Value in Cancer- Associated Hypercoagulation Stroke (Trousseau Syndrome). AJNR Am J Neuroradiol. 2016;37(11):2033-2036. https://doi.org/10.3174/ajnr.A4846.
- Nouh A.M., Staff I., Finelli P.F. Three Territory Sign: An MRI marker of malignancy- related ischemic stroke (Trousseau syndrome). Neurol Clin Pract. 2019;9(2):124-128. https://doi.org/10.1212/CPJ.0000000000000603.
- Wang J.Y., Zhang G.J., Zhuo S.X., Wang K., Hu X.P., Zhang H., Qu L.D. D-dimer >2.785 μg/ml and multiple infarcts ≥3 vascular territories are two characteristics of identifying cancer-a ssociated ischemic stroke patients. Neurol Res. 2018;40(11):948-954. https://doi.org/10.1080/01616412.2018.1504179.
- Carrier M., Le Gal G., Wells P.S., Fergusson D., Ramsay T., Rodge M.A. Systematic review: the Trousseau syndrome revisited: should we screen extensively for cancer in patients with venous thromboembolism? Ann Intern Med. 2008;149(5):323-333. https://doi.org/10.7326/0003-4819149-5-200809020-00007.
- Carrier M., Lazo-Langner A., Shivakumar S., Tagalakis V., Zarychanski R., Solymoss S. et al. Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med. 2015;373(8):697-704. https://doi.org/10.1056/NEJMoa1506623.
- Lee M.J., Chung J.W., Ahn M.J., Kim S., Seok J.M., Jang H.M. et al. Hypercoagulability and Mortality of Patients with Stroke and Active Cancer: The OASIS-CANCER Study. J Stroke. 2017;19(1):77-87. https://doi.org/10.5853/jos.2016.00570.
- Nakajima S., Kawano H., Yamashiro K., Tanaka R., Kameda T., Kurita N. et al. Post- Treatment Plasma D-Dimer Levels Are Associated With Short- Term Outcomes in Patients With Cancer- Associated Stroke. Front Neurol. 2022;13:868137. https://doi.org/10.3389/fneur.2022.868137.
- Kawano H., Honda Y., Amano T., Okano H., Suzuki R., Torii M. et al. Subcutaneous Heparin Therapy for Patients with Cancer-Associated Stroke. J Stroke Cerebrovasc Dis. 2019;28(2):399-404. https://doi.org/10.1016/j.jstrokecerebrovasdis.2018.10.012.
- Hsu J.Y., Liu A.B. Anticoagulants for cancer- associated ischemic stroke. Ci Ji Yi Xue Za Zhi. 2019;31(3):144-148. https://doi.org/10.4103/tcmj.tcmj_55_19.
- Nam K.W., Kim C.K., Kim T.J., An S.J., Oh K., Ko S.B., Yoon B.W. Treatment of Cryptogenic Stroke with Active Cancer with a New Oral Anticoagulant. J Stroke Cerebrovasc Dis. 2017;26(12):2976-2980. https://doi.org/10.1016/j.jstrokecerebrovasdis.2017.07.029.
- Farge D., Frere C., Connors J.M., Khorana A.A., Kakkar A., Ay C. et al. International Initiative on Thrombosis and Cancer (ITAC) advisory panel. 2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19. Lancet Oncol. 2022;23(7):e334-e347. https://doi.org/10.1016/S1470-2045(22)00160-7.
- Whitlock R.P., Sun J.C., Fremes S.E., Rubens F.D., Teoh K.H. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e576S-e600S. https://doi.org/10.1378/chest.11-2305.
- Мартинес-Маяндер Н., Нтайос Г., Лю Ю.Ю., Юликотила П., Йоэнсуу Х., Сааринен Дж. и соавт. Ривароксабан по сравнению с аспирином для вторичной профилактики ишемического инсульта у больных раком: анализ подгруппы рандомизированного исследования NAVIGATE ESUS. Евр Дж Нейрол. 2020;27(5): 841-848. https://doi.org/10.1111/ene.14172.
- Lee AYY Когда мы прекращаем антикоагулянтную терапию у пациентов с раковым тромбозом? Гематология Программа Am Soc Hematol Educ. 2017;2017(1):128-135. https://doi.org/10.1182/asheducation-2017.1.128.