Журнал "Медицинский совет" №1/2021
DOI: 10.21518/2079-701X-2021-1-149-156
Е.В. Каннер1, ORCID: 0000-0003-3204-1846
А.В. Горелов1,2, ORCID: 0000-0001-9257-0171
М.Л. Максимов3,4, ORCID: 0000-0003-3260-5672
И.Д. Каннер5, ORCID: 0000-0002-8979-8084
Н.М. Лапкин6, ORCID: 0000-0001-6078-9240
1 Центральный научно-исследовательский институт эпидемиологии; 111123, Россия, Москва, ул. Новогиреевская,
д. 3а
2 Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
3 Казанская государственная медицинская академия; 420012, Россия, Казань, ул. Бутлерова, д. 36
4 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова; 117997, Россия, Москва, ул. Островитянова, д. 1
5 Московский государственный университет им. М.В. Ломоносова: 119991, Россия, Москва, Ленинские горы, д. 1
6 Ярославский государственный медицинский университет; 150000, Россия, Ярославль, ул. Революционная, д. 5
Применение АБП существенно снизило количество тяжелых бактериальных инфекционных заболеваний и летальность у детей, особенно первого года жизни. Но широкое и неоправданное применение АБП, в т.ч. антибиотиков резерва (использование карбапенемов выросло на 45%, полимиксинов – на 13%), при неосложненных острых респираторных инфекциях чревато серьезными последствиями, такими как рост антибиотикорезистентности возбудителей. Одним из частых осложнений антибиотикотерапии может быть развитие антибиотик-ассоциированной диареи. По данным различных авторов, частота развития антибиотик-ассоциированной диареи составляет 6–80% среди пациентов, получавших антибиотики, в среднем 35% (примерно каждый третий пациент) на фоне приема антибиотиков отмечают симптомы антибиотик-ассоциированной диареи.
Нарушения качественного и количественного состава микрофлоры кишечника сопровождаются снижением защитных функций слизистой оболочки кишечника и способствуют росту патогенных и условно-патогенных микроорганизмов (Clostridium spp., Candida spp., Salmonella spp., Staphyloccus aureus). Данные большинства исследований, полученные на большой выборке детского населения, а также клинические рекомендации Всемирной ассоциации гастроэнтерологов для профилактики антибиотик-ассоциированной диареи у детей рекомендуют применять пробиотический штамм L. rhamnosus GG – степень доказательности 1. L. rhamnosus GG обладают хромосомной устойчивостью к ряду антибиотиков, которая варьируется в зависимости от вида и штамма. Плазмидной ДНК, опасной для распространения антибиотикоустойчивости среди других бактерий, они не содержат, что делает возможным их широкое лечебно-профилактическое использование. Приведены клинические примеры течения антибиотик-ассоциированной диареи у детей, демонстрирующие вариабельность клинической картины. Лихорадка при ОРИ у детей, особенно раннего возраста, основной опасностью которой является дегидратация вследствие значительных потерь воды при дыхании, и особенно возросшего потоотделения (в т.ч. при приеме жаропонижающих средств), требует особого внимания со стороны родителей и врачей. Таким образом, пероральная регидратация является важным методом лечения инфекционных заболеваний у детей. Осложнения, возникающие у пациентов, особенно детского возраста, после приема антибиотиков, заболевания, которые могут приводить к нарушениям водно-электролитного баланса, являются жизнеугрожающими состояниями, требуют немедленной помощи. Коррекция водно-электролитного баланса, своевременное восстановление микрофлоры кишечника улучшают прогноз у таких пациентов, способствуют скорейшему выздоровлению.
Для цитирования: Каннер Е.В., Горелов А.В., Максимов М.Л., Каннер И.Д., Лапкин Н.М. Современные подходы к профилактике и регидратационной терапии антибиотик-ассоциированной диареи у детей на фоне ОРИ. Медицинский совет. 2021;(1):149–156. doi: 10.21518/2079-701X-2021-1-149-156.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Modern approaches to the prevention and rehydration therapy of antibiotic-associated diarrhea affected by ARI in children
Ekaterina V. Kanner1, ORCID: 0000-0003-3204-1846
Aleksandr V. Gorelov1,2, ORCID: 0000-0001-9257-0171
Maksim L. Maksimov3,4, ORCID: 0000-0003-3260-5672
Ilya D. Kanner5, ORCID: 0000-0002-8979-8084
Nikita M. Lapkin6, ORCID: 0000-0001-6078-9240
1 Central Research Institute of Epidemiology; 3a, Novogireevskaya St., Moscow, 111123, Russia
2 Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
3 Kazan State Medical Academy; 36, Butlerov St., Kazan, 420012, Russia
4 Pirogov Russian National Research Medical University; 1, Ostrovityanov St., Moscow, 117997, Russia
5 Lomonosov Moscow State University, 1, Leninskie Gory, Moscow, 119991, Russia
6 Yaroslavl State Medical University; 5, Revolutsionnaya St., Yaroslavl, 150000, Russia
The use of antibiotic drugs (ABDs) has significantly reduced the number of severe bacterial infectious diseases and mortality in children, especially in infants. But the widespread and unnecessary use of ABDs, including reserve antibiotics (the use of carbapenems increased by 45%, polymyxins – by 13%), to treat uncomplicated acute respiratory infections is open to many hazards, such as increased antibiotic resistance of pathogens. Antibiotic-associated diarrhea is one of the common complications of antibiotic therapy. According to various authors, the incidence of antibiotic-associated diarrhea is 6–80% among patients treated with antibiotics, on average 35% of patients (approximately every third patient) receiving antibiotics report symptoms of antibiotic-associated diarrhea.
Disruptive changes in the qualitative and quantitative composition of the intestinal microbiota are accompanied by a decrease in the protective functions of the intestinal mucosa and contribute to the growth of pathogenic and opportunistic microorganisms (Clostridium spp., Candida spp., Salmonella spp., Staphyloccus aureus). The findings of most studies obtained on a large sample of paediatric population, as well as the clinical guidelines of the World Association of Gastroenterologists recommend the use of L. rhamnosus GG probiotic strain (level of evidence 1) to prevent antibiotic-associated diarrhea in children. L. rhamnosus GG presents chromosomal resistance to a range of antibiotics, which varies with species and strain. They do not contain plasmid DNA, which is dangerous for the spread of antibiotic resistance among other bacteria, which enables their wide therapeutic and prophylactic use. Clinical case studies of the course of antibiotic-associated diarrhea in children are presented to demonstrate the variability of clinical symptoms. Fever in children with ARI, particularly in tender-age infants, requires special attention from parents and doctors, as its main risk lies with a dehydration due to significant water loss during breathing, and especially increased sweating (including sweating induced by antipyretics). Therefore, oral rehydration therapy is an important method for treating infectious diseases in children. Complications that develop in patients, especially in children, after administration of antibiotics, diseases that can lead to water and electrolyte imbalance are life-threatening conditions that require immediate medical attention. Correction of water and electrolyte balance, timely restoration of intestinal microflora improve prognosis in such patients and promote faster recovery.
For citation: Kanner E.V., Gorelov A.V., Maksimov M.L., Kanner I.D., Lapkin N.M. Modern approaches to the prevention and rehydration therapy of antibiotic-associated diarrhea affected by ARI in children. Meditsinskiy sovet = Medical Council. 2021;(1):149–156. (In Russ.) doi: 10.21518/2079-701X-2021-1-149-156.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Во всем мире для практикующих педиатров антибактериальные препараты (АБП) – это препараты выбора при многих инфекционных заболеваниях. Применение АБП существенно снизило количество тяжелых бактериальных инфекционных заболеваний и летальность у детей, особенно первого года жизни. Но широкое и неоправданное применение АБП, в т.ч. антибиотиков резерва (использование карбапенемов выросло на 45%, полимиксинов – на 13%), при неосложненных острых респираторных инфекциях (ОРИ), к сожалению, ставшее уже догматической привычкой, чревато серьезными последствиями, такими как рост антибиотикорезистентности возбудителей [1, 2]. Так, например, во Франции АБП применяют в 24% случаев, в США – в 25%, в Канаде – в 38% [3]. В Дании 60% детей до двух лет с признаками ОРИ получают минимум один курс АБП ежегодно [3]. В Китае 97% детей назначают антибиотик [3].
Большинство назначений АБП у детей делается в амбулаторной практике. В 80% случаев показаниями для их использования являются инфекции верхних и нижних дыхательных путей. Необоснованное применение антибиотиков ведет не только к росту резистентности микрофлоры, но и к нарушению нормальной микрофлоры организма; повышает риск развития нежелательных реакций; ведет к увеличению затрат на лечение [1, 2].
ОСЛОЖНЕНИЕ АНТИБИОТИКОТЕРАПИИ
Одним из частых осложнений антибиотикотерапии может быть развитие антибиотик-ассоциированной диареи (ААД). По данным различных авторов, частота развития ААД составляет 6–80% среди пациентов, получавших антибиотики, в среднем 35% (примерно каждый третий пациент) на фоне приема антибиотиков отмечают симптомы ААД [2, 4, 5].
Важно отметить, что развитие ААД может иметь отсроченный характер, в соответствии с чем Всемирная организация здравоохранения под ААД понимает три и более эпизода неоформленного стула в течение двух или более последовательных дней, развившихся на фоне или в течение двух месяцев после применения АБП [6].
Диагноз «ААД» устанавливают на основании связи диареи с применением антибиотиков. Способ введения антибиотика не имеет большого значения. При приеме внутрь антибиотик, помимо эрадикации микроорганизмов, воздействует на слизистую оболочку тонкой кишки. При парентеральном введении антибиотики влияют на биоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишок. Симптомы ААД у большинства больных обычно появляются во время лечения, а у 30% — в пределах 7–10 дней после его прекращения (иногда еще позже, на чем и основан акцент временного фактора при определении ААД) [6].
Изменения в составе микробиоты, вызванные воздействием АБП, и изменения, наблюдаемые при воспалительных заболеваниях кишечника, могут привести к изменению концентраций микроб-ассоциированных молекулярных паттернов (microbial-associated molecular pattern – MAMP) [7], ответственных за связывание с рецепторами клеток врожденного иммунитета. MAMP представляют собой эволюционно консервативные молекулы, экспрессируемые как патогенами, так и комменсалами, которые включают маркеры клеточной поверхности, такие как липополисахарид, полисахарид A, липотейхоевая кислота и пептидогликан. Концентрации МАМР обнаруживаются рецепторами распознавания паттерна (pattern recognition receptors – PRRs) дендритных клеток, М-клеток и кишечными эпителиальными клетками (IECs) [8]. Значительное изменение концентраций МАМР может нарушить гомеостаз лимфоидной ткани, связанной с кишечником, через ослабление барьера IECs и изменения продукции муцина, цитокинов и антимикробных пептидов IECs (рис. 1) [9].
Рисунок 1. Иммунный ответ хозяина на нарушение микробиоты антибиотиками [9]
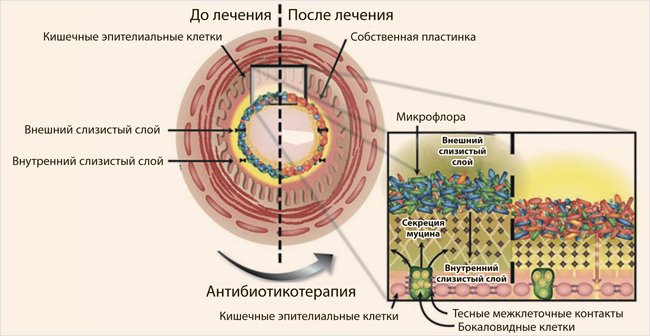
Нарушения качественного и количественного состава микрофлоры кишечника сопровождаются снижением защитных функций слизистой оболочки кишечника и способствуют росту патогенных и условно-патогенных микроорганизмов (Clostridium spp., Candida spp., Salmonella spp., Staphyloccus aureus) [10]. В табл. 1 представлена сравнительная характеристика идиопатической и Cl. difficile ААД. Практикующим врачам следует помнить, что в этиологической структуре ААД у детей преобладает инфекция, вызванная Cl. difficile, в некоторых исследованиях также была показана значительная доля вирусной этиологии [11]. Однако именно с инфекцией Cl. difficile ассоциировано развитие наиболее тяжелых случаев, вплоть до угрожающего жизни псевдомембранозного колита [11, 12].
Таблица 1. Сравнительная характеристика идиопатической и Cl. difficile ААД
| Наиболее частые «виновные» АБП | Клиндамицин, цефалоспорины, ампициллин | Амоксициллин/клавуланат, цефиксим, цефоперазон |
| Вероятность развития от дозы АБП | Низкая | Высокая |
| Отмена АБП | Диарея персистирует | Разрешение диареи |
| Лейкоциты в кале | У 50–80% пациентов | Не выявляются |
| Колоноскопия | Признаки колита у 50% пациентов | Патологии нет |
| Компьютерная томография | Признаки колита у 50% пациентов | Патологии нет |
| Осложнения | Токсический мегаколон, гипоальбуминемия, дегидратация | Крайне редко |
| Эпидемиология | Внутрибольничные вспышки, хроническое носительство | Спорадические случаи |
ПРОФИЛАКТИКА ОСЛОЖНЕНИЙ
Несомненно, ААД лучше предупредить, чем лечить! Профилактика – это прежде всего рациональное применение АБП, назначение пробиотиков совместно с АБП с 1-го дня антибиотикотерапии, поддержание нормальной кишечной микрофлоры, препятствие развитию патогенной микрофлоры. Анализ имеющихся данных свидетельствует, что устойчивость бактерий к АБП является характерным признаком конкретного штамма микроорганизма и это необходимо учитывать при выборе препарата. Принимая во внимание, что нарушение баланса между нормальной и условно-патогенной флорой комменсальной микробиоты кишечника лежит в основе патогенеза ААД, использование пробиотиков в лечении и профилактике данной нозологии давно является объектом РКИ [11]. Наиболее широко применялись бактериальные штаммы L. rhamnosus GG, L. acidophilus, Lactobacillus casei, Bifidobacterium sрp., Streptococcus sрp. и дрожжи S. boulardii, при этом данные большого числа двойных слепых плацебо-контролируемых исследований, полученные на большой выборке детского населения, а также клинические рекомендации Всемирной ассоциации гастроэнтерологов для профилактики ААД у детей рекомендуют применять пробиотический штамм L. rhamnosus GG – степень доказательности 1 [11, 13–16].
L. rhamnosus GG обладают хромосомной устойчивостью к ряду антибиотиков, которая варьируется в зависимости от вида и штамма [17, 18]. Плазмидной ДНК, опасной для распространения антибиотикоустойчивости среди других бактерий, они не содержат, что делает возможным их широкое лечебно-профилактическое использование [19]. У лактобацилл распространены плазмиды с малыми молекулярными массами (менее 10 МД).
Дополнительным обоснованием применения LGG в лечении бактериальных инфекционных заболеваний является его способность продуцировать 7 маленьких белков, проявляющих антибактериальную активность в отношении как грамотрицательных (Escherichia coli и Salmonella typhi), так и грамположительных (Staphylococcus aureus) бактерий [11, 20].
Ниже приведены клинические примеры течения ААД у детей, демонстрирующие вариабельность клинической картины. Практикующим врачам следует помнить, что клинические проявления могут варьировать от умеренно выраженных интестинальных расстройств до тяжелых форм поражения кишечника. Лихорадка при ОРИ у детей, особенно раннего возраста, основной опасностью которой является дегидратация вследствие значительных потерь воды при дыхании, и особенно возросшего потоотделения (в т.ч. при приеме жаропонижающих средств), требует особого внимания со стороны родителей и врачей. Следует помнить, что на каждый 1 °С повышения температуры потери воды возрастают примерно на 10%, а при наличии тахипноэ потери жидкости с перспирацией возрастают на 5–20 мл/кг/сут, у пациентов со значительным потоотделением – на 5–25 мл/кг/сут. Повышение температуры тела более опасно для детей до 3 мес. Используя критерии ВОЗ, оценивая степень дегидратации, можно сразу определить дефицит жидкости (табл. 2).
Таблица 2. Оценка дефицита жидкости у ребенка по ВОЗ
| Нет признаков обезвоживания | <5 | <50 |
| Некоторая степень обезвоживания | 5–10 | 50–100 |
| Обезвоживание в тяжелой форме | 10 | 100 |
Оценка тяжести дегидратации по клиническим данным, естественно, субъективна. Для этих целей ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology, and Nutrition – Европейская ассоциация детских гастроэнтерологов, гепатологов и диетологов) рекомендует использовать клиническую шкалу дегидратации CDS (Clinical Dehydration Scale): 0 баллов – дегидратация отсутствует, от 1 до 4 баллов – легкая дегидратация, 5–8 баллов соответствуют дегидратации средней и тяжелой степени (табл. 3) [21].
Таблица 3. Шкала дегидратации CDS
| Внешний вид | Нормальный | Жажда, беспокойство, раздражительность | Вялость, сонливость |
| Глазные яблоки | Тургор нормальный | Слегка запавшие | Запавшие |
| Слизистые оболочки | Влажные | Липкие, суховатые | Сухие |
| Слезы | Слезоотделение в норме | Слезоотделение снижено | Слезы отсутствуют |
Предупредить дегидратацию несложно, давая ребенку пить по потребности. Важно правильно оценивать степень дегидратации и использовать регидратирующие растворы со сниженной осмолярностью, которая согласно рекомендации ESPGHAN должна составлять 225–260 м/осм/л [21].
КЛИНИЧЕСКИЙ СЛУЧАЙ №1
Мальчик Петр К., 2 года 8 мес., заболел остро, заболевание началось с фебрильной лихорадки, ринита и увеличения шейных лимфоузлов. В клиническом анализе крови отмечено снижение гемоглобина до 109 г/л, цв. показатель 0,73, лейкопения умеренная 4,1 × 109/л, палочкоядерные клетки 3%, сегментоядерные клетки 39%, эозинофилы 10%, лимфоциты 33%, моноциты 15%, СОЭ 12 мм/ч. Назначен амоксициллина клавуланат в дозе 100 мг/кг/сут по амоксициллину, капли Ксимелин в нос, умифеновира гидрохлорида моногидрат, суппозитории с интерфероном, бромгексина гидрохлорид. На 2-е сут. болезни появились боли в животе, метеоризм.
Состояние ребенка расценено как развитие норовирусной инфекции, и в терапию добавлен нифуроксазид. На третьи сутки болезни и приема амоксициллина клавуланата и в первые сутки приема нифуроксазида отмечался подъем температуры тела до фебрильных цифр (39,3 °С), рвота до двух раз, диарея до 12 раз в сутки с примесью крови в последних порциях. В анализе крови на 4-е сут. отмечался лейкоцитоз до 20 × 109/л, палочкоядерные нейтрофилы 6%, сегментоядерные нейтрофилы 77%, СОЭ 24 мм/ч. Aнтитела к вирусу Эпштейна – Барр – отрицательные. В кале: АТ к токсинам Clostridium difficile A&B – положительно. ПЦР кала на ротавирус, калицивирус, норовирус – отрицательно.
Диагноз «Антибиотик-ассоциированный колит, ассоциированный с Clostridium difficile-инфекцией. Острая респираторная инфекция: назофарингит».
Для снижения интоксикации и восстановления водноэлектролитного баланса организма был назначен Нормобакт Аквабаланс – комбинация солей для оральной регидратации и пробиотика Lactobacillus rhamnosus GG высокой дозировки 5 млрд КОЕ, с низкой осмолярностью 233 мОсм/моль, по 50 мл после каждого эпизода жидкого стула. Дополнительно на 3-й день лечения, когда жидкий стул прекратился, для восстановления микрофлоры кишечника был рекомендован стандартизированный синбиотический продукт Нормобакт L, содержащий в своем составе L. rhamnosus GG – изолированный моноштамм LGG (Lactobacillus rhamnosus GG) в высокой концентрации 4 × 109 КОЕ, высокоадгезивный, с самой высокой способностью к колонизации, модифицирующий иммунный ответ, состав бактериальной флоры кишечника, проявляющий широкий спектр активности против условнопатогенных и патогенных микроорганизмов. Высокая адгезия к эпителиальным клеткам кишечного барьера и способность к колонизации желудочно-кишечного тракта у LGG связана с наличием уникальных выростов SpaCBA-, SpaDEF-пилей, играющих ключевую роль в этом процессе и формировании биопленки (рис. 2) [22].
Рисунок 2. Пили SpaCBA и молекулярные механизмы адгезии LGG

L. rhamnosus GG не только оказывает профилактическое действие ААД при приеме антибиотиков, но и имеет положительный доказанный эффект при респираторных инфекциях, доказанное направленное действие и сильное влияние на экосистему как тонкого, так и толстого кишечника. Нормобакт L был рекомендован ребенку для приема по 1 саше в день во время еды, после окончания курса лечения антибиотиками применение Нормобакта L составило 2 нед. На фоне проводимой терапии состояние ребенка улучшилось, стул нормализовался. Контрольный анализ кала на токсины А и В Сl. difficile – отрицательный.
Наши наблюдения отражают данные клинических исследований, согласно которым применение L. rhamnosus GG снижает риск развития инфекций верхних дыхательных путей на 34%, заболеваний, продолжающихся более 3 дней, — на 43%, уменьшает количество дней с симптомами инфекции дыхательных путей (р < 0,001), а также снижает (на 17%) частоту развития осложненных случаев инфекций дыхательных путей, в т. ч. инфекций нижних отделов респираторного тракта [23–25].
КЛИНИЧЕСКИЙ СЛУЧАЙ №2
Девочка Полина О., 5 лет, была госпитализирована в стационар на 7-й день болезни с диагнозом «Острый бронхит, острый риносинусит». Отмечались жалобы на повышение температуры тела до 38,5 оС, влажный кашель, насморк с гнойным отделяемым, головную боль. Из анамнеза известно, что заболевание началось с субфебрилитета до 37,7 оС и катаральных явлений со стороны органов верхних дыхательных путей. Амбулаторно получала симптоматическое лечение – без эффекта, что и послужило причиной госпитализации. Из анамнеза известно, что ребенок от второй беременности, протекавшей с незначительным токсикозом первой половины, вторых срочных родов (первый ребенок, мальчик, болеет хронической пневмонией, гайморитом). Масса при рождении 3 500 г, длина 51 см. Вскармливался естественно. Прикорм вводился своевременно. В массе прибавляла плохо. Вес в 1 год — 9 кг, в 2 года — 10,5 кг.
На первом году жизни трижды перенесла отит. Со второго года жизни — частые ОРВИ. Ребенок вакцинирован согласно Национальному календарю профилактических прививок. В стационаре наряду с общепринятой терапией назначен цефазолин по 700 мг × 3 раза в день в/м. На 8-е сут. с момента госпитализации температура тела повысилась до 38,3 оС, появилась рвота 4 раза, водянистый стул без примеси крови 7 раз в сутки, в связи с чем ребенок был переведен в кишечное отделение. При обследовании: бак. посев кала на кишечную группу и латекс-тест на ротавирусы и аденовирусы – отрицательные; анализ кала методом ИФА на токсины А и В Cl. difficile – положительный (на 11-й день применения цефазолина).
Клинический диагноз «Антибиотик-ассоциированная диарея, вызванная Cl. difficile. Токсикоз с эксикозом II степени. Острый бронхит. Острый риносинусит».
Лечение: метронидазол по 250 мг × 3 раза в день. Дополнительно для восстановления микрофлоры кишечника был рекомендован синбиотик Нормобакт L по два саше в день во время еды, предварительно растворенный перед применением в воде.
На фоне проводимого лечения состояние ребенка улучшилось: исчезли симптомы интоксикации, стул нормализовался, рвота не повторялась. Контрольный анализ кала на токсины А и В Cl. difficile – отрицательный. В период реконвалесценции получала Нормобакт L по 1 саше один раз в день в течение двух недель.
Данная схема терапии показала высокую эффективность и является оправданной, учитывая результаты исследований, демонстрирующие, что LGG ускоряют выздоровление больных с острой диареей. В настоящее время LGG является единственным пробиотическим штаммом, снижающим риск развития диареи и продолжительность заболевания более трех дней — результат, который был получен во всех проведенных исследованиях (степень рекомендаций: для лечения острой инфекционной диареи 1a для LGG, для профилактики ААД 1b). Наилучшие показатели отмечены при максимально раннем приеме пробиотика после появления первых симптомов, до развития дегидратации.
Стоит отметить, что LGG – штамм, модифицирующий иммунный ответ с усилением неспецифического звена иммунитета за счет активации как гуморального звена иммунитета, в т.ч. за счет увеличения выработки секреторного иммуноглобулина A, так и клеточного звена иммунитета, увеличения фагоцитарной активности, индуцирования выработки интерферона. Таким образом, включение средства с Lactobacillus rhamnosus GG (Нормобакт L) в схему комплексного лечения детей, особенно с частыми ОРИ, приводит к укреплению их иммунитета и скорейшему выздоровлению Прием Нормобакта L таким детям может быть рекомендован по следующей схеме: по два саше в день во время еды в течение 5 дней, предварительно растворив перед применением в воде, с продолжением курса приема по одному саше в день во время еды в течение 10 дней.
КЛИНИЧЕСКИЙ СЛУЧАЙ №3
Мальчик Семен П., 5,5 года, посещает детский сад с 1 года 9 мес. С этого времени у ребенка отмечаются частые респираторные инфекции (до 10–12 раз в год), с применением антибиотиков до 4–5 раз в год.
Болен вторые сутки, заболел остро, с повышения температуры тела до 39,1 ºС, озноб, жалобы на головную боль, боль в горле при глотании, однократная рвота. При осмотре участковым педиатром: состояние средней тяжести. Температура тела 38,9 ºС. Кожные покровы чистые, румянец на щеках. Губы яркие, гиперемированы. Слизистая ротоглотки (дужек, миндалин) ярко гиперемирована. Миндалины увеличены до II размера, с обеих сторон в лакунах бело-желтый налет, легко снимающийся шпателем, подлежащая поверхность миндалины не кровоточит. Язык суховат. Переднешейные лимфоузлы увеличены до 1,5 см, болезненны при пальпации. Дыхание везикулярное, без хрипов, ЧДД 20 в минуту. Тоны сердца ясные, ритмичные, ЧСС 112 в минуту. Живот мягкий, безболезненный. Паренхиматозные органы не увеличены. Физиологические отправления не нарушены. Анализ крови: гемоглобин – 124 г/л, эритроциты – 4,1 × 1012/л, лейкоциты – 22 × 109/л, палочкоядерные нейтрофилы – 8%, сегментоядерные нейтрофилы – 72%, лимфоциты – 17%, моноциты – 3%, СОЭ – 25 мм/ч.
Диагноз «Острый тонзиллит (лакунарный), средней степени тяжести».
Лечение: амоксициллин + клавулановая кислота по 250 мг препарата 3 раза в сутки 7 дней; симптоматическое лечение.
Для восстановления водно-электролитного баланса организма при лихорадке был рекомендован Нормобакт Аквабаланс по 1 пакетику «Дуокам», предварительно растворенному в 200 мл охлажденной кипяченой воды, 4 раза в день в течение 3 сут., на 4-е сут. для восстановления микрофлоры кишечника был рекомендован синбиотик Нормобакт L по 1 саше один раз в день в течение 10 дней, диетотерапия.
На фоне терапии на 3-и сут. состояние ребенка с улучшением, нормализовалась температура тела; рекомендовано продолжить проводимую терапию. Применение Нормобакта Аквабаланс, представляющего собой комбинацию солей для оральной регидратации и пробиотика Lactobacillus rhamnosus GG высокой дозы 5 × 109 KOE, с низкой осмолярностью 233 мОсм/ моль в уникальном двухкамерном пакетике «Дуокам» (DUOCAM), может быть рекомендовано для детей с первых дней жизни и взрослых для регидратации на фоне лихорадки для восстановления водно-электролитного баланса и улучшения самочувствия. Осмолярность готового раствора Нормобакт Аквабаланс соответствует рекомендациям ESPHGAN. Регидратационная терапия является неотъемлемой частью лечения различных категорий больных, особенно при ОРИ, когда в остром периоде отмечается недостаточное поступление жидкости с пищей за счет снижения аппетита и отказа детей от питья.
ЗАКЛЮЧЕНИЕ
Таким образом, пероральная регидратация является важным методом лечения инфекционных заболеваний у детей.
Рассмотренные нами клинические случаи показывают небезопасность антибактериальной терапии препаратами широкого спектра действия. Осложнения, возникающие у пациентов, особенно детского возраста, после приема АБП, заболевания, которые могут приводить к нарушениям водно-электролитного баланса, являются жизнеугрожающими состояниями, требуют немедленной помощи. Как следствие, коррекция водноэлектролитного баланса, а также своевременное восстановление микрофлоры кишечника улучшают прогноз у таких пациентов, способствуют скорейшему выздоровлению.
Список литературы / References
- Романова О.Н., Довнар-Запольская О.Н., Преображенская О.А., Матуш Л.И., Сергей Ж.С., Манкевич Р.Н. и др. Антибиотикоассоциированная диарея у детей, обусловленная Clostridium difficilt-инфекцией: клинические особенности, диагностика и лечение. Клиническая инфектология и паразитология. 2020;9(1):50–70. doi: 10.34883/PI.2020.9.1.005. / Romanova O.N., Dovnar-Zapolskaya O.N., Preobrazhenskaya O.A., Matush L.I., Sergey Zh.S., Mankevich R.N. et al. Antibiotic-Associated Diarrhea in Children Caused by Clostridium Difficile Infection: Clinical Features, Diagnosis and Treatment. Klinicheskaya infektologiya i parazitologiya = Clinical Infectology and Parasitology. 2020;9(1):50–70. (In Russ.) doi: 10.34883/PI.2020.9.1.005.
- Захарова И.Н., Бережная И.В., Сугян Н.Г. Антибиотик-ассоциированные диареи у детей: что нового? Медицинский совет. 2017;(19):126–133. doi: 10.21518/2079-701X-2017-19-126-133. / Zakharova I.N., Berezhnaya I.V., Sugyan N.G. Antibiotic associated diarheas in children: what’s new? Meditsinskiy sovet = Medical Council. 2017;(19):126–133. (In Russ.) doi: 10.21518/2079-701X-2017-19-126-133.
- Харченко О.Ф. Антибиотикоассоциированная диарея у детей: новые возможности лечения. Международные обзоры: клиническая практика и здоровье. 2014;(3):82–88. Режим доступа: https://www.elibrary.ru/item.asp?id=21978635. / Kharchenko O.F. Antibiotic-associated diarrhea in children: new treatment options. Mezhdunarodnye obzory: klinicheskaya praktika i zdorov’e = International reviews: Clinical Practice and Health. 2014;(3):82–88. (In Russ.) Available at: https://www.elibrary.ru/item.asp?id=21978635.
- Bartlett J.G. Clinical practice. Antibiotic-associated diarrhea. N Eng J Med. 2002;346(5):334–339. doi: 10.1056/NEJMcp011603.
- Barakat M., El-Kady Z., Mostafa M., Ibrahim N, Ghazaly H. Antibioticassociated Bloody Diarrhea in Infants: Clinical, Endoscopic and Histopathologic Profiles. J Pediatr Gastroenterol Nutr. 2011;52(1):60–64. doi: 10.1097/MPG.0b013e3181da215b.
- Успенский Ю.П., Фоминых Ю.А. Антибиотик-ассоциированная диарея: актуальность проблемы, профилактика и терапия. Архивъ внутренней медицины. 2013;2(10):46–53. doi: 10.20514/2226-6704-2013-0-2-46-53. / Uspenskiy Yu.P., Fominykh Yu.A. Antibiotic-associated diarrhea: urgency of the issue, prevention, and therapy. Arkhiv vnutrenney meditsiny = The Russian Archives of Internal Medicine. 2013;2(10):46–53. (In Russ.) doi: 10.20514/2226-6704-2013-0-2-46-53.
- Пинегин Б.В., Хаитов Р.М. Современные принципы создания иммунотропных лекарственных препаратов. Иммунология. 2019;40(6):57–62. doi: 10.24411/0206-4952-2019-16008. / Pinegin B.V., Khaitov R.M. Modern principles of immunotropic drugs creation. Immunologiya = Immunology. 2019;40(6):57–62. (In Russ.) doi: 10.24411/0206-4952-2019-16008.
- Hooper L.V. Do symbiotic bacteria subvert host immunity? Nat Rev Microbiol. 2009;7(5):367–374. doi: 10.1038/nrmicro2114.
- Wlodarska M., Finlay B. Host immune response to antibiotic perturbation
of the microbiota. Mucosal Immunol. 2010;3(2):100–103. doi: 10.1038/mi.2009.135. - Плоскирева А.А., Горелов А.В., Голден Л.Б. Антибиотик-ассоциированная диарея: патогенетические аспекты терапии и профилактики. РМЖ.
2017;(19):1381–1384. Available at: https://www.rmj.ru/. / Ploskireva A.A., Gorelov A.V., Golden L.B. Antibiotic-associated diarrhea: pathogenetic aspects of therapy and prevention. RMZh = RMJ. 2017;(19):1381–1384. Available at: https://www.rmj.ru/. - Захарова И.Н., Борзова Е.Ю., Симакова М.А. Lactobacillus rhamnosus GG:
опыт применения в детской гастроэнтерологической практике. Российский вестник перинатологии и педиатрии. 2019;64(6):20–29. doi: 10.21508/1027-4065-2019-64-6-20-29. / Zakharova I.N., Borzova E.Yu., Simakova M.A. Lactobacillus rhamnosus GG: experience in pediatric gastroenterology. Rossiyskiy vestnik perinatologii i pediatrii = Russian Bulletin of Perinatology and Pediatrics. 2019;64(6):20–29. (In Russ.) doi: 10.21508/1027-4065-2019-64-6-20-29. - Hurley B.W., Nguyen C.C. The spectrum of pseudomembra-nous enterocolitis
and antibiotic-associated diarrhea. Arch Intern Med. 2002;162(19):2177–2184. doi: 10.1001/archinte.162.19.2177. - Szajewska H., Kołodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther. 2015;42(10):1149–1157. doi: 10.1111/apt.13404.
- Goldenberg J.Z., Lytvyn L., Steurich J., Parkin P., Mahant S., Johnston B.C. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev. 2015;(12):CD004827. doi: 10.1002/14651858.CD004827.pub4.
- Blaabjerg S., Artzi D.M., Aabenhus R. Probiotics for the prevention of antibiotic-associated diarrhea in outpatients – a systematic review and metaanalysis. Antibiotics (Basel). 2017;6(4):21. doi: 10.3390/antibiotics6040021.
- Guarner F., Sanders M.E., Eliakim R., Fedorak R., Gangl A., Garisch J. et al. WGO Practice Guidelines – Probiotics and prebiotics. 2017. Available at:
https://www.worldgastroenterology.org/. - Charteris W.P., Kelly P.M., Morelli L., Collins J.K. Gradient diffusion antibiotic susceptibility testing of potentially probiotic lactobacilli. J Food Prot. 2001;64(12):2007–2014. doi: 10.4315/0362-028x-64.12.2007.
- Shah N.P. Probiotic bacteria: selective enumeration and survival in dairy foods. J Dairy Sci. 2000;83(4):894–907. doi: 10.3168/jds.S0022-0302(00)74953-8.
- Глушанова Н.А. Биологические свойства лактобацилл. Бюллетень сибирской
медицины. 2003;2(4):50–58. doi: 10.20538/1682-0363-2003-4-50-58. / Glushanova N.A. Biological properties of lactobacillus. Byulleten’ sibirskoy meditsiny = Bulletin of Siberian Medicine. 2003;2(4):50–58. (In Russ.) doi: 10.20538/1682-0363-2003-4-50-58. - Lu R., Fasano S., Madayiputhiya N., Morin N.P., Nataro J., Fasano A. Isolation, Identification, and Characterization of Small Bioactive Peptides
From Lactobacillus GG Conditional Media That Exert Both Anti-Gramnegative and Gram-positive Bactericidal Activity. J Pediatr Gastroenterol Nutr. 2009;49(1):23–30. doi: 10.1097/MPG.0b013e3181924d1e. - Guarino A., Ashkenazi Sh., Gendrel D., Lo Vecchio A., Shamir R., Szajewska H. European Society for Paediatric Gastroenterology, Hepatology, and Nutrition/European Society for Paediatric Infectious Diseases Evidencebased Guidelines for the Management of Acute Gastroenteritis in Children in Europe. J Pediatr Gastroenterol Nutr. 2014;59(1):132–152. doi: 10.1097/MPG.0000000000000375.
- Segers M.E., Lebeer S. Towards a better understanding of Lactobacillus
rhamnosus GG – host interactions. Microb Cell Fact. 2014;13(1 Suppl.):7. doi: 10.1186/1475-2859-13-S1-S7. - Hatakka K., Savilahti E., Ponka A., Meurman J.H., Poussa T., Näse L. et al. Effect of long term consumption of probiotic milk on infections in children attending day care centres: double blind, randomised trial. BMJ. 2001;322(7298):1327. doi: 10.1136/bmj.322.7298.1327.
- Hojsak I., Snovak N., Abdovic S., Szajewska H., Misak Z., Kolacek S. et al. Lactobacillus GG in the prevention of gastrointestinal and respiratory
tract infections in children who attend day care centers: a randomized, double-blind, placebo-controlled trial. Clin Nutr. 2010;29(3):312–316. doi: 10.1016/j.clnu.2009.09.008. - Андреева И.В. Современные доказательные данные эффективности применения Lactobacillus Rhamnosus GG и Bifidobacterium Lactis ВB-12 в педиатрической практике. Вопросы современной педиатрии. 2011;10(1):50–57. Режим доступа: https://vsp.spr-journal.ru/. / Andreyeva I.V. Evidence-based data on effectiveness of lactobacillus rhamnosus Gg and bifidobacterium Lactis ВB-12 in pediatric practice. Voprosy sovremennoi pediatrii = Current Pediatrics. 2011;10(1):50–57. (In Russ.) Available at: https://vsp.spr-journal.ru/.
