
Журнал "Медицинский совет" №23/2022
DOI: 10.21518/2079-701X-2022-16-23-50-59
Е.Н. Кабаева1*, https://orcid.org/0000-0002-7941-2010
А.В. Ершов2,3, https://orcid.org/0000-0001-5758-8552
П.Ф. Литвицкий2, https://orcid.org/0000-0003-0151-9114
Д.T. Реджепов1, https://orcid.org/0000-0003-3203-6676
А.А. Поздняков2, https://orcid.org/0000-0003-0032-9917
1 Российский университет дружбы народов; Россия, 117198, Москва, ул. Миклухо-Маклая, д. 6
2 Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); Россия, 119991, Москва, ул. Большая Пироговская, д. 2, стр. 4
3 Научно-исследовательский институт общей реаниматологии имени В.А. Неговского Федерального научно-клинического центра реаниматологии и реабилитологии; Россия, 107031, Москва, ул. Петровка, д. 25, стр. 2
Введение. COVID-19 повышает риск развития ишемического инсульта (ИИ), однако при этом мало изученным остается влияние COVID-19 на течение восстановительного периода после ИИ.
Цель. Выявить закономерности и особенности течения и проявлений раннего и позднего этапов восстановительного периода после ИИ, развившегося у пациентов на фоне COVID-19.
Материалы и методы. Обследован 81 пациент, разделенный на 3 группы: 1) с ИИ на фоне COVID-19 (n = 21); 2) с инфицированием COVID-19 без ИИ (n = 40); 3) с ИИ без COVID-19 (n = 20). У пациентов с инсультом исследовали степень тяжести инсульта (шкала NIHSS), функциональный статус (шкала Рэнкина), уровень повседневной активности (шкала Бартел). У всех обследуемых оценивали жалобы, общее состояние, уровень активности, способность к самообслуживанию, эмоциональный статус. Анализировали тяжесть течения инсульта, функциональный статус, объем поражений легких по МСКТ, наличие сердечно-сосудистых заболеваний, показатели общего и биохимического анализа крови, динамику уровня цитокинов IL-6, IL-8, IL-10, TNF-α в крови. Со всеми обследуемыми проводили телефонное интервьюирование в течение 12 мес. после выписки из стационара.
Результаты. Наибольшая смертность на постгоспитальном этапе (67%) была у пациентов, перенесших ИИ на фоне COVID-19, при этом половина зарегистрирована в первые 3 мес., к концу 6-го месяца этот показатель составил 79%. Летальные исходы у пациентов с ИИ, развившиеся на фоне COVID-19, наступали на 6 мес. раньше, чем в группе пациентов с ИИ без COVID-19. Основными причинами фатальных исходов у пациентов с ИИ на фоне COVID-19 в первые 3 мес. были острый инфаркт миокарда и повторные инсульты. Высокая частота неблагоприятных реабилитационных прогнозов и летальных исходов как в остром периоде заболевания, так и на постгоспитальном этапе отмечалась у пациентов с высокой коморбидностью.
Заключение. Пациенты, перенесшие ИИ на фоне COVID-19, в первые 3 мес. постгоспитального периода входят в группу повышенного риска развития тромботических и тромбоэмболических осложнений и летального исхода.
Для цитирования: Кабаева Е.Н., Ершов А.В., Литвицкий П.Ф., Реджепов Д.T., Поздняков А.А. Закономерности и особенности течения раннего и позднего этапов восстановительного периода после ишемического инсульта, развившегося на фоне COVID-19. Медицинский Совет. 2022;(23):50-59. https://doi.org/10.21518/2079-701X-2022-16-23-50-59
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Patterns and features of the course of the early and late stages recovery period after ischemic stroke associated with COVID-19
Ekaterina N. Kabaeva1*, https://orcid.org/0000-0002-7941-2010
Anton V. Ershov2,3, https://orcid.org/0000-0001-5758-8552
Peter F. Litvitskiy2, https://orcid.org/0000-0003-0151-9114
Dovlet T. Rejepov1, https://orcid.org/0000-0003-3203-6676
Artem A. Pozdnyakov2, https://orcid.org/0000-0003-0032-9917
1 Peoples’ Friendship University of Russia; 6, Miklukho-Maklai St., Moscow, 117198, Russia
2 Sechenov First Moscow State Medical University (Sechenov University); 2, Bldg. 4, Bolshaya Pirogovskaya St., Moscow, 119991, Russia
3 Negovsky Research Institute of General Resuscitation of the Federal Scientific and Clinical Center for Resuscitation and Rehabilitology; 2, Bldg. 25, Petrovka St., Moscow, 107031, Russia
Introduction. COVID-19 increases the risk of ischemic stroke (IS), but the impact of COVID-19 on the recovery period of IS remains poorly understood.
The aim of the study – to identify patterns and features of the course and manifestations of the early and late stages of the recovery period after ischemic stroke associated with COVID-19.
Materials and methods. The combined retro-prospective study included 81 patients. Patients were divided into three groups: 1) development of stroke followed by outcome in ischemic stroke (IS) associated with COVID-19 (n = 21); 2) COVID-19 infection without stroke (n = 40). 3) development of stroke without COVID-19 (n = 20). All subjects were interviewed by telephone within 12 months from the date of discharge from the hospital. In patients with stroke, the severity of stroke (NIHSS scale), functional status (Rankine scale), and daily activity level (Bartel scale) were studied. All subjects were interviewed by telephone within 12 months from the moment of discharge from the hospital, the following were assessed: complaints, general condition of patients, the patient's level of activity and ability to self-care, emotional status and the presence of anxiety and depressive disorders. The following were retrospectively assessed: stroke severity, functional status, volume of lung lesions according to MSCT, the presence of cardiovascular diseases, indicators of general and biochemical blood tests, changes in blood levels of cytokines IL-6, IL-8, IL-10, TNF-α.
Results. The highest mortality at the post-hospital stage (only 67 and 47% of the total number of deaths) was in patients who had an ischemic stroke associated with COVID-19; half of them were registered in the first 3 months; by the end of the 6th month, this figure was 79%. Deaths in patients with IS due to COVID-19 occur 6 months earlier than in the group of patients with stroke without COVID-19. The leading causes of fatal outcomes in patients with IS due to COVID-19 in the first 3 months were acute myocardial infarction and repeated strokes. A high frequency of unfavorable rehabilitation prognoses and deaths both in the acute period of the disease and at the post-hospital stage was observed in patients with high comorbidity with forms of pathology of the circulatory system.
Conclusion. Patients who have had an ischemic stroke associated with COVID-19, in the first 3 months of the post-hospital period, are at an increased risk of developing thrombotic complications and death and require special attention of outpatient doctors in this period after discharge from the hospital.
For citation: Kabaeva E.N., Ershov A.V., Litvitskiy P.F., Rejepov D.T., Pozdnyakov A.A. Patterns and features of the course of the early and late stages recovery period after ischemic stroke associated with COVID-19. Meditsinskiy sovet = Medical Council. 2022;(23):50-59. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-23-50-59
Conflict of interest: the authors declare no conflict of interest.
Введение
Коронавирусная инфекция остается одной из наиболее актуальных медико-социальных проблем современной системы здравоохранения. У многих пациентов заболевание COVID-19 играет роль триггера острых сосудистых катастроф, наиболее тяжелым проявлением которых является инсульт [1–3].
Согласно данным профильных стационаров 15–20% случаев острого нарушения мозгового кровообращения с исходом в инсульт, возникшего на фоне инфицирования SARS-CoV-2, заканчиваются летально [3, 4]. Помимо этого, более чем у 1/3 пациентов, выписанных в удовлетворительном состоянии из специализированных стационаров с инсультом и COVID-19, отмечаются признаки декомпенсации сопутствующих соматических форм патологии, неблагоприятный реабилитационный прогноз и функциональный исход [3, 5]. У 1/2 пациентов, перенесших COVID-19, развивается устойчивый комплекс нарушений, включающий в себя вегетоэндокринную дисфункцию, психоэмоциональные расстройства, недостаточность функций различных органов и их систем, обозначенный как постстковидный синдром (ПКС) [6]. С 2021 г. ПКС включен в Международную классификацию болезней 10-го пересмотра.
У пациентов с ишемическим инсультом (ИИ) на фоне коронавирусной инфекции ПКС в постгоспитальный период протекает в более тяжелых формах [6, 7]. При этом наблюдаются выраженные явления декомпенсации при развитии сопутствующих форм патологии, а также острые расстройства кровообращения, в том числе в мозге и сердце. Подобные проявления ПКС обусловлены сочетанным действием патогенных факторов повреждения мозга в результате как его ишемии, так и инфицирования SARS-CoV-2 [7, 8]. Согласно литературным данным различные клинические проявления ПКС наблюдаются преимущественно в период от 3 мес. до 1 года после дебюта инфекции. У пациентов, перенесших инсульт, длительность и проявления ПКС широко варьируют [8, 9]. В течение первых 6 мес. после излечения от коронавирусной инфекции у этих пациентов отмечается высокая частота госпитализаций, в основном в стационары кардиологического и неврологического профиля. На этот же период приходится наибольшее число госпитальных и внегоспитальных летальных исходов [9].
В более поздние сроки, на 6–12-м месяце постгоспитального периода, развиваются такие формы патологии, как гломерулонефрит, пиелонефрит, полинейропатия, хронический бронхит / трахеобронхит, пневмонии, нарушения функций желудочно-кишечного тракта [9, 10].
Несмотря на внедрение различных профилактических мероприятий и реабилитационных методик, частота ПКС и его осложнений у пациентов с перенесенным ИИ как на раннем, так и на позднем этапе постгоспитального периода остается весьма высокой. В связи с этим ведение таких пациентов на разных этапах восстановительного периода после ИИ, развившегося на фоне COVID-19, представляет собой одну из сложнейших задач, особенно для врачей амбулаторного звена. Это требует у таких пациентов тщательного исследования механизмов восстановительного периода, а также разработки эффективных алгоритмов лечебно-профилактических мероприятий с целью повышения эффективности у них медицинской помощи.
Цель настоящей работы – выявить закономерности и особенности течения и проявлений раннего (первые 6 мес.) и позднего (6–12 мес.) этапов восстановительного периода после ИИ, развившегося у пациентов на фоне COVID-19.
Материалы и методы
В исследование был включен 81 пациент. Средний возраст обследованных составил 62 ± 10 лет. Все пациенты проходили стационарное лечение в условиях Городской клинической больницы (ГКБ) имени В.В. Виноградова в период с ноября 2020 по февраль 2021 г. Исследование на постгоспитальном этапе проводилось по 28 февраля 2022 г. включительно. Пациенты были разделены на три группы: 1) с ИИ на фоне COVID-19 (n = 21); 2) с COVID-19 без ИИ (n = 40); 3) с ИИ без COVID-19 (n = 20).
У всех групп пациентов исследовали основные клинические показатели. У пациентов с инсультом оценивали риск повторного инсульта по шкале риска повторного инсульта ESRS (Essen Stroke Risk Score) (табл. 1).
Таблица 1. Характеристика пациентов, включенных в исследование, n (%)
| Показатель | Основная группа – с ИИ на фоне COVID-19 (n = 21) | Группа сравнения – с COVID-19 без ИИ (n = 40) | Группа с ИИ без COVID-19 (n = 20) | Всего (n = 81) |
| Возраст, М ± SD, лет | 62 ± 10 | 63 ± 6 | 61 ± 9 | 62 ± 10 |
| Артериальная гипертензия | 21 (100%) | 28 (70%) | 20 (100%) | 69 (85%) |
| Сахарный диабет | 7 (33%) | 9 (23%) | 7 (32%) | 22 (27%) |
| Инфаркт миокарда в анамнезе | 4 (19%) | 5 (12,5%) | 7 (30%) | 16(19,7%) |
| ИБС, сердечная недостаточность, желудочковая аритмия | 15 (72%) | 16 (40%) | 17 (89%) | 49(60,5%) |
| Фибрилляция предсердий | 11 (51%) | 9 (24%) | 11 (55%) | 31 (38%) |
| Заболевания периферических артерий | 8 (35%) | 12 (30%) | 7 (32%) | 27 (33%) |
| Курение | 11 (50%) | 19 (48%) | 8 (40%) | 38(46,9%) |
| Повторные ТИА и ИИ (госпитальный этап) | 9 (43,8%) | – | 5 (26,3%) | 14 (17%) |
| Ожирение | 12 (57%) | 20 (50%) | 21 (51%) | 53 (65%) |
| Риск повторного инсульта по ESRS: – низкий; – средний; – высокий | 8 (38%) 8 (38%) 5 (24%) | – | 5 (25%) 9 (40%) 6 (37%) | 25 (31%) 34 (42%) 22 (27%) |
Примечание. ИБС – ишемическая болезнь сердца; ИИ – ишемический инсульт; ТИА – транзиторная ишемическая атака; ESRS – шкала риска повторного инсульта (Essen Stroke Risk Score).
Для профилактики повторного инсульта всем пациентам проводилось стандартизированное лечение следующими группами препаратов: антитромботическими (антитромбоцитарными) (аспирин, клопидогрел) или антикоагулянтами (варфарин, прадакса), антигипертензивными и статинами.
Пациентам с ИИ при поступлении в стационар, выписке и на постгоспитальном этапе в динамике оценивали степень тяжести инсульта (шкала NIHSS (National Institutes of Health Stroke Scale – Шкала инсульта Национального института здоровья)), функциональный исход (шкала Рэнкина), уровень повседневной активности (шкала Бартел). Пациенты с инсультом при поступлении в стационар были сопоставимы как по тяжести течения инсульта по шкале NIHSS (медиана (Ме) была равна 10,5 баллов, что свидетельствовало о средней степени тяжести), так и по наличию и выраженности сопутствующих сердечно-сосудистых заболеваний.
Функциональный исход по шкале Рэнкина на момент выписки из стационара в обеих группах был равен 4 (Ме), что соответствует признакам состояния выраженного неврологического дефицита и потребности пациента в посторонней помощи. Оценка по шкале Бартел при выписке из стационара свидетельствовала о выраженной зависимости пациента от посторонней помощи в основной группе (средняя сумма баллов 55 ± 24) и об умеренной зависимости от посторонней помощи в группе пациентов без COVID-19 (80 ± 14).
Пациенты с коронавирусной инфекцией при поступлении были идентичны по тяжести течения инфекции и объему поражения легочной ткани по результатам мультиспиральной компьютерной томографии (МСКТ): все имели степень поражения легких КТ1 (10–25%) и КТ2 (25–50%).
Исследование выполнено в соответствии с этическими нормами Хельсинкской декларации Всемирной медицинской ассоциации (1964, 2004), от всех пациентов получено письменное добровольное информированное согласие. Работа одобрена этическим комитетом ГКБ имени В.В. Виноградова.
Всем обследуемым проводилось телефонное интервьюирование в течение последующих 12 мес. с момента выписки из стационара (в конце 3, 6, 9, 12-го месяца).
Методом анкетирования оценивали:
– жалобы на слабость и усталость, не связанные с наличием парезов, по шкале от 1 до 10 баллов (от 1 до 4 их расценивали как легкие, от 5 до 7 – средние, от 8 до 10 – сильные);
– наличие или отсутствие признаков декомпенсации сопутствующих форм патологии;
– изменение уровня артериального давления, частоту сердечных сокращений (по данным пациентов или их родственников, которые вели дневник наблюдений);
– уровень активности пациента;
– способность к самообслуживанию (по шкале Бартел);
– эмоциональный статус и наличие тревожно-депрессивных расстройств (по шкале депрессии Гамильтона).
Сведения о времени и причинах смерти получали от родственников пациентов, а также из протоколов аутопсий в ГКБ имени В.В. Виноградова. Ретроспективно анализировали клинико-лабораторные показатели на госпитальном этапе.
При ИИ исследовали:
– тяжесть неврологической симптоматики по шкале NIHSS;
– функциональный статус пациентов (по шкале Бартел);
– объем поражений легких по МСКТ;
– наличие заболеваний системы кровообращения;
– показатели общего и биохимического анализа крови;
– динамику уровней в крови цитокинов: интерлейкина (IL) 6, IL-8, IL-10, фактора некроза опухоли (TNF) α.
Статистический анализ фактических данных проводили с использованием программного обеспечения IBM SPSS Statistics 20 и RStudio 2021.09.3+396. Различия считались статистически значимыми при p < 0,05. Описательная статистика непрерывных количественных данных представлена в виде среднего значения (M) и стандартного отклонения (±SD) при нормальном распределении, а также в виде медианы (Mе), значений 25-го и 75-го процентилей (P25–P75) при ненормальном распределении, установленном в большинстве случаев. Для сравнения двух независимых непараметрических выборок использовали критерий Манна – Уитни, для множественного сравнения – Краскелла – Уоллиса. Для сравнения двух зависимых непараметрических выборок использовали критерий Уилкоксона, для множественного сравнения – критерий Фридмана. Качественные переменные сравнивались с помощью теста χ2 Пирсона (таблицы сопряженности). Анализ выживаемости пациентов проводили путем построения кривой по методу Каплана – Майера с оценкой факторов риска с применением регрессионного анализа Кокса.
Результаты
За весь период 12-месячного наблюдения на постгоспитальном этапе во всех группах обследованных умерли 30 пациентов (37%). Наибольшее число летальных исходов на постгоспитальном этапе было зафиксировано у перенесших ИИ на фоне COVID-19: в 2 раза больше, чем в группе пациентов с COVID-19 без ИИ и в 1,2 раза больше, чем у пациентов с ИИ без коронавирусной инфекции (p < 0,05) При анализе выживаемости пациентов на постгоспитальном этапе в течение 12 мес. выявлено, что все летальные исходы у пациентов основной группы (ИИ на фоне COVID-19) зафиксированы в первые 9 мес. после выписки из стационара. Из них половина смертей зарегистрирована в первые 3 мес. (в 3 раза больше, чем у пациентов с ИИ без COVID-19). К концу 6-го месяца летальность составила 79%. В отличие от этого, летальные исходы в группе пациентов с ИИ без коронавирусной инфекции фиксировались равномерно на всех этапах 12-месячного наблюдения (табл. 2).
Таблица 2. Количество летальных исходов в исследуемых группах пациентов в течение 12 месяцев после выписки из стационара, n (%)
| Исследуемый период | Основная группа – с ИИ на фоне COVID-19 (n = 14 (47%)) | Группа сравнения – с COVID-19 без ИИ (n = 5 (17%)) | Группа пациентов с ИИ без COVID-19 (n = 11 (37%)) | Всего (n = 30 (100%)) |
| Первые 3 месяца | 7 (50%) | 1 (20%) | 2 (18%) | 10 (33%) |
| От 3 до 6 месяцев | 4 (29%) | 2 (40%) | 1 (9%) | 7 (23%) |
| От 6 до 9 месяцев | 3 (21%) | 1 (20%) | 5 (45%) | 9 (30%) |
| От 9 до 12 месяцев | 0 (0%) | 1 (20%) | 3 (27%) | 4 (13%) |
Примечание. ИИ – ишемический инсульт.
Данные табл. 2 свидетельствуют о том, что сочетание острого ИИ и COVID-19 является фактором высокого риска неблагоприятного исхода в первые 3 мес. после выписки из стационара. Это требует особого внимания сотрудников амбулаторного звена в отношении указанной группы пациентов на раннем постгоспитальном этапе. Анализ выживаемости проводился путем построения показателей выживаемости по методу Каплана – Майера (рис. 1).
Рисунок 1. Показатели выживаемости в исследуемых группах пациентов (метод Каплана – Майера)
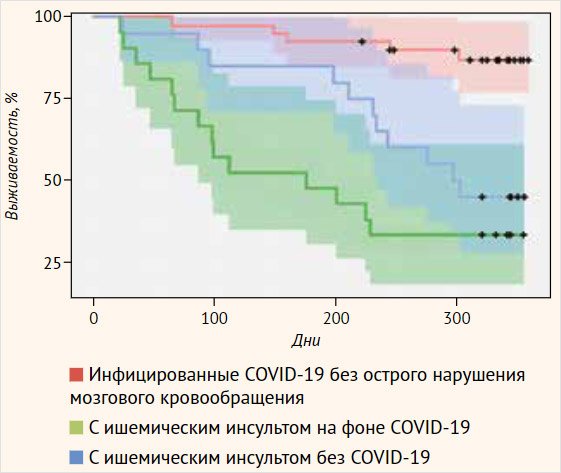
Анализ полученных результатов показал, что имеются статистически значимые различия между данными по выживаемости пациентов с ИИ на фоне COVID-19 и с ИИ без COVID-19 (p < 0,0001), а также между группой пациентов с COVID-19 без ИИ и ИИ без COVID-19 (p = 0,00045). Между показателями выживаемости группы пациентов с ИИ без COVID-19 и основной группы статистической разницы не наблюдалось (p = 0,15).
В целом результаты анализа выявили важный факт: летальные исходы у пациентов с ИИ, развившимся на фоне COVID-19, наступают на 6 мес. раньше, чем в группе пациентов с инсультом без COVID-19.
Регрессионный анализ Кокса также свидетельствует о том, что в течение года после выписки из стационара показатель отношения риска летальных исходов в группе пациентов с ИИ без коронавирусной инфекции к таковому в группе сравнения (пациенты с COVID-19) составлял 5,19 (95%-й доверительный интервал (95% ДИ) 1,80–15,0, p = 0,002). В отличие от этого, показатель отношения риска летальных исходов в основной группе (развитие ИИ на фоне COVID-19) к группе пациентов с COVID-19 был равен 9,27 (95% ДИ 3,32–25,9, p < 0,001). При этом показатель отношения риска между основной группой и группой пациентов с инсультом без инфекции не имел статистической значимости. Отсюда следует, что риск летальных исходов на постгоспитальном этапе у пациентов, перенесших ИИ без COVID-19, был в 5 раз выше, чем у пациентов только с COVID-19. При этом развитие инсульта на фоне COVID-19 увеличивало риск летального исхода в 9 раз в первые 12 мес. после выписки.
Приведенные факты являются основанием для заключения о том, что развитие ИИ на фоне коронавирусной инфекции является не только отягчающим фактором течения и неблагоприятного реабилитационного прогноза заболевания, но и значимым фактором повышенного риска летального исхода (в 9 раз) в сравнении с пациентами с коронавирусной инфекцией без ИИ.
Непосредственными причинами летальных исходов у всех выписанных из стационара пациентов были различные формы патологии системы кровообращения. Среди них наиболее частыми были: острый инфаркт миокарда (ОИМ), тромбоэмболия легочной артерии (ТЭЛА), и инсульт / повторный инсульт. При этом у умерших пациентов с инсультом на фоне COVID-19 в 78% зафиксированы последствия тромбофилии и тромбоэмболии: повторное развитие инсульта (29%), ТЭЛА (21%), ОИМ (29%) (табл. 3).
Таблица 3. Причины летальных исходов во всех группах пациентов в течение 12 месяцев постгоспитального этапа, %
| Причина летального исхода | Основная группа – с ИИ на фоне COVID-19 | Группа сравнения – с COVID-19 без ИИ (n = 5) | Группа пациентов с ИИ без COVID-19 (n = 11) |
| Острый инфаркт миокарда | 29 | 20 | 27 |
| Повторный инсульт | 29 | 40 | 36 |
| Тромбоэмболия легочной артерии | 21 | – | 9 |
| Другие причины | 21 | 20 | 28 |
Примечание. ИИ – ишемический инсульт.
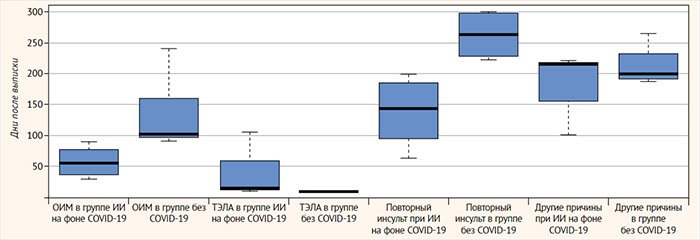
При анализе причин летальных исходов и времени их возникновения выявлены статистически значимые различия между группами неинфицированных и инфицированных SARS-CoV-2 пациентов с ИИ. Ведущими причинами фатальных исходов у пациентов основной группы (ИИ, развившийся на фоне COVID-19) в первые 3 мес. были ОИМ и повторные острые нарушения мозгового кровообращения с исходом в ИИ. При этом у неинфицированныхSARS-CoV-2 пациентов с инсультом указанные осложнения возникали статистически значимо в более поздние сроки – с 6-го по 12-й месяц постгоспитального этапа (рис. 2). Учитывая патогенетические особенности течения повреждения при ИИ на фоне коронавирусной инфекции, сочетание острого ИИ и COVID-19 сопровождалось существенными нарушениями в системе кровообращения. Указанные расстройства являлись ключевыми патогенетическими звеньями формирования полиорганной недостаточности в остром периоде госпитального этапа и развития тромботических и тромбоэмболических осложнений на постгоспитальном этапе в первые 3 мес.
Рисунок 2. Причины летальных исходов и время их возникновения при ишемическом инсульте у инфицированных SARS-CoV-2 и у неинфицированных пациентов в течение 12 месяцев после выписки из стационара
При оценке ответов пациентов на вопросы анкеты выявлено, что наиболее частыми у всех были жалобы на слабость и усталость. В большинстве случаев максимально выраженная слабость и усталость (8–10 баллов) отмечались в первые 3 мес. постгоспитального периода. В основной группе (ИИ на фоне COVID-19) это выявлено у 71% пациентов и у 55% неинфицированных с инсультом. В отличие от этого, у пациентов с коронавирусной инфекцией без инсульта жалобы на слабость и усталость наблюдались в 12% случаев. Среди наиболее частых жалоб также выделены тахикардия – у 57% пациентов, повышенная потливость – у 55%, головная боль – у 47%, одышка – у 34,5%. По частоте всех жалоб у пациентов с перенесенным инсультом на фоне COVID-19 преобладали тахикардия – в 1,2 раза и головная боль – в 1,5 чаще, чем в двух других группах (p < 0,05). Жалобы на повышенную потливость и одышку превалировали в группе пациентов, перенесших COVID-19, однако статистически значимых различий между группами не отмечено.
При оценке результатов опросов выявлено, что жалобы среди умерших пациентов на сильную усталость встречались в 5 раз чаще, чем у выживших, учащенное сердцебиение – в 1,6 раза, потливость – в 1,8 раза, одышка – в 2 раза чаще (p < 0,05). Таким образом, наиболее ранние (в первые 3 мес.) и выраженные проявления ПКС наблюдались у пациентов с инсультом на фоне COVID-19 (p < 0,001). При этом выраженные симптомы ПКС в ранний постгоспитальный период служат неблагоприятным прогностическим фактором выживаемости у таких пациентов. Это требует максимально ранней и интенсивной профилактики и коррекции у них ПКС.
При оценке показателей состояния эмоционально-волевой сферы (опрос по шкале Гамильтона) выявлено, что у всех пациентов имелись признаки депрессии различной выраженности. Среднее значение показателя шкалы Гамильтона составило: в основной группе (ИИ на фоне COVID-19) – 22 ± 5 баллов, что соответствует тяжелой степени депрессивного расстройства; в группе пациентов с коронавирусной инфекцией – 12 ± 8 баллов (легкое депрессивное расстройство); в группе неинфицированных пациентов с инсультом – 17,5 ± 7 баллов (средняя степень выраженности депрессивных расстройств). Таким образом, наиболее нестабильный эмоциональный фон и отсутствие мотиваций к выздоровлению наблюдались у пациентов с инсультом на фоне COVID-19: выраженность депрессивных расстройств у них была в 1,8 раза больше, чем у пациентов с COVID-19 (p < 0,05) и в 1,2 раза больше в сравнении с неинфицированными SARS-CoV-2 и с инсультом (p > 0,05). Кроме того, среди умерших тяжелые депрессивные расстройства встречались в 1,5 раза чаще, чем у выживших. При этом в первые 3 мес. тяжесть расстройств у них была в 2 раза больше (табл. 4).
Таблица 4. Динамика показателей тяжести и функционального исхода у пациентов с инсультом на постгоспитальном этапе в течение 12 месяцев после выписки
| Шкала | Период | Форма патологии ишемического инсульта | |
| На фоне COVID-19 (n = 21) | Без COVID-19 (n = 20) | ||
| NIHSS, Ме | Поступление | 10,5 | 10,5 |
| Выписка | 9 | 7 | |
| Через 3–6 мес. | 9 | 5 | |
| Рэнкина, Ме | Выписка | 4 | 4 |
| Через 3 мес. | 4 | 3 | |
| Через 6–12 мес. | 4 | 3 | |
| Бартел, М ± SD | Выписка | 55 ± 24 | 80 ± 14 |
| Через 3 мес. | 65 ± 15 | 85 ± 8 | |
| Через 6–12 мес. | 65 ± 10 | 85 ± 6 | |
Анализ результатов показателей функциональной активности по шкале Бартел у пациентов с инсультом в первые 3 мес. после выписки из стационара показал, что пациенты с инсультом, перенесшие COVID-19, имели по шкале Бартел более низкий балл (в 1,3 раза ниже; p < 0,001) по сравнению с группой пациентов без коронавирусной инфекции, а следовательно, худший функциональный исход и выраженную зависимость от посторонней помощи в быту. У выживших пациентов показатель функциональной активности по шкале Бартел в динамике не улучшался, в то время как в группе сравнения отмечена положительная динамика повседневной активности: на 6-м месяце Me достигала 85 ± 8 баллов.
Таким образом, пациенты с ИИ, развившимся на фоне коронавирусной инфекции, имели меньший реабилитационный потенциал и восстановительный прогноз: их функциональная активность была ниже, чем у пациентов с инсультом, не перенесших COVID-19.
В исследуемых нами группах частота летальных исходов у пациентов с высокой степенью коморбидности (63%) была в 2 раза выше, чем при средней (30%) и в 9 раз выше в сравнении с пациентами с низкой степенью (6,7%); p < 0,001. Высокая степень коморбидности была выявлена у 63% пациентов основной группы: у всех на постгоспитальном этапе зафиксированы летальные исходы, половина зафиксирована в первые 9 мес. ПКС, при этом в первые 3 мес. она была равна 18%, к концу 6-го месяца – 36%. Анализ Каплана – Майера показал, что наличие у таких пациентов ишемической болезни сердца (ИБС), перенесенного инфаркта миокарда и фибрилляции предсердий статистически значимо (p < 0,05) повышает риск смерти в ранние сроки (первые 3 мес.) постгоспитального периода.
Доказанным также является факт повышения прокоагулянтной активности крови при COVID-19 и ИИ. У пациентов всех групп при выписке из стационара был повышен уровень D-димера в периферической крови, наиболее высоким он был у пациентов с COVID-19. Его уровень у пациентов с ИИ на фоне COVID-19 превышал нормальный в 12 раз, у пациентов с COVID-19 – в 20 раз, у пациентов с инсультом – в 2,4 раза.
В группах пациентов с COVID-19 существенно увеличивалось содержание в крови цитокинов с провоспалительным действием. Так, уровень IL-6 при ИИ, развившемся на фоне COVID-19, был более чем в 50 раз выше нормального диапазона, в группе сравнения (пациенты с COVID-19) – в 77 раз; содержание IL-10 у пациентов этой группы превышало норму в 6 раз; IL-8 – в 1,3 раза, а у пациентов с COVID-19 – в 8 раз; TNF-α – в 2 и 5 раз соответственно. В группе пациентов с ИИ уровень исследуемых цитокинов был в пределах нормы (табл. 5).
Таблица 5. Содержание D-димера и цитокинов с провоспалительным эффектом в периферической крови у пациентов исследуемых групп при выписке, Me (P25–P75)
| Показатель (референтные значения) | Основная группа – с ИИ на фоне COVID-19 (n = 20) | Группа сравнения – с COVID-19 без ИИ (n = 40) | Группа пациентов с ИИ без COVID-19 (n = 20) | Значимость различий между группами (р) |
| D-димер, мг ФЭЕ/л (0,00–0,55) | 6,9 (5,7–7,4) | 10,1 (9,7–11,1)* | 1,2 (1,0–2,1) | < 0,05 |
| Фактор некроза опухоли α, пг/мл (0,0–8,2) | 18,5 (16,5–20)* | 47,5 (32–55) | 3,3 (2,8–4,2) | 0,05 |
| Интерлейкин 10, пг/мл (< 9,1) | 51 (42–65) | 483 (355–515) | 5,4 (4,3–6,6) | 0,05 |
Интерлейкин 6, пг/мл (< 7) | 371 (298–462) | 544 (442–590) | 1,6 (0,9–2,2) | < 0,05 |
Интерлейкин 8, пг/мл (< 62) | 86,8 (80–99) | 502 (415–556) | 4 (3,9–6,2) | 0,05 |
Таким образом, у пациентов с ИИ, развившимся на фоне COVID-19, на момент выписки из стационара сохранялись расстройства в системе гемостаза и выраженный дисбаланс содержания цитокинов с провоспалительным действием. Это является основой формирования у них постинфекционных нарушений на раннем постгоспитальном этапе – уже в первые 3 мес. Прогрессирующее нарастание таких расстройств в совокупности с предрасполагающими факторами (высокая коморбидность с формами патологии системы кровообращения, низкая функциональная активность) приводит к фатальным тромботическим и тромбоэмболическим осложнениям в виде острого коронарного синдрома, повторного обширного ИИ и ТЭЛА.
Обсуждение
В целом полученные нами данные свидетельствуют о том, что у пациентов, перенесших ИИ на фоне COVID-19, первые 3 мес. постгоспитального периода являются критическими в отношении развития фатальных тромботических и тромбоэмболических осложнений. Наличие в анамнезе у пациентов с инсультом артериальной гипертензии, фибрилляции предсердий, ангиопатий при сахарном диабете, ИБС, постинфарктного кардиосклероза является существенным фактором риска как инициации инсульта на фоне COVID-19, так и тяжелого течения инфекции с развитием тромбоэмболических осложнений (ОИМ, ТЭЛА, инсульта) как на госпитальном, так и на постгоспитальном этапе. Согласно результатам многочисленных исследований [2, 11–13], к ключевым патогенетическим механизмам развития полиорганных осложнений при коронавирусной инфекции относят нарушения системы гемостаза с увеличением свертывающей способности крови. При сочетании COVID-19 и инсульта риск указанных осложнений у пациента значительно повышается как в остром, так и восстановительном периоде, что подтверждает наши наблюдения.
По данным профильных стационаров по лечению COVID-19 частота острого инсульта, развивающегося на фоне коронавирусной инфекции, составляет 8–12%, более 1/3 которых заканчиваются фатально [2, 3, 10]. Согласно статистическим данным, смертность при сочетании этих двух форм патологии в 3 раза выше, чем у пациентов только с инсультом до пандемии [5, 14, 15], что соответствует данным наших наблюдений.
При проведении реабилитационных программ у пациентов с постинсультными парезами, развившимися на фоне или после коронавирусной инфекции, отмечается более медленная динамика восстановления двигательной функции по сравнению с пациентами, неинфицированными SARS-CoV-2 [5, 6, 9]. По литературным данным [12, 13, 16] у 45–50% пациентов с COVID-19 выявляется мультиморбидность, частота которой увеличивается до 75% случаев при его тяжелых формах. Доказанной является значимая роль заболеваний системы кровообращения как одного из основных факторов риска тяжелого течения новой коронавирусной инфекции с развитием летальных исходов как на госпитальном, так и на постгоспиталльном этапе [12–14]. В нашем исследовании у всех пациентов с инсультом на фоне COVID-19 и коморбидностью с заболеваниями системы кровообращения на постгоспитальном этапе зафиксирована высокая смертность. При этом инсульт при коронавирусной инфекции является не только самостоятельным фактором неблагоприятного исхода, но и триггером процесса декомпенсации сопутствующих форм патологии системы кровообращения.
Также доказанным является факт повышения прокоагулянтной активности крови при COVID-19, в котором принимают участие множество факторов. Наиболее значимыми из них являются гиперпродукция провоспалительных цитокинов, повышение содержания фактора Виллебранда и уровня D-димера [17]. В ходе проведенного нами клинико-лабораторного мониторинга у пациентов с COVID-19 выявлено повышение показателей прокоагулянтной активности крови (D-димера, фактора фон Виллебранда) и гиперпродукция цитокинов с провоспалительным действием (IL-6, IL-10, TNF-α) на момент выписки из специализированного по ковиду стационара. Это свидетельствует о сохраняющихся расстройствах в системах гемостаза и провоспалительных цитокинов. Прогрессирование указанных расстройств является базой формирования тромботических и тромбоэмболических осложнений в виде острого коронарного синдрома, повторного обширного ИИ, ТЭЛА. Показано, что степень повышения концентрации D-димера в крови является маркером общего состояния пациентов, перенесших COVID-19. Согласно результатам исследований С. Huang et al., выявлена зависимость между концентрацией D-димера у пациентов с COVID-19 при поступлении и тяжестью состояния, а также с необходимостью лечения в условиях отделения интенсивной терапии [18]. В работе N. Tang et al. приведены статистические данные, указывающие на то, что изменение концентрации D-димера в крови служит предиктором летального исхода у пациентов с COVID-19 [19]. Отмечено также, что ПКС в восстановительном периоде ИИ, развившегося на фоне коронавирусной инфекции, протекает в более тяжелых формах [6, 7, 20]. При этом отмечается закономерное потенцирование декомпенсации функции органов, тканей и их систем при сопутствующих формах патологии с развитием острых расстройств кровообращения, в том числе в мозге и сердце. Подобные проявления ПКС обусловлены сочетанным действием патогенных факторов повреждения мозга в результате как его ишемии, так и развития SARS-CoV-2 [7, 8]. Согласно литературным данным [7, 8, 21] различные клинические проявления ПКС наблюдаются преимущественно в период от 3 мес. до 1 года после дебюта инфекции. Так, в нашем исследовании ранними проявлениями ПКС в первые 3 мес. были тромботические и тромбоэмболические осложнения.
Роль патогенных изменений в системах гемостаза и иммунобиологического надзора организма в патогенезе COVID-19 подтверждена результатами исследования других авторов [22, 23]. Выраженность изменений лабораторных показателей на момент выписки преобладает у пациентов с инсультом на фоне COVID-19. Важно, что пациенты с наличием более 2–3 заболеваний системы кровообращения (системным атеросклерозом, длительной артериальной гипертензией, декомпенсированным сахарным диабетом 2-го типа, ИБС), развившихся до эпизодов инсульта и COVID-19, уже имеют признаки тяжелых форм эндотелиальной дисфункции и нарушений в системе гемостаза с доминированием протромботического потенциала при формировании хронического синдрома диссеминированного внутрисосудистого свертывания крови [12, 13]. Следовательно, эти пациенты имеют существенные предпосылки как развития церебральных расстройств с низким реабилитационным потенциалом, так и тяжелого течения коронавирусной инфекции с развитием тяжелых форм ПКС.
В целом выявление закономерностей и особенностей течения, а также проявлений раннего и позднего этапов восстановительного периода у пациентов после ИИ, развившегося на фоне COVID-19, является актуальным направлением исследований, результаты которых послужат основой разработки эффективных алгоритмов снижения у них риска неблагоприятных исходов на постгоспитальном этапе.
У пациентов, перенесших ИИ на фоне COVID-19, закономерно развиваются ранние выраженные проявления ПКС. Таких пациентов в первые 3 мес. постгоспитального периода следует относить к группе повышенного риска развития тромбоэмболических осложнений и летального исхода. Уже в этот период у них регистрируются фатальные проявления тромбофилии и тромбоэмболии: ОИМ, повторные обширные ИИ, ТЭЛА. Следовательно, пациенты с сочетанием острого инсульта и COVID-19 требуют особого внимания врачей амбулаторного звена в первые 3 мес. после выписки из стационара.
Высокая коморбидность ИИ с формами патологии системы кровообращения является значимым фактором риска раннего (уже в первые 3–6 мес.) развития неблагоприятных исходов на постгоспитальном этапе, особенно у пациентов с ИИ, развившемся на фоне COVID-19. Частота летальных исходов при наличии высокой степени коморбидности в указанные сроки в 2 раза выше, чем при средней и в 9 раз выше, чем при низкой степени. При этом наличие у пациентов ИБС, перенесенного ранее инфаркта миокарда и фибрилляции предсердий повышают риск летальных исходов именно в ранние сроки (первые 3 мес.) постгоспитального периода. Риск смерти пациентов с ИИ на фоне COVID-19 в первые 12 мес. после выписки из специализированного стационара в 9 раз выше, чем у неинфицированных пациентов с инсультом, а также пациентов, перенесших COVID-19 без инсульта.
Для пациентов с инсультом на фоне COVID-19 характерен более низкий реабилитационный потенциал и функциональный исход, а также обусловленная этим длительная неспособность к самообслуживанию и более выраженные расстройства эмоционального фона (состояние депрессии). Именно у таких пациентов наблюдается наиболее высокая частота летальных исходов.
Заключение
Таким образом, пациенты с ИИ, развившимся на фоне COVID-19, требуют разработки специализированных алгоритмов восстановительного лечения как в остром периоде инсульта, так и на постгоспитальном этапе, особенно в первые 6 мес. Такой алгоритм должен включать методы коррекции психоэмоционального состояния пациентов и повышения у них мотивации к выздоровлению.
Список литературы / References
- Lu R., Zhao X., Li J., Niu P., Yang B., Wu H. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020;395(10224):565-574. https://doi.org/10.1016/s0140-6736(20)30251-8.
- Mao L., Jin H., Wang M., Hu Y., Chen S., He Q. et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020;77(6):683-690. https://doi.org/10.1001/jamaneurol.2020.1127.
- Romero-Sánchez C.M., Díaz-Maroto I., Fernández-Díaz E., Sánchez-Larsen Á., Layos-Romero A., García-García J. et al. Neurologic manifestations in hospitalized patients with COVID-19: The ALBACOVID registry. Neurology. 2020;95(8):e1060-e1070. https://doi.org/10.1212/WNL.0000000000009937.
- Trejo-Gabriel-Galán J.M. Stroke as a complication and prognostic factor of COVID-19. Neurologia (Engl Ed). 2020;35(5):318-322. https://doi.org/10.1016/j.nrl.2020.04.015.
- Carod-Artal F.J. Neurological complications of coronavirus and COVID-19. Rev Neurol. 2020;70(9):311-322. https://doi.org/10.33588/rn.7009.2020179.
- Jimeno-Almazán A., Pallarés J.G., Buendía-Romero Á., Martínez-Cava A., Franco-López F., Sánchez-Alcaraz Martínez B.J. et al. Post-COVID-19 Syndrome and the Potential Benefits of Exercise. Int J Environ Res Public Health. 2021;18(10):5329. https://doi.org/10.3390/ijerph18105329.
- Camargo-Martínez W., Lozada-Martínez I., Escobar-Collazos A., NavarroCoronado A., Moscote-Salazar L., Pacheco-Hernández A. et al. Post-COVID 19 neurological syndrome: Implications for sequelae’s treatment. J Clin Neurosci. 2021;88:219-225. https://doi.org/10.1016/j.jocn.2021.04.001.
- Yong S.J. Long COVID or post-COVID-19 syndrome: putative pathophysiology, risk factors, and treatments. Infect Dis (Lond). 2021;53(10):737-754. https://doi.org/10.1080/23744235.2021.1924397.
- Ortelli P., Ferrazzoli D., Sebastianelli L., Engl M., Romanello R., Nardone R. et al. Neuropsychological and neurophysiological correlates of fatigue in post-acute patients with neurological manifestations of COVID-19: Insights into a challenging symptom. J Neurol Sci. 2021;420:117271. https://doi.org/10.1016/j.jns.2020.117271.
- Sagris D., Papanikolaou A., Kvernland A., Korompoki E., Frontera J.A., Troxel A.B. et al. COVID-19 and ischemic stroke. Eur J Neurol. 2021;28(11):3826-3836. https://doi.org/10.1111/ene.15008.
- Qin W., Zhang X., Yang S., Li Y., Yuan J., Yang L. et al. Risk Factors for Multiple Organ Dysfunction Syndrome in Severe Stroke Patients. PLoS ONE. 2016;11(11):e0167189. https://doi.org/10.1371/journal.pone.0167189.
- Azevedo R.B., Botelho B.G., Hollanda J.V.G., Ferreira L.V.L., Junqueira de Andrade L.Z., Oei S.S.M.L. et al. COVID-19 and the cardiovascular system: a comprehensive review. J Hum Hypertens. 2021;35(1):4-11. https://doi.org/10.1038/s41371-020-0387-4.
- Clerkin K.J., Fried J.A., Raikhelkar J., Sayer G., Griffin J.M., Masoumi A. et al. COVID-19 and Cardiovascular Disease. Circulation. 2020;141(20):1648-1655. https://doi.org/10.1161/CIRCULATIONAHA.120.046941.
- Парфенов В.А., Кулеш А.А. Острые и отдаленные неврологические нарушения у пациентов, перенесших коронавирусную инфекцию. Неврология, нейропсихиатрия, психосоматика. 2022;14(3):4-11. https://doi.org/10.14412/2074-2711-2022-3-4-11.
- Harrison S.L., Fazio-Eynullayeva E., Lane D.A., Underhill P., Lip G.Y.H. Higher Mortality of Ischaemic Stroke Patients Hospitalized with COVID-19 Compared to Historical Controls. Cerebrovasc Dis. 2021;50(3):326-331. https://doi.org/10.1159/000514137.
- Asadi-Pooya A.A., Simani L. Central nervous system manifestations of COVID-19: A systematic review. J Neurol Sci. 2020;413:116832. https://doi.org/10.1016/j.jns.2020.116832.
- Ahmed S., Zimba O., Gasparyan A.Y. Thrombosis in Coronavirus disease 2019 (COVID-19) through the prism of Virchow’s triad. Clin Rheumatol. 2020;39(9):2529-2543. https://doi.org/10.1007/s10067-020-05275-1.
- Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. https://doi.org/10.1016/S0140-6736(20)30183-5.
- Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844-847. https://doi.org/10.1111/jth.14768.
- Akhtar N., Abid F., Singh R., Kamran S., Imam Y., Al-Jerdi S. et al. Ischemic stroke in patients that recover from COVID-19: Comparisons to historical stroke prior to COVID-19 or stroke in patients with active COVID-19 infection. PLoS ONE. 2022;17(6):e0270413. https://doi.org/10.1371/journal.pone.0270413.
- Asirvatham T., Abubacker M., Isaac Chandran P., Boppana A., Salim Al Abdulla S., Mohammed Saad R. Post-COVID-19 Stroke Rehabilitation in Qatar: A Retrospective, Observational Pilot Study. Qatar Med J. 2022;2022(1):10. https://doi.org/10.5339/qmj.2022.10.
- Luo X.H., Zhu Y., Mao J., Du R.C. T cell immunobiology and cytokine storm of COVID-19. Scand J Immunol. 2021;93(3):e12989. https://doi.org/10.1111/sji.12989.
- Quirch M., Lee J., Rehman S. Hazards of the Cytokine Storm and Cytokine-Targeted Therapy in Patients With COVID-19: Review. J Med Internet Res. 2020;22(8):e20193. https://doi.org/10.2196/20193.