Журнал "Медицинский совет" №1/2022
DOI: 10.21518/2079-701X-2022-16-1-134-141
О.В. Борисова1,Г.А. Маковецкая1, Л.И. Мазур1, Н.М. Бочкарева1, В.Н. Баринов2, О.Н. Яшкина1, С.А. Колесников1, С.Н. Решетова1
1 Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89
2 Самарская областная клиническая больница имени В.Д. Середавина; 443095, Россия, Самара, ул. Ташкентская, д. 159
Введение. В настоящее время во всем мире продолжается пандемия коронавирусной инфекции, вызванная вирусом SARS-CoV-2. Данные исследований отечественных и зарубежных авторов свидетельствуют, что почки являются таргетным органом для новой инфекции, поражения которых варьируются от протеинурии и гематурии до острого повреждения почек.
Цель исследования – определить частоту и характер поражения почек у детей с подтвержденной коронавирусной инфекцией.
Материалы и методы. Проведен ретроспективный и проспективный анализ случаев подтвержденной инфекции COVID-19 у детей (n = 441), госпитализированных в Самарскую областную детскую инфекционную больницу с марта 2020 г. по июль 2021 г. У всех пациентов обнаружена РНК SARS-CoV-2 методом одностадийной реакции обратной транскриптации, совмещенной с полимеразной цепной реакцией. Изучены изменения со стороны почек, возникшие у 57 детей. Результаты исследования обработаны с применением программы Statistica 7.0 (StatSoft, США).
Результаты. Вовлечение почек в инфекционный процесс выявлено у каждого 8-го ребенка с COVID-19 (12,9%) чаще в виде изолированного мочевого синдрома, частота выявления которого коррелировала с тяжестью течения коронавирусной инфекции: при тяжелом течении протеинурия определена у 31,6% пациентов, гематурия – у 21%, острое повреждение почек – у 10,5%, диабетическая нефропатия – у 5,3%. Повреждение почек сочеталось с поражением респираторного и желудочно-кишечного трактов, характеризовалось быстрым восстановлением диуреза и показателей азотемии без проведения специальной почечной терапии. Описан клинический случай дебюта нефротического синдрома, развившегося через 2 нед. после перенесенной коронавирусной инфекции.
Выводы. Дети с COVID-19 требуют проведения мониторинга функции почек для раннего выявления нарушений и их коррекции при необходимости. Пациенты с изолированным мочевым синдромом в острый период нуждаются в длительном наблюдении с целью выявления скрытой почечной патологии.
Для цитирования: Борисова О.В., Маковецкая Г.А., Мазур Л.И., Бочкарева Н.М., Баринов В.Н., Яшкина О.Н., Колесников С.А., Решетова С.Н. Пандемия COVID-19 и поражение почек у детей: обзор литературы и собственные региональные наблюдения. Медицинский Совет. 2022;(1):134-141. https://doi.org/10.21518/2079-701X-2022-16-1-134-141
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
COVID-19 pandemic and kidney disease in children: literature review and own regional observations
Olga V. Borisova1, Galina A. Makovetskaya1, Liliya I. Mazur1, Natalia M. Bochkareva1, Victor N. Barinov2, Olga N. Yashkina1, Sergey A. Kolesnikov1, Svetlana N. Reshetova1
1 Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia
2 Seredavin Samara Regional Clinical Hospital; 159, Tashkentskaya St., Samara, 443095, Russia
Introduction. Currently, the coronavirus infection pandemic caused by the SARS-CoV-2 virus continues around the world. Research data from domestic and foreign authors indicate that the kidneys are a target organ for a new infection, lesions vary from proteinuria and hematuria to acute kidney injury. Aim of the study – to determine the frequency and nature of kidney damage in children with confirmed coronavirus infection.
Materials and methods. A retrospective and prospective analysis of cases of confirmed COVID-19 infection in children (n = 441) admitted to the Samara Regional Children’s Infectious Diseases Hospital from March 2020 to July 2021 was carried out. SARSCoV-2 RNA was detected in all patients by a one-step reverse transcription reaction combined with a polymerase chain reaction. The changes in the kidneys that occurred in 57 children were studied. The research results were processed using the Statistica 7.0 software (StatSoft, USA).
Results. The involvement of the kidneys in the infectious process was detected in every 8 children with COVID-19 (12.9%), more often in the form of isolated urinary syndrome, the detection rate of which correlated with the severity of the course of coronavirus infection: in severe cases, proteinuria was detected in 31.6% of patients, hematuria – in 21%, acute kidney injury – in 10.5%, diabetic nephropathy – in 5.3%. Kidney damage was combined with damage to the respiratory and gastrointestinal tract, characterized by rapid recovery of urine output and azotemia parameters without special renal therapy. A clinical case of the onset of nephrotic syndrome that developed 2 weeks after suffering a coronavirus infection is described.
Conclusions. Children with COVID-19 require kidney function monitoring for early detection and correction in case of impairment. Patients with isolated urinary syndrome in the acute period require long-term observation in order to detect latent renal pathology
For citation: Borisova O.V., Makovetskaya G.A., Mazur L.I., Bochkareva N.M., Barinov V.N., Yashkina O.N., Kolesnikov S.A., Reshetova S.N. COVID-19 pandemic and kidney disease in children: literature review and own regional observations. Meditsinskiy sovet = Medical Council. 2022;(1):134-141. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-1-134-141
Conflict of interest: the authors declare no conflict of interest.
Введение
Пандемия новой коронавирусной инфекции, начавшаяся в декабре 2019 г., определяется сегодня как одна из самых тяжелых пандемических болезней, которая коснулась всех поколений взрослых и детей [1–3]. Z.N. Hatmi на основании систематического обзора, проведенного в 2021 г., считает, что вирус SARS-Cov-2 способствует поражению многих органов у взрослых и детей: кровеносных сосудов, легких, сердца, почек, печени, глаз [1].
Обзор литературы
Поражения почек при COVID-19 нередко встречаются у взрослых пациентов и варьируются от протеинурии и гематурии до острого повреждения почек (ОПП). Первые исследования в этом направлении, проведенные в Китае, показали частоту выявления ОПП у взрослых пациентов до 29% [4–7]. По данным I. Cheruiyot et al., полученным в результате проведения исследования в 2020 г., ОПП связано с худшим прогнозом [8]. Е.С. Столяревич и др. в 2020 г. провели клинические и морфологические сопоставления проявления почечной патологии у 220 взрослых пациентов, умерших от COVID-19 [9]. Морфологическим субстратом ОПП в большинстве случаев было острое повреждение канальцевого эпителия, венозное полнокровие органа (более чем у половины больных), а также наличие тромботических микроангиопатий. Многими авторами подчеркивается, что инфекция COVID-19 может усложнить лечение, уход и повысить смертность у людей с основным заболеванием почек [6, 7].
Мало что известно о распространенности и патогенезе ОПП у детей, заболевших коронавирусной инфекцией [10]. Свой взгляд на особенности ОПП и на проведение заместительной почечной терапии (ЗПТ) у детей c COVID-19 высказали специалисты секции нефрологии и интенсивной терапии Европейского общества педиатрической и неонатальной интенсивной терапии [11]. Обезвоживание, вероятно, является первым пусковым механизмом, и поэтому следует уделять внимание жидкостному режиму. ЗПТ становится основным методом, в т. ч. у детей, у которых применяется и перитонеальный диализ с жестким контролем жидкостных и метаболических нарушений. A. Basaalely et al. в работе, проведенной в 2021 г., сообщают о результатах проспективного исследования проживающих в эпицентре вспышки COVID-19 детей, которые поступали на лечение в 4 Нью-Йоркских госпиталя в течение 5 месяцев 2020 г. (март–август) [12]. Контингент детей был разнообразен по расе, этнической принадлежности и социально-экономическим условиям. В исследование были включены 152 пациента с острым COVID-19 и 55 детей с ассоциированным с коронавирусной инфекцией системным мультивоспалительным синдромом. ОПП в когорте развилась у 11,8%, в т. ч. у 8 детей (8,2%) с острым COVID-19 и у 10 детей (18,2%) из 2-й группы. В полученной математической модели повреждение почек было ассоциировано с низким альбумином в сыворотке крови, лейкоцитозом, а также низким уровнем кальция, приводящем к вторичному снижению проницаемости клеток. Более низкий уровень альбумина в сыворотке может сыграть роль в пуске воспалительного каскада [12].
У пациентов с мультивоспалительным синдромом и ОПП отмечен высокий уровень систолической дисфункции. Снижение внутрисосудистого объема и последующий кардиогенный шок тоже могут способствовать развитию ОПП. Дети с ОПП имели более длительную госпитализацию (в среднем на 8,4 дня) [12].
J.A. Kari et al. представляют многоцентровое ретроспективное исследование, осуществленное в 2021 г., в которое были включены дети с подтвержденной инфекцией COVID-19. Диагноз ОПП был выставлен пациентам в соответствии с критериями KDIGO. Из 89 включенных детей у 19 (21%) развилось ОПП, при этом 1-я стадия – у 52,6%. Мультивоспалительный синдром был отмечен чаще у детей с ОПП, по сравнению с детьми с нормальной функцией почек (15% против 1,5%). ОПП не потребовало ЗПТ, однако остаточная почечная недостаточность наблюдалась при выписке у 9% пациентов. На это повлияли сопутствующие заболевания: артериальная гипертензия, гипоксия, сердечная недостаточность [13].
По данным ретроспективного обсервационного исследования 238 детей с коронавирусной инфекцией, частота ОПП составила 1,8% [14]. Исследование проводилось в детской больнице Ухани на ранних стадиях пандемии с 24 января по 20 марта 2020 г. Из всех случаев COVID-19 только трое детей были с ОПП и нуждались в лечении в условиях отделения интенсивной терапии. У двух пациентов была продрома в виде желудочно-кишечных симптомов. У всех больных с ОПП отмечено увеличение ИЛ-16 и активация комплемента. Все трое прошли курс плазмафереза и непрерывную ЗПТ. Исходы заболевания были следующими: один ребенок полностью выздоровел, у одного пациента отмечены остаточные нарушения функции почек и одного ребенка спасти не удалось из-за критического состояния [14].
Частота ОПП у детей при коронавирусной инфекции различна в разных странах. Согласно данным исследователей в Великобритании, ОПП у детей с COVID-19 развилось в 21%, в Саудовской Аравии – в 29% случаев [13, 15]. В предварительном отчете многоцентрового исследования по оценке ОПП у 106 детей с коронавирусной инфекцией, пролеченных в 32 американских центрах, частота ОПП составила 44% [16]. Таким образом, в педиатрических исследованиях новой коронавирусной инфекции частоту ОПП оценивают от 1,3% до 44,0%.
Патогенез заболеваний почек у детей представлен A.C.S. Silva et al. в исследовании, проведенном в 2020 г., как взаимодействие SARS-Cov-2 с ренин-ангиотензин-альдостероновой системой (РААС). В обзоре характеризуется роль РААС при заболеваниях почек, включая артериальную гипертонию, гломерулярные болезни, СAKUT-синдром, хроническую болезнь почек (ХБП) и др. [17]. Уже доказано, что почки являются органами с высокой уязвимостью при коронавирусной инфекции: вирус SARS-Cov-2 проникает в клетки организма-хозяина, используя ангиотензинпревращающий фермент 2 (АСЕ2) [18]. Вирус заражает хозяина, связываясь с рецепторами АСЕ2 из-за наличия данных рецепторов в почках и пищеварительном тракте. В результате могут произойти одновременно острые состояния в почках и проблемы пищеварения. Происходит нарушение водно-электролитного баланса, особенно у детей, что надо учитывать в контроле терапии пациента [19]. Вирус SARS-Cov-2 может оказывать прямое цитопатическое действие на почки [20]. Это доказано обнаружением фрагментов коронавируса методом ПЦР в моче пациентов с COVID-19 [21].
По данным J.B. Cohen et al., представленным в работе, опубликованной в 2021 г., в первые месяцы пандемии COVID-19 возникла гипотеза о том, что фармакологические ингибиторы РААС могут увеличить тяжесть инфекции [22]. Однако контраргументы указали на доказательство потенциально защитных эффектов блокады АСЕ2 в отношении острого повреждения легких, а также на значительные риски от прекращения приема этих широко используемых лекарств при данном заболевании. Согласно результатам работы D.L. Edmonston et al., проведенной в 2020 г., гипертония является фактором риска для людей, больных COVID-19 [23]. Рассматривая внереспираторные проявления коронавирусной инфекции, C.C. Lai et al. в исследовании, осуществленном в 2020 г., представили диапазон клинических симптомов для проведения дифференциальной диагностики и прогноза. Такие осложнения как ОПП, а также поражение сердца, нарушения свертывания крови и тромботические осложнения связаны с плохим прогнозом [24].
Современное лечение COVID-19 при наличии ОПП включает общее и поддерживающее лечение, а также проведение ЗПТ. В настоящее время не существует эффективной противовирусной терапии. Пациенты с подтвержденной инфекцией COVID-19 должны соблюдать постельный режим, им необходимо обеспечить нутритивную поддержку, сохранение адекватного водного статуса, артериального давления и оксигенации. Другие меры включают профилактику и лечение осложнений путем обеспечения органной поддержки, сохранения гемодинамической стабильности и предотвращения вторичной инфекции.
Инфекция COVID-19 влечет за собой особые проблемы для диализных пациентов. Пациенты с уремией особенно уязвимы. Китайское и Тайваньское общество нефрологов, Международная ассоциация нефрологов (ISN) разработали рекомендации для диализных отделений во время вспышки COVID-19 [25]. Консенсусные рекомендации по уходу за детьми, получающими хронический диализ в связи с пандемией коронавирусной инфекции, представили Q. Shen et al. в проведенном в 2020 г. исследовании [26]. Авторы отмечают, что дети с ХБП 5-й стадии особо подвержены опасности заражения COVID-19. Был предложен набор рекомендаций по профилактике и контролю тяжелого респираторного синдрома при коронавирусной инфекции в центрах педиатрического гемодиализа и в условиях домашнего гемодиализа, которые основаны на эпидемиологических особенностях вируса, факторах восприимчивости, а также стратегиях профилактики и контроля [27].
В литературе имеются единичные публикации о связи между новой инфекцией и нефротическим синдромом (НС) у детей. Так, описан рецидив НС у мальчика 3-х лет с COVID-19 [28]. Лечение преднизолоном в дозировке 2 мг/кг вызвало полную клинико-лабораторную ремиссию, однако при снижении дозы препарата развился тяжелый респираторный синдром, снова появились периорбитальные отеки, протеинурия. Доза преднизолона была увеличена до 2 мг/кг в сутки, что способствовало ремиссии НС. Другими авторами описан дебют НС у 15-летнего мальчика, у которого был позитивный тест на COVID-19 [29]. И.М. Каганцов и др. в научной работе, опубликованной в 2021 г., представили описание клинического наблюдения инфаркта почки у девочки 17 лет с тяжелым течением новой коронавирусной инфекции [30].
Опираясь на данные вышеупомянутых исследователей, мы оценили частоту и характер поражения почек у детей Самарского региона с подтвержденной инфекцией COVID-19 (U 07.1).
Цель исследования – определить частоту и характер поражения почек у детей с подтвержденной коронавирусной инфекцией
Материалы и методы
Нами проведено ретроспективное и проспективное исследование с марта 2020 г. по июль 2021 г. (17 мес.). С начала пандемии в ГБУЗ «Самарская областная детская инфекционная больница» был госпитализирован 441 ребенок в возрасте от 3 нед. до 18 лет включительно, средний возраст детей составил 8,2 [5,7; 13,5] лет. Среди обследованных пациентов было 218 мальчиков (49,4%) и 223 девочки (50,6%).
Всем детям проводили общеклинические анализы крови и мочи (автоанализатор MidrayBC-3600), биохимический анализ крови (автоанализатор Olimpus AU680). По показаниям исследовали коагулограмму, измеряли суточную протеинурию, рассчитывали скорость клубочковой фильтрации (СКФ) по методу Schwartz с учетом возраста:
– у детей до 2 лет: СКФ = 40 × длина тела (см)/креатинин плазмы (мкмоль/л);
– у пациентов старше 2 лет: СКФ = к × длина тела (см) × 80/креатинин плазмы (мкмоль/л), где к = 0,55 (у детей от 2 до 12 лет), к = 0,55 (для девушек от 13 до 18 лет), к = 0,77 (для юношей от 13 до 18 лет).
У всех детей в мазках из рото- и носоглотки определяли РНК SARS-CoV-2 методом одностадийной реакции обратной транскриптации, совмещенной с полимеразной цепной реакцией (ПЦР) в режиме реального времени, с помощью набора реагентов «ПЦР-РВ-2019-nCoV».
Из инструментальных методов по показаниям применяли ультразвуковое исследование грудной и брюшной полости (аппарат «SonoScape»), компьютерную томографию (КТ) легких (аппарат «Siemens Definition AS 128»).
Статистическую обработку числового материала проводили с использованием статистического пакета Statistica 7.0 (StatSoft, США). Для оценки различий показателей применяли критерий χ2 Пирсона. Результаты считали статистически значимыми при р < 0,05.
Результаты и обсуждение
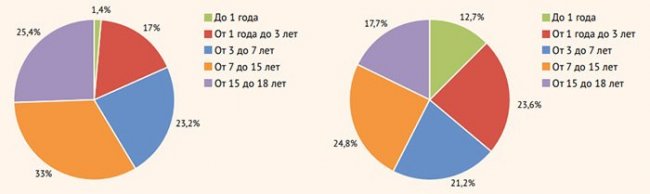
Распределение пациентов по возрасту за все время наблюдения представлено на рис. 1.
Рисунок 1. Распределение детей с COVID-19 по возрасту
В 2020 г. в стационаре было пролечено 276 детей с коронавирусной инфекцией, в 2021 г. (до 31.07.2021 г.) – 165 пациентов. Возрастное распределение по годам (2020 г., 2021 г.) указано на рис. 2.
Рисунок 2. Распределение пациентов по возрасту в 2020 и в 2021 гг.
Согласно полученным данным, в 2021 г. чаще были госпитализированы дети до года – 12,7% (в 9 раз чаще по сравнению с предыдущим годом) и пациенты от 1 года до 3 лет – 23,6% (в 1,4 раза чаще).
Спектр клинических проявлений COVID-19 варьировался от случаев с легким течением до тяжелых вариантов. У большинства детей (278 человек, 63,0%) заболевание протекало в легкой форме, в 144 случаях (32,7%) – в среднетяжелой. У 19 детей (4,3%) по данным КТ отмечено тяжелое течение инфекции со значительным объемом поражения легких (50–75%). Крайне тяжелых форм и летальных исходов не было. Мы также сравнили тяжесть течения COVID-19 у госпитализированных пациентов в 2020 г. и в 2021 г. В 2020 г. в детском инфекционном стационаре дети с тяжелой формой коронавирусной инфекции составляли 2,5%, тогда как за 7 мес. 2021 г. – 7,3%.
Наиболее частыми симптомами заболевания у детей было повышение температуры (100%), непродуктивных кашель (63,9%), боль в горле (60%), заложенность носа (24%), признаки интоксикации (слабость, тошнота, миалгии) (27,9%), симптомы поражения желудочно-кишечного тракта (5,9%).
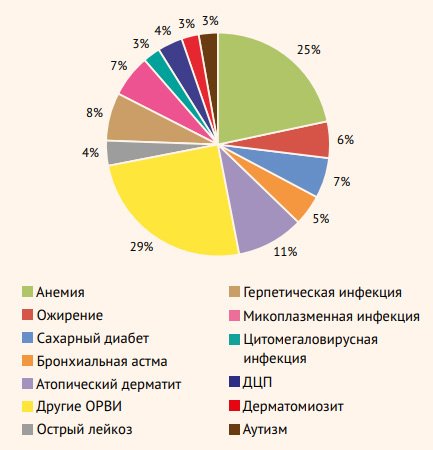
Среди сопутствующих заболеваний у госпитализированных пациентов почечная патология не выявлена (рис. 3). У 7 детей (1,6%) был сахарный диабет, у 3 пациентов периодически выявлялась микроальбуминурия (стадия начинающейся диабетической нефропатии) без нарушения функционального состояния почек.
Рисунок 3. Сопутствующие заболевания у детей с коронавирусной инфекцией (в абс.)
Изменения со стороны почек у детей, госпитализированных с коронавирусной инфекцией, определены в 57 случаях (12,9%). Выявлены следующие поражения: недифференцированный мочевой синдром (n = 55) – 96,5%, ОПП (n = 2) – 3,5%.
Наиболее частым вариантом поражения почек при COVID-19 у детей был недифференцированный мочевой синдром. Под мочевым синдромом мы понимали изменения в анализах мочи, проявляющиеся протеинурией, гематурией, лейкоцитурией, цилиндрурией, изменениями солевого состава мочевого осадка, учитывали нарушения в мочеотделении (изменения количества мочи, частоты и ритма мочеиспускания) [31]. При этом чаще отмечен транзиторный тип нарушений: 1–2-х кратные изменения в анализах мочи с последующей нормализацией, реже – персистирующие изменения, которые появлялись вновь. При этом клиника ренальных и экстраренальных нарушений не была выявлена.
Ведущее место занимала протеинурия, которую мы оценили как преренальную, заболевание диагностировано у 36 детей (8,2%). Протеинурия расценивалась как минимальная (до 1 г/л/сут) и носила у большинства пациентов транзиторный характер на фоне лихорадки выше 38оС (вследствие усиления катаболических процессов). Средний уровень протеинурии составил 0,325 [0,130; 0,550] г/л/сут.
У 2 детей старше 15 лет с сопутствующим сахарным диабетом выявлена умеренная протеинурия (до 3 г/л/сут) как проявление диабетической нефропатии. У одного ребенка с сахарным диабетом коронавирусная инфекция была тяжелой формы, диабетическая нефропатия сопровождалась артериальной гипертензией и снижением СКФ до 62 мл/мин/1,73 м2.
По данным ряда авторов протеинурия может возникнуть вследствие прямого повреждения подоцитов в результате экспрессии АСЕ2 [20, 32]. Протеинурия, по нашим данным, коррелировала с тяжестью коронавирусной инфекции, при среднетяжелом течении встречалась в 7,5 раза чаще, а при тяжелом – в 14 раз чаще, по сравнению с легким вариантом (р < 0,01).
Реже была отмечена гематурия – у 16 детей (3,6%), которая чаще сочеталась с протеинурией – 11 пациентов (2,5%). Согласно исследованиям, проведенным на взрослых пациентах M.A. Martinez-Rojas et al. в 2020 г., наличие гематурии выявлено у 20% больных, инфицированных COVID19. Авторы расценивают данный симптом как следствие эндотелиита, приводящего к коагулопатии и связывают гематурию с тяжелым течением коронавирусной инфекции [20, 33]. В нашем исследовании мы также отметили связь возникновения гематурии с тяжестью заболевания. При тяжелом варианте COVID-19 гематурия возникала у 21% пациентов (р < 0,01).
У 12 детей (2,7%) выявлена лейкоцитурия. У 10 пациентов абактериальная лейкоцитурия сочеталась с низкой гематурией, минимальной протеинурией и кристаллурией, что было определено как дизметаболические нарушения. Чаще это были пациенты с легким течением болезни.
У всех 55 детей изменения в анализах мочи были кратковременными, быстро нормализовались и отсутствовали при выписке из стационара.
ОПП 1-й стадии выявлено у 2 детей с тяжелым течением COVID-19 (0,45% среди всех пациентов, 10,5% среди тяжелых больных). Критерии ОПП определялись в соответствии с рекомендациями KDIGO, 2012 г.: 1 стадия – увеличение уровня сывороточного креатинина ≥0,3 мл/дл (26,4 мкмоль/л) в течение 48 часов, снижение объема мочи <0,5 мл/кг/час в течение более 6 ч. У обоих пациентов отмечена азотемия, умеренное снижение скорости клубочковой фильтрации (СКФ) – до 72 и 57 мл/мин/1,73 м2. Однако быстро восстановился диурез и показатели азотемии без проведения специальной почечной терапии. Ряд авторов считают, что появление клиники ОПП при COVID-19 коррелирует с плохим прогнозом выживаемости взрослых пациентов [34]. Другие исследователи считают временное нарушение функции почек вторичной травмой, возникающей на фоне гипоксии при коронавирусной инфекции [35].
Клинический случай 1
Мальчик, 2 года, был доставлен в инфекционный стационар с жалобами на повышение температуры до 39 ºС, кашель, насморк, двукратную рвоту, головную боль. Ребенок был госпитализирован из очага COVID-19 в семье. Мальчик от 4-й беременности, протекавшей на фоне угрозы прерывания, кольпита, от первых преждевременных родов, массой 2350 г и ростом 48 см. Со слов матери часто болел ОРВИ. При поступлении его состояние было расценено как тяжелое, отмечена бледность кожных покровов, небольшая пастозность век, гиперемия слизистых ротоглотки, ЧД – 36–44 в мин, ЧСС – 128–132 в мин, АД – 100 и 70 мм рт. ст. КТ грудной клетки выявила многочисленные участки понижения пневматизации легочной ткани по типу «матового стекла», объем поражения составил 60–65%. Мазок из носо- и ротоглотки на РНК вируса SARS-CoV-2 методом ПЦР был положительным.
На вторые сутки госпитализации появился частый жидкий стул, многократная рвота. За сутки получено 250 мл мочи. На 3-й день в общем анализе мочи определена значительная протеинурия – 5,5 г/л, большое количество лейкоцитов, эритроцитов, гиалиновые и зернистые цилиндры. В общем анализе крови выявлен лейкоцитоз 18,6 × 109/л, сдвиг лейкоформулы влево, анемия (Эр 2,4 × 1012/л, Нв 75 г/л), умеренная тромбоцитопения (125 × 109/л), СОЭ 45 мм/ч. Гемолитико-уремический синдром при этом был исключен. В биохимическом анализе крови определена азотемия (мочевина 12,8 ммоль/л, креатинин 232 мкмоль/л), умеренное повышение АЛТ (52 Ед/л), С-реактивный белок (20,5 мг/л). Диурез составил <0,3 мл/кг/час.
В связи с развитием ОПП пациент был переведен в отделение интенсивной терапии инфекционного стационара, где получал этиотропную терапию (противовирусную и антибактериальную), диуретики, контролируемую инфузионную терапию, коррекцию нарушений гомеостаза. На 5-е сутки диурез составил 0,7 мл/кг/час, функции почек полностью восстановились к концу первой недели болезни. ЗПТ не потребовалось. Ребенок был выписан на 16 сутки.
Таким образом, у мальчика на фоне тяжелого течения коронавирусной инфекции с поражением респираторного и желудочно-кишечного тракта постепенно развилась анурия. Быстрый положительный ответ на проводимую терапию является достоверным положительным прогностическим показателем.
ОПП у детей встречается значительно реже по сравнению со взрослыми пациентами (20–40% реанимационных больных) по данным разных авторов [5, 7]. ОПП у взрослых пациентов рассматривается как маркер полиорганной недостаточности и тяжести заболевания. В наших наблюдениях ОПП развилась у 10,5% детей с тяжелым течением COVID-19. Частота повреждения почек в остром периоде коронавирусной инфекции представлена в табл.
Таблица. Частота повреждения почек у детей с COVID-19 в зависимости от тяжести течения заболевания
Вид повреждения почек | Тяжесть течения COVID-19 | c2, р | ||
Легкая (n = 278) | Среднетяжелая (n = 144) | Тяжелая (n = 19) | ||
недифференцированный мочевой синдром (n = 55) | 15 (5,4%) | 34 (23,6%) | 6 (31,6%) | 4,55 <0,05* |
протеинурия (n = 36) | 6 (2,2%) | 24 (16,7%) | 6 (31,6%) | 5,82 <0,01* |
гематурия (n = 16) | 1 (0,4%) | 11 (7,6%) | 4 (21,0%) | 7,33 <0,01* |
лейкоцитурия (n = 12) | 10 (3,6%) | 2 (1,4%) | 0 | 0,04 >0,5 |
диабетическая нефропатия (n = 2) | 0 | 1 (0,7%) | 1 (5,3%) | 4,21 <0,05* |
ОПП (n = 2) | 0 | 0 | 2 (10,5%) | |
* достоверность при р < 0,05
Таким образом, вовлечение почек в инфекционный процесс выявлено у каждого 8-го ребенка с COVID-19 чаще в виде недифференцированного мочевого синдрома, частота выявления которого коррелировала с тяжестью течения коронавирусной инфекции: при тяжелом течении протеинурия определена у 31,6% пациентов, гематурия – у 21%, ОПП – у 10,5%, диабетическая нефропатия – у 5,3%.
Уже после выписки из стационара мы наблюдали ребенка с НС, развившемся после перенесенной коронавирусной инфекции. Известно, что респираторно-вирусные инфекции, в т. ч. грипп, аденовирус и др., а также персистенция респираторного вируса могут способствовать как развитию НС, так и его обострению. Этому способствует и генетическая предрасположенность, которая нередко обнаруживается у детей с НС [36].
Клинический случай 2
Девочка в возрасте 1,5 лет из семейного очага COVID-19, отец и мать ребенка перенесли вирусную пневмонию. Ребенок от 2-й беременности, протекавшей с угрозой прерывания и артериальной гипертензией у матери. Вес при рождении 2750 г, рост – 52 см. У отца девочки хроническая болезнь почек, 3-я стадия, хронический пиелонефрит. Ребенок находился на грудном вскармливании, до 1,5 лет не болела респираторными заболеваниями.
Поступила в ГБУЗ «Самарская областная детская инфекционная больница» на 4-е сутки болезни с жалобами на затруднение дыхания, кашель, жидкий стул, однократную рвоту, повышение температуры до 39 ºС. При исследовании мазков из ротоглотки выделена РНК SARS-CoV-2. По данным КТ определена двусторонняя пневмония с поражением легких в объеме 30–35%. На 5 день госпитализации выявлена значительная протеинурия – 4,5 г/л/сут, кратковременная азотемия – повышение уровня мочевины до 10,6 ммоль/л. Изменения в моче были однократными, азотемия быстро купировалась. Девочка была выписана через 14 дней, анализы мочи были без изменений. Через 2 нед. после выписки у ребенка ухудшается самочувствие, появляется вялость, слабость, отеки на голенях и стопах, на лице. Ребенок был госпитализирован в отделение нефрологии. У девочки развивается полная картина НС: выраженные отеки, протеинурия (до 8 г/л/сут), гипоальбуминемия (25 г/л), диспротеинемия, гиперлипидемия.
Ультразвуковая картина органов брюшной полости включала признаки полисерозита, увеличение почек в размерах, повышение эхогенности коркового слоя, обеднение васкуляризации в подкапсульной области почек.
Курс терапии преднизолоном в дозе 2 мг/кг в течение 6 нед. дал эффект. Диагноз – вторичный нефротический синдром, стероидчувствительный вариант, стадия клинико-лабораторной ремиссии. Ограничение концентрационной функции почек. В настоящее время девочка наблюдается в Самарском нефрологическом центре.
Таким образом, по данным отечественных и зарубежных авторов и нашим собственным наблюдениям, инфекция COVID-19 вызывает повреждения почек у детей. Согласно проведенному анализу, у 12,5% детей встречается изолированный мочевой синдром, который нередко представляет значительные трудности при обследовании пациента с COVID-19. Это могут быть больные со скрытой почечной патологией, требующие длительного наблюдения. Частота развития ОПП по данным разных авторов колеблется от 1,3% до 44%. ОПП развивается уже при поступлении в госпиталь и нередко разрешается перед выпиской. Как и у взрослых пациентов, у детей с ОПП отмечены более высокие маркеры воспаления (лейкоцитоз и высокий уровень С-реактивного белка, низкий уровень сывороточного альбумина). ОПП ассоциируется с повышенной заболеваемостью и смертностью, а также с остаточной почечной недостаточностью при выписке. Ключ к успешному лечению ОПП у детей – гибкое использование ресурсов, понимание методов диализа и командная работа. По данным наших исследований, ОПП развилось у 10,5% детей с тяжелым течением коронавирусной инфекции, функциональное состояние почек восстановилось без проведения ЗПТ. В различных публикациях подчеркиваются пробелы в знаниях и необходимость дальнейших исследований с включением детской когорты с инфекцией COVID-19.
Выводы
Поражение почек при коронавирусной инфекции, согласно нашим наблюдениям, отмечено в 12,9% в остром периоде заболевания (у каждого 8-го ребенка). При этом преобладал изолированный мочевой синдром (транзиторная протеинурия, гематурия), частота возникновения которого зависела от тяжести COVID-19: при тяжелом течении протеинурия отмечена у 31,6% пациентов, гематурия – у 21,0%. Частота развития ОПП среди детей с тяжелым течением заболевания составляла 10,5%, повреждение почек характеризовалось достаточно быстрым восстановлением диуреза и показателей азотемии без проведения специальной почечной терапии.
Дети с респираторными симптомами COVID-19 требуют проведения мониторинга функции почек с целью раннего выявления и коррекции в случае ее нарушения. Пациенты с изолированным мочевым синдромом в острый период нуждаются в длительном наблюдении с целью выявления скрытой почечной патологии. Также требует дальнейшего изучения анализ клинических проявлений и возможных осложнений COVID-19 у пациентов детского возраста.
Список литературы / References
- Hatmi Z.N. A Systematic Review of Systematic Reviews on the COVID-19 Pandemic. SN Compr Clin Med. 2021;3:419-436. https://doi.org/10.1007/s42399-021-00749-y.
- Golden T.N., Simmons R.A. Maternal and neonatal response to COVID-19. Am J Physiol Endocrinol Metab. 2020;319(2):е315-е319. https://doi.org/10.1152/ajpendo.00287.2020.
- Горелов А.В., Николаева С.В., Акимкин В.Г. Новая коронавирусная инфекция COVID-19: особенности течения у детей в Российской Федерации. Педиатрия. Журнал имени Г.Н. Сперанского. 2020;99(6):57-62. https://doi.org/10.24110/0031-403X-2020-99-6-57-62.
- Guan W.J., Ni Z.Y., Hu Y., Liang W.Н., Ou C.Q., He J.Х. et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708-1720. https://doi.org/10.1056/NEJMoa2002032.
- Cheng Y., Luo R., Wang K., Zhang M., Wang Z., Dong L. et al. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney Int. 2020;97(5):829-838. https://doi.org/10.1016/j.kint.2020.03.005.
- Han X., Ye Q. Kidney involvement in COVID-19 and its treatments. J Med Virol. 2021;93(3):1387-1395. https://doi.org/10.1002/jmv.26653.
- Nadim M.K., Forni L.G., Mehta R.L., Connor M.J.Jr., Liu K.D., Ostermann M. et al. COVID-19-associated acute kidney injury: consensus report of the 25th Acute Disease Quality Initiative (ADQI) Workgroup. Nat Rev Nephrol. 2020;16(12):747-764. https://doi.org/10.1038/s41581-020-00356-5.
- Cheruiyot I., Henry B., Lippi G., Kipkorir V., Ngure B., Munguti J., Misiani M. Acute Kidney Injury is Associated with Worse Prognosis In COVID-19 Patients: A Systematic Review and Meta-analysis. Acta Biomed. 2020;91(3):e2020029. https://doi.org/10.23750/abm.v91i3.10222.
- Столяревич Е.С., Фролова Н.Ф., Артюхина Л.Ю., Варясин В.В. Поражение почек при Covid-19: клинические и морфологические проявления почечной патологии у 220 пациентов, умерших от Covid-19. Нефрология и диализ. 2021;23(3):255-436. https://doi.org/10.28996/2618-9801-2021-3-379-389.
- Deep A., Bansal M., Ricci Z. Acute Kidney Injury and Special Considerations during Renal Replacement Therapy in Children with Coronavirus Disease-19: Perspective from the Critical Care Nephrology Section of the European Society of Paediatric and Neonatal Intensive Care. Blood Purif. 2021;50(2):150-160. https://doi.org/10.1159/000509677.
- Ort M., Dingemanse J., van den Anker J., Kaufmann P. Treatment of Rare Inflammatory Kidney Diseases: Drugs Targeting the Terminal Complement Pathway. Front Immunol. 2020;11:599417. https://doi.org/10.3389/fimmu.2020.599417.
- Basaalely A., Gurusinghe S., Schnaider J., Shah S.S., Siegel L.B., Pollack G. et al. Acute Kidney injury in pediatric patients hospitalized with acute COVID-19 and multisystem inflammatory syndrome in children associated with COVID-19. Kidney Int. 2021;100(1):138-145. https://doi.org/10.1016/j.kint.2021.02.026.
- Kari J.A., Shalaby M.A., Albanna A.S., Alahmadi T.S., Alherbish T.S., Alhasan K.A. Acute kidney injury in children with COVID-19: a retrospective study. BMS Nephrology. 2021;22(1):202. https://doi.org/10.1186/s12882-021-02389-9.
- Wang X., Chen X., Tang F., Luo W., Fang J., Qi C., Sun H. et al. Be aware of acute kidney injury in critically ill children with COVID-19. Pediatr Nephrol. 2021;36(1):163-169. https://doi.org/10.1007/s00467-020-04715-z.
- Stewart D.J., Hartley J.C., Johnson M., Marks S.D, Pré P., Stojanovic J. Renal dysfunction in hospitalised children with COVID-19. Lancet Child Adolesc Health. 2020;4(8):e28-e29. https://doi.org/10.1016/S2352-4642(20)30178-4.
- Baradaran A., Malek A., Moazzen N., Shaye Z.A. COVID-19 Associated Multisystem Inflammatory Syndrome: A Systematic Review and Metaanalysis. Iran J Allergy Asthma Immunol. 2020;19(6):570-588. https://doi.org/10.18502/ijaai.v19i6.4927.
- Silva A.C.S., Lanza K., Palmeira V.A., Costa L.B., Flynn J.T. 2020 update on the renin-angiotensin-aldosterone system in pediatric kidney disease and its interactions with coronavirus. Pediatr Nephrol. 2021;36(6):1407-1426. https://doi.org/10.1007/s00467-020-04759-1.
- Sparks M.A., South A.M., Badley A.D., Baker-Smith C.M., Batlle D., Bozkurt B. et al. Severe Acute Respiratory Syndrome Coronavirus 2, COVID-19, and the Renin-Angiotensin System. Pressing Needs and Best Research Practices. Hypertension. 2020;76(5):1350-1367. https://doi.org/10.1161/HYPERTENSIONAHA.120.15948.
- Pourfridoni M., Abbasnia S.M., Shafaei F., Razaviyan J., Heidari-Soureshjani R. Fluid and Electrolyte Disturbances in COVID-19 and Their Complications. Biomed Res Int. 2021;2021:6667047. https://doi.org/10.1155/2021/6667047.
- Кульченко Н.Г. Эпидемиология болезней почек у пациентов с COVID-19. Research’n Practical Medicine Journal. 2020;7(3):74-82. https://doi.org/10.17709/2409-2231-2020-7-3-7.
- Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. et al. Clinical features of patents infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. https://doi.org/10.1016/S0140-6736(20)30183-5.
- Cohen J.B., South A.M., Shaltout H.A., Sinclair M.R., Sparks M.A. Reninangiotensin system blockade in the COVID-19 pandemic. Clin Kidney J. 2021;14(Suppl 1):i48-i59. https://doi.org/10.1093/ckj/sfab026.
- Edmonston D.L., South A.M., Sparks M.A., Cohen J.B. Coronavirus Disease 2019 and Hypertension: The Role of Angiotensin-Converting Enzyme 2 and the Renin-Angiotensin System. Adv Chronic Kidney Dis. 2020;27(5):404-411. https://doi.org/10.1053/j.ackd.2020.07.002.
- Lai C.C., Ko W.C., Lee P.I., Jean S.S., Hsueh P.R. Extra-respiratory manifestations of COVID-19. Int J Antimicrob Agents. 2020;56(2):106024. https://doi.org/10.1016/j.ijantimicag.2020.106024.
- Palevsky P.M., Radhakrishnan J., Townsend R.R. COVID-19: Issues related to acute kidney injury, glomerular disease, and hypertension. UpToDate, Inc.; 2021. Available at: https://www.uptodate.com/contents/covid-19-issuesrelated-to-acute-kidney-injury-glomerular-disease-and-hypertension/print.
- Shen Q., Wang M., Che R., Li Q., Zhou J., Wang F. et al. Consensus recommendations for the care of children receiving chronic dialysis in association with the COVID-19 epidemic. Pediatr Nephrol. 2020;35(7):1351-1357. https://doi.org/10.1007/s00467-020-04555-x.
- Lew S.Q., Wallace E.L., Srivatana V., Warady B.A., Watnick S., Hood J. et al. Telehealth for Home Dialysis in COVID-19 and Beyond: A Perspective From the American Society of Nephrology COVID-19 Home Dialysis Subcommittee. Am J Kidney Dis. 2021;77(1):142-148. https://doi.org/10.1053/j.ajkd.2020.09.005.
- Enia T., Morimota Y., Oshima R., Myazaki K., Miyazawa T., Okada M., Sugimoto K. Nephrotic syndrome relapse in a boy with COVID-19. CEN Case Rep. 2021;10(3):431-434. https://doi.org/10.1007/s13730-021-00587-w.
- Alvarado A., Franceschi G., Resplandor E., Sumba J., Orta N. COVID-19 associated with onset nephrotic Syndrome in a pediatric patient: considinse or related conditions? Pediatr Nephrol. 2021;36(1):205-207. https://doi.org/10.1007/s00467-020-04724-y.
- Каганцов И.М., Сизонов В.В., Шелегин Р.В., Сварич В.Г. Новая коронавирусная инфекция (COVID-19), ассоциированная с инфарктом почки у 17-летнего ребенка. Урология. 2021;(1):84-88. https://doi.org/10.18565/urology.2021.1.84-88.
- Гасилина Е.С., Борисова О.В., Санталова Г.В. Роль инфекций в формировании хронической болезни почек у детей. Практическая медицина. 2012;1(56):7-12. Режим доступа: https://www.elibrary.ru/item.asp?id=17335412.
- Pan X.-W., Xu D., Zhang H., Zhou W., Wang L-H., Cui X-G. Identification of a potential mechanism of acute kidney injury during the COVID-19 outbreak: a study based on single-cell transcriptome analysis. Intensive Care Med. 2020;46(6):1114-1116. https://doi.org/10.1007/s00134-020-06026-1.
- Martinez-Rojas M.A., Vega-Vega O., Bobadilla N.A. Is the kidney a target of SARS-CoV-2? Am J Physiol Renal Physiol. 2020;318(6):F1454-F1462. https://doi.org/10.1152/ajprenal.00160.2020.
- Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-1062. https://doi.org/10.1016/s0140-6736(20)30566-3.
- Wang L., Li X., Chen H., Yan S., Li D., Li Y., Gong Z. Coronavirus Disease 19 Infection Does Not Result in Acute Kidney Injury: An Analysis of 116 Hospitalized Patients from Wuhan, China. Am J Nephrol. 2020;51(5):343-348. https://doi.org/10.1159/000507471.
- Zhang X., Wang Z., Dong I., Guo Y., Wu J., Zhai S. New insightinto the pathogenesis of minimal change nephrotic syndrome: Role of the persistence of respiratory tract virus in immune desorders. Autoimmun Rev. 2016;15(7):632-637. https://doi.org/10.1016/j.autrev.2016.02.007.