Журнал "Медицинский совет" №5/2022
DOI: 10.21518/2079-701X-2022-16-5-78-85
З.С. Зайдиева,https://orcid.org./0000-0002-5270-2915
Е.С. Безуглова, https://orcid.org/0000-0001-9293-1299
М.К. Меджидова, https://orcid.org/0000-0001-6938-4207
Родильный дом Городской клинической больницы №40; 129336, Россия, Москва, ул. Таймырская, д. 6
Введение. По данным отечественных и зарубежных авторов, большинство женщин к концу беременности имеют ту или иную стадию недостатка железа, а к моменту родов истощаются его запасы в депо и формируется анемия. На фоне острого воспаления, в т. ч. вызванного COVID-19, происходит деструкция эритроцитов, что приводит к хаотичному распределению железа по тканям и выраженной потере его запасов и усугублению имеющегося дефицита. К моменту родов с наслоившимися изменениями на фоне новой коронавирусной инфекции дефицит железа создает в послеродовом периоде благоприятные условия для развития инфекционно-воспалительных осложнений.
Цель. Оценить особенности течения послеродового периода и гематологического статуса у родильниц с постковидной анемией на фоне комплексного лечения с применением антианемического препарата двухвалентного железа.
Материал и методы. В проспективное исследование были включены 30 родильниц (основная группа) в послеродовом периоде, перенесшие коронавирусную инфекцию в период гестации с легкой степенью ЖДА. В группу 2 (группа сравнения) вошли 15 родильниц с легкой ЖДА, не перенесшие коронавирусную инфекцию в период гестации. В группу 3 (контрольная группа) вошли 15 условно здоровых родильниц, не болевших в период гестации новой коронавирусной инфекцией и не страдающие ЖДА.
Результаты и обсуждение. Родильницы, перенесшие COVID-19 в период гестации, достоверно чаще имели инфекционновоспалительные заболевания в послеродовом периоде. У родильниц с ЖДА на фоне перенесенной коронавирусной инфекции субинволюция матки, послеродовый эндометрит и тиреоидит, расхождение швов на промежности и серомы (гематомы) шва после операции кесарева сечения, дисбиотические состояния микробиоты влагалища встречались достоверно чаще, чем у женщин групп сравнения и контроля (индекс SBI, p < 0,05). Заключение. Женщины, перенесшие COVID-19 во время беременности, должны быть выделены в группу инфекционного риска по возможности развития послеродовых осложнений с своевременной коррекцией сопутствующей патологии и адекватным лечением ЖДА. >< 0,05).
Заключение. Женщины, перенесшие COVID-19 во время беременности, должны быть выделены в группу инфекционного риска по возможности развития послеродовых осложнений с своевременной коррекцией сопутствующей патологии и адекватным лечением ЖДА.
Для цитирования: Зайдиева З.С., Безуглова Е.С., Меджидова М.К. Опыт клинического применения двухвалентного сульфата железа в терапии постковидной анемии родильниц. Медицинский Совет. 2022;(5):78-85. https://doi.org/10.21518/2079-701X-2022-16-5-78-85
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Experience in the clinical administration of ferrous sulfate for treating post-covid anemia in puerperas
Zulya S. Zaydiyeva,https://orcid.org./0000-0002-5270-2915
Elena S. Bezuglova, https://orcid.org/0000-0001-9293-1299
Marzhana K. Medzhidova, https://orcid.org/0000-0001-6938-4207
Birth Centre of City Clinical Hospital No. 40; 6, Taymyrskaya St., Moscow, 129336, Russia
Introduction. According to domestic and foreign authors, most women have a greater or lesser level of iron deficiency by the end of pregnancy and deplete their depot iron reserves, and anaemia develops by the time of delivery. Erythrocyte destruction occurs in presence of acute inflammation, including that caused by COVID-19, which leads to a chaotic distribution of iron within tissues and a pronounced loss of its reserves and aggravation of the existing deficiency. Due to overlapping changes with underlying novel coronavirus infection, iron deficiency creates favourable conditions for the development of infectious and inflammatory complications in the postpartum period by the time of delivery.
Aim. To assess the features of the postpartum period and hematological status in puerperas with post-COVID anemia, who receive the combination therapy including an anti-anemic ferrous iron drug.
Materials and methods. The prospective study included 30 puerperas (treatment group) in the postpartum period, who had a coronavirus infection with a mild degree of IDA during the gestation period. Group 2 (comparison group) included 15 puerperas with mild IDA, who did not have a coronavirus infection during the gestation period. Group 3 (control group) included 15 conditionally healthy puerperas, who had no novel coronavirus infection and did not suffer from IDA during the gestation period.
Results and discussion. The puerperas, who had COVID-19 in pregnancy, developed infectious and inflammatory diseases significantly more often in the postpartum period. Subinvolution of the uterus, postpartum endometritis and thyroiditis, disruption of perineal stitches and seromas (hematomas) of the suture after cesarean section, vaginal dysbiotic conditions occurred significantly more often in puerperas with IDA, who came through coronavirus infection, than in women from the comparison group and control group (SBI index, p < 0.05).
Conclusion. Women who had COVID-19 in pregnancy should be spinned off into a separate infectious risk group due to the possibility of postpartum complications and timely management of concomitant pathologies and appropriate treatment of IDA.
For citation: Zaydieva Z.S., Bezuglova E.S., Medzhidova M.K. Experience in the clinical administration of ferrous sulfate for treating post-covid anemia in puerperas. Meditsinskiy sovet = Medical Council. 2022;(5):78-85. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-5-78-85
Conflict of interest: the authors declare no conflict of interest.
Введение
Железо относится к незаменимым микроэлементам, а его регулярное и адекватное поступление абсолютно необходимо для нормальной жизнедеятельности организма [1–3]. Снижение содержания железа в сыворотке крови, костном мозге и депо при беременности в связи с большими его затратами на создание фетоплацентарного комплекса и перераспределением в пользу плода приводит к возникновению железодефицитных состояний (ЖДС) [1, 2]. Данное состояние с истощением его транспортных и органных запасов приводит к обеднению клеток и тканей железосодержащими и железозависимыми ферментами, нарушению окислительно-восстановительных и метаболических процессов в эритроцитах с развитием тканевой гипоксии [1, 2].
При острых респираторных вирусных инфекциях, а также у пациенток с хроническими заболеваниями возникает нарушение депонирования железа в печени, а также недостаточность синтеза белков, транспортирующих его (трансферрин и ферритин) [4, 5]. На фоне острого воспаления при COVID-19 происходит массовая деструкция эритроцитов, что приводит к хаотичному распределению свободного железа в тканях, а также к усилению потери железа в организме и усугублению ЖДА [6–8].
Около половины женщин к началу беременности имеет истощенные или полностью израсходованные запасы железа [2, 3]. В таком состоянии женщины вступают в беременность, что согласно данным ряда исследователей приводит к недостатку железа в конце гестационного процесса и послеродовом периоде у всех без исключения пациенток либо в скрытой, либо в явной форме [9]. По данным литературы, анемия в послеродовом периоде встречается в среднем у 10–70% рожениц. [1, 2, 9] Запасы железа остаются низкими в течение нескольких месяцев после родов, особенно если роды сопровождались обильной кровопотерей, а пациентка не получала терапию, направленную на восполнение запасов железа [3, 5].
При дефиците железа беременные и родильницы восприимчивы к инфекционным заболеваниям, т. к. железо принимает участие в работе иммунокомпетентной системы [10]. Если у беременной с исходно нормальными показателями крови на фоне коронавирусной инфекции формируется анемия, то ее патогенез тесно связан не только с высоким уровнем воспаления и ускоренной гибелью эритроцитов, но и с дефицитом ряда микроэлементов [11, 12].
Биологическая значимость железа определяется его участием в тканевом дыхании, при дефиците железа у пациентов возникает прогрессирующая гемическая гипоксия с последующим развитием вторичных метаболических расстройств, в т. ч. осложняющих течение послеродового периода [9, 13].
Лечение железодефицитной анемии должно быть комплексным и индивидуальным, а выбор препарата для восполнения дефицита железа должен основываться на высокой биодоступности при минимальных побочных эффектах [1]. Таким образом, представляется актуальным изучение клинической эффективности железосодержащих препаратов, представленных на фармацевтическом рынке для лечения анемии [2, 9].
Целью исследования – проанализировать эффективность антианемического препарата Сорбифер Дурулес в лечении родильниц с ЖДА, перенесших в инфекцию COVID-19 в период гестации.
В исследовании изучалась эффективность антианемического препарата Сорбифер Дурулес, показанием к применению которого являлась также повышенная потребность в железе при беременности и кормлении грудью. Сорбифер Дурулес – круглые двояко выпуклые таблетки, которые содержат двухвалентное железо в виде сульфата в количестве, эквивалентном содержанию 100 мг железа, и аскорбиновую кислоту в дозе 60 мг.
Материалы и методы
На первом этапе запланированной работы проводилась оценка соматического и гинекологического статуса, а также клинико-лабораторных показателей обратившихся на прием родильниц, перенесших COVID-19 в 1-м и 2-м триместрах беременности. В проспективное исследование были включены 30 родильниц (основная группа) в позднем послеродовом периоде, перенесшие коронавирусную инфекцию в период гестации с легкой степенью ЖДА.
Критерии включения в исследование:
1. Лабораторно диагностированная инфекция COVID-19 в 1-м и 2-м триместрах гестации:
– положительный результат исследования на наличие РНК SARS-CoV-2 с применением методов амплификации нуклеиновых кислот или антигена SARS-CoV-2 с применением иммунохромографического анализа вне зависимости от клинических проявлений;
– положительный результат на антитела класса IgM и/или IgG у пациенток с клинически подтвержденной инфекцией COVID-19.
2. Уровень гемоглобина пациенток – 90–110 г/л, эритроциты – 3,3–3,7, гематокрит – 30,5–35%, ферритин – ≤20 мкг/л, сывороточное железо – менее 12,5 мкмоль/л.
В группу 2 (группа сравнения) вошли 15 родильниц в позднем послеродовом периоде с легкой степенью ЖДА, не перенесшие коронавирусную инфекцию в период гестации. Группу 3 (контрольная группа) составили 15 условно здоровых родильниц, не болевших в период гестации новой коронавирусной инфекцией и не имевших ЖДА.
Критерии исключения:
1. Тяжелая соматическая патология.
2. Сахарный диабет, включая гестационный сахарный диабет на дието- и инсулинотерапии.
3. ЖДА средней и тяжелой степени.
4. Другие формы анемий.
Кроме того, у всех женщин был изучен общий и гинекологический анамнез, особенности менструальной и генеративной функции. Внимание уделяли характеру питания, наличию заболеваний желудочно-кишечного тракта, клинических признаков дефицита железа, очагов хронической инфекции, анемии в анамнезе, течению гестационного периода. Общий осмотр включал в себя оценку окраски, влажности кожных покровов и слизистых, измерение артериального давления и частоты пульса, гинекологический осмотр, ультразвуковое исследование органов малого таза (табл. 1). Материалом для проведения клинического, биохимического анализ крови и определения антител IgM и IgG к COVID-19 служила сыворотка венозной крови. Было проведено микробиологическое исследование влагалищного отделяемого с определением чувствительности к антибиотикам.
Статистическая обработка полученных данных проводилась с использованием пакета программ Statistica 7,0 и таблиц Exсel 2007. На основании величины t-критерия Стьюдента и степени свободы n по таблице распределения t находили вероятность различия р. Достоверными считались данные, для которых вероятность ошибки была меньше 0,05 (р < 0,05). Для непараметрических данных использовался программный пакет BioStat, включая критерий Хи-квадрат. Статистически достоверными считались значения р < 0,05.
Результаты и обсуждение
Средний возраст в 1-й группе составил 31,5 года, во 2-й группе – 33,9 года, в 3-й группе – 32,2 года.
Таблица 1. Анализ жалоб и визуального осмотра обследованных родильниц (%)
Жалобы/Осмотр | Группа 1 | Группа 2 | Группа 3 | р |
Цианоз кожных покровов и слизистых | 70 | 66,6 | 13,3 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Кровоточивость десен | 73,3 | 40 | 26,6 | 2–3 > 0,05;1–3; 1–2 < 0,05 |
Ангулярный хейлит | 36,6 | 26,6 | 6,66 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Эрозивно-язвенные повреждения слизистой оболочки рта | 13,3 | 6,6 | 0 | 1–2; 1–3; 2–3 < 0,05 |
Сухость кожных покровов | 56,6 | 53,3 | 33,3 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Ломкость ногтей | 16,6 | 13,3 | 6,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Диффузная алопеция | 23,3 | 13,3 | 0 | 1–2; 1–3; 2–3 < 0,05 |
Тахикардия, низкое АД | 23,3 | 26,6 | 20 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Нарушение вкусовых ощущений | 70 | 33,3 | 6,6 | 1–2; 1–3; 2–3 < 0,05 |
Слабость, головокружения | 63,3 | 40 | 6,6 | 1–2; 1–3; 2–3 < 0,05 |
При анализе жалоб пациенток и визуальном осмотре было выявлено, что цианоз кожных покровов и слизистых, сухость кожных покровов, выпадение волос, ломкость ногтей, извращение вкуса, слабость и головокружения, а также кровоточивость десен, ангулярный хейлит, эрозивно-язвенные поражения слизистой рта достоверно чаще встречались у родильниц с ЖДА в сравнении с группой контроля, что согласуется с проведенными ранее исследованиями [14].
Кровоточивость десен, диффузная алопеция, извращение вкуса, слабость и головокружения достоверно чаще отмечались в группе родильниц, перенесших СOVID 19 в сравнении с группами 2 и 3. Выявленные изменения указывают на негативное действие вируса на сосудистую стенку и выраженное истощение запасов витаминов и микроэлементов в организме беременной и родильницы при железодефицитных состояниях [15].
Цианоз и сухость кожных покровов и слизистых, ломкость ногтей, ангулярный хейлит и эрозивно-язвенные поражения слизистой в группе сравнения встречались реже, чем в основной, но достоверно чаще, чем в группе контроля, что является неоспоримым доказательством негативного влияния дефицита железа на беременность и послеродовый период [14].
Таблица 2. Оценка соматического и гинекологического статуса обследованных пациенток (%)
Результаты осмотра | Группа 1 | Группа 2 | Группа 3 | р |
Субинволюция матки (лохиометра) | 13,3 | 6,6 | – | 1–2; 1–3; 2–3 < 0,05 |
Послеродовый эндометрит (легкая форма) | 6,6 | – | – | 1–2; 1–3 < 0,05 |
Расхождения швов на промежности (после кесарева сечения) | 6,6 | – | – | 1–2; 1–3 < 0,05 |
Гематомы (серомы) акушерской хирургической раны | 6,6 | – | – | 1–2; 1–3 < 0,05 |
Инфекция хирургической акушерской раны | 13,3 | – | – | 1–2 > 0,05;1–3;2–3 < 0,05 |
Другие инфекции половых путей после родов (цервицит, вагинит) | 16,6 | 13,3 | 13,3 | 1–2; 1–3; 2–3 > 0,05 |
Инфекции мочевых путей после родов | 20 | 20 | 6,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Инфекции молочной железы и нарушения лактации, связанные с деторождением | 16,6 | 20 | 6,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Послеродовый тиреоидит | 3,3 | – | – | 1–2; 1–3 < 0,05 |
По результатам проведенного обследования у пациентов 1-й группы достоверно чаще встречались субинволюция матки, послеродовый эндометрит, расхождения швов на промежности, серомы и гематомы швов после операции кесарево сечение, а также воспаление щитовидной железы в послеродовом периоде (табл. 2).
У женщин с ЖДА (1-я и 2-я группы) по сравнению с группой контроля, достоверно чаще помимо вышеуказанных изменений отмечались инфекции молочной железы и мочевых путей.
Выявленные изменения подтверждают данные литературы о ЖДА родильниц как предрасполагающем факторе для реализации инфекционных осложнений, усугубляющемся негативным влиянием вирусной инфекции, в т. ч. COVID-19 [16–18].
Таблица 3. Результаты микробиологического исследования влагалищного отделяемого (%)
Показатели | Группа 1 | Группа 2 | Группа 3 | р |
Porphyromonas spp. | 13,3 | 13,3 | 6,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Leptotrichia spp. | 23,3 | 13,3 | 6,6 | 1–2; 1–3; 2–3 < 0,05 |
Staphylococcus aureus | 36,6 | 33,3 | 0 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Candida albicans | 43,3 | 53,3 | 26,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Streptococcus viridans | 23,3 | 20 | 13,3 | 1–2; 1–3; 2–3 > 0,05 |
Klebsiella pneumonia | 6,6 | 0 | 0 | 1–2; 1–3 < 0,05 |
Gardnerrela vaginalis | 46,6 | 33,3 | 13,3 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Atopobium vagina | 23,3 | 13,3 | 6,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Prevotella bivia | 10 | 6,6 | 0 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Ureaplasma urealiticum | 13,3 | 13,3 | 0 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Enterococcus faecalis | 36,6 | 26,6 | 6,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Streptococcus agalactiae | 43,3 | 20 | 6,6 | 1–2; 1–3; 2–3 < 0,05 |
Enterobacter cloacae | 6,6 | 6,6 | 0 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Escherichia coli | 36,6 | 20 | 13,3 | 2–3 > 0,05;1–2; 1–3 < 0,05 |
Lactobacillus acidophilus | 36,6 | 33,3 | 66,6 | 1–2 > 0,05;1–3; 2–3 < 0,05 |
Lactobacillus spp. | 43,3 | 46,6 | 73,3 | 1–2; 1–3; 2–3 > 0,05 |
Как видно из представленных данных, при микробиологическом исследовании (табл. 3) отделяемого половых органов у пациенток с ЖДА имелись выраженные нарушения биоценоза влагалища, что согласуется с имеющимся литературным данными [2, 19, 20].
Наиболее часто в основной группе был обнаружен Streptococcus agalactiae (43,3%), Candida albicans (43,3%) и Gardnerella vaginalis (46,6%). Klebsiella pneumonia была выделена в 6,6% случаев только в группе 1. В группе сравнения наиболее часто определялась Candida albicans (53,3%), чуть реже встречались Staphylococcus aureus и Gardnerella vaginalis – оба по 33,3%.
Снижение представителей нормальной микрофлоры позволяет говорить о наличии дисбиотических сдвигов у всех родильниц на фоне ЖДА, что является благоприятным фоном для развития инфекционно-воспалительных заболеваний послеродового периода [3, 21, 22].
Не стало находкой и то, что наиболее выраженные дисбиотические изменения микрофлоры влагалища были отмечены у пациенток с ЖДА после перенесенной инфекции COVID-19 [23–26].
Для коррекции ЖДА в основной группе и группе сравнения был использован антианемический препарат Сорбифер Дурулес, содержащий железо-II-сульфат в количестве, эквивалентном 100 мг железа, и аскорбиновую кислоту (витамин C) в количестве, эквивалентном 60 мг сухого вещества. Показанием для назначения препарата является лечение и профилактика ЖДА, в т. ч. при беременности и в период грудного вскармливания, что дало возможность остановить свой выбор на назначении этого препарата женщинам с легкой степенью ЖДА в послеродовом периоде [27]. Важным преимуществом при выборе препарата стала технология Дурулес, обеспечивающая постепенное замедленное высвобождение активного компонента, что позволяет минимизировать вероятность нежелательных явлений и повысить приверженность пациенток к проводимой терапии. Особое покрытие предотвращает растворение таблетки в желудке, равномерное высвобождение препарата начинает происходить только в кишечнике. Поступление лекарственного препарата в кровь происходит в течение 6 ч [28, 29]. Входящая в состав аскорбиновая кислота также улучшает всасывание железа в кишечнике на 30%, что повышает биодоступность препарата и положительно сказывается на темпах прироста железа [29].
Препарат назначался в лечебной дозировке по 1 табл. 2 раза в день в течение 8 нед. Параллельно проводилась коррекция выявленных инфекционно-воспалительных нарушений, санация влагалища, при необходимости антибактериальная терапия.
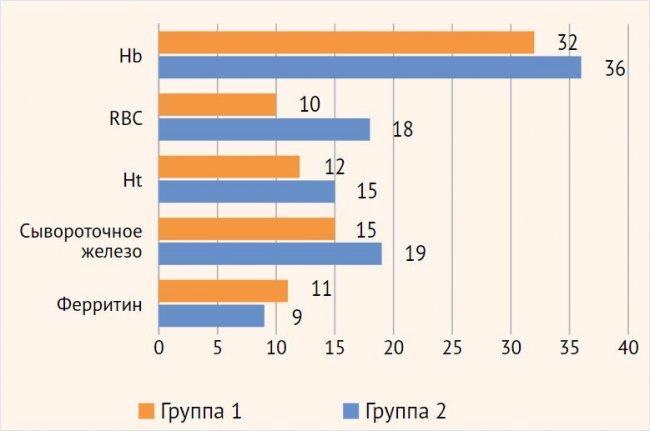
Прирост среднего значения концентрации Нb и ферритина по отношению к исходному спустя 8 нед. на фоне лечения препаратом Сорбифер Дурулес оказался достоверно выше у пациенток группы сравнения, не болевших COVID-19, что еще раз подтверждает глубину нарушений метаболизма железа на фоне инфекционного процесса и совпадает с данными проведенных ранее исследований (рис. 1) [4, 5, 30.].
Рисунок 1. Гематологические показатели на фоне лечения препаратом Сорбифер Дурулес (через 4 нед.)
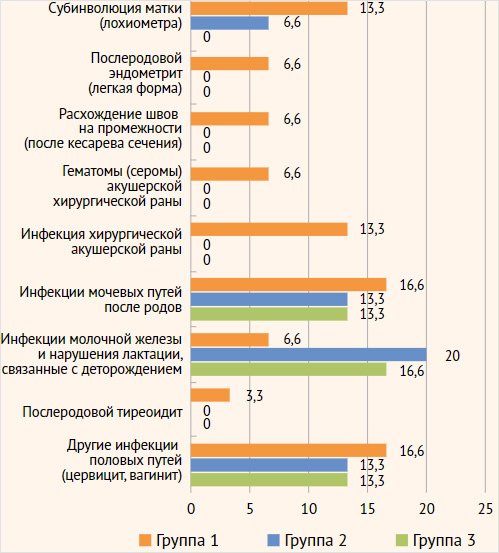
Оценка соматического и гинекологического статуса родильниц показала, что через 4 нед. лечения препаратом Сорбифер Дурулес совместно с этиопатогенетической терапией практически все клинические симптомы инфекционно-воспалительных изменений были купированы, кроме острого тиреоидита и дисбиоза влагалища в группе 1 (рис. 2). Пациентки, переболевшие COVID-19, требовали более длительного назначения системных мета-, про- и симбиотиков для коррекции дисбиотического состояния организма, вызванного новой коронавирусной инфекцией, что согласуется с ранее проведенными исследованиями [4, 5, 15, 31, 32].
Рисунок 2. Показатели соматического и гинекологического статуса родильниц на фоне лечения препаратом Сорбифер Дурулес (через 4 нед.)
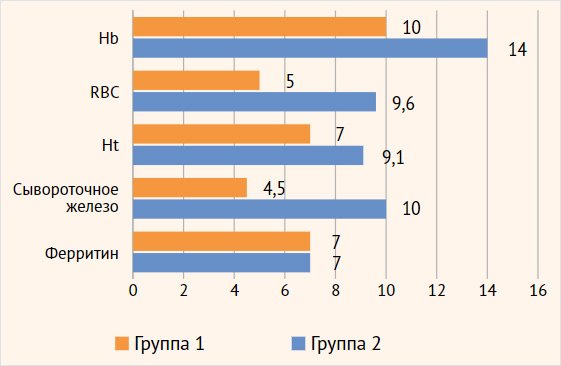
Все анализируемые показатели через 8 нед. терапии достигли нормативных значений, темпы прироста в обоих группах практически сравнялись (рис. 3).
Рисунок 3. Гематологические показатели на фоне лечения препаратом Сорбифер Дурулес (через 8 нед.), %
Заключение
Таким образом, в результате проведенного исследования было выявлено, что новая коронавирусная инфекция, перенесенная в период гестации, является отягощающим фактором течения ЖДА и увеличивает риск развития инфекционно-воспалительных осложнений в послеродовом периоде. Выявленные нарушения микробиоты влагалища у пациенток с анемией, позволяют говорить о неблагоприятном фоне для реализации инфекционных осложнений и поиска путей для своевременной адекватной коррекции диагностированных нарушений и дефицита железа [33–37]. Наиболее выраженные изменения и высокий процент послеродовых изменений имели место у родильниц с анемией, перенесших в период гестации COVID-19. Комбинированный антианемический препарат сульфата железа и аскорбиновой кислоты Сорбифер Дурулес продемонстрировал хорошие результаты по коррекции дефицита железа и соматического статуса через 4 нед. терапии. Нормализация всех имеющихся отклонений была достигнута через 8 нед. лечения. Высокая биодоступность комбинации сульфата железа и аскорбиновой кислоты в препарате Сорбифер Дурулес обеспечили высокий темп прироста гемоглобина и восстановления гематологических показателей [27–29], что делает эту комбинацию целесообразной к использованию в качестве препарата первого выбора для профилактики и лечения ЖДА как у беременных пациенток, так и у пациенток в послеродовом периоде.
2 Rehabilitation considerations during the COVID-19 outbreak, 2020. World Health Organization. Available at: https://www.who.int/docs/default-source/searo/ncd/rehabilitation-considerations-during-the-covid-19-outbreak.
Список литературы / References
- Тютюнник В.Л., Виноградова М.А., Кан Н.Е. Диагностика, профилактика и терапия железодефицитных состояний у беременных: взгляд акушерагинеколога и гематолога. Акушерство и гинекология. 2021;(3):10-16. Режим доступа: https://aig-journal.ru/articles/DIAGNOSTIKAPROFILAKTIKA-I-TERAPIYa-JELEZODEFICITNYH-SOSTOYaNII-UBEREMENNYH-VZGLYaD-AKUShERA-GINEKOLOGA-I-GEMATOLOGA.html.
- Якунина Н.А., Зайдиева З.С. Дефицит железа у беременных - проблема, не теряющая своей актуальности. Медицинский совет. 2012;(7):56-60. Режим доступа: https://cyberleninka.ru/article/n/defitsit-zheleza-uberemennyh-problema-ne-teryayuschaya-svoey-aktualnosti.
- Napolitano M., Dolce A., Celenza G., Grandone E., Perilli M.G., Siragusa S. et al. Iron-dependent erythropoiesis in women with excessive menstrual blood loss and women with normal menses. Ann Hematol. 2014;93(4):557-563. https://doi.org/https://www.doi.org/10.1007/s00277-013-1901-3.
- Громова О.А., Торшин И.Ю., Шаповалова Ю.О., Курцер М.А., Чучалин А.Г. COVID-19 и железодефицитная анемия: взаимосвязи патогенеза и терапии. Акушерство, гинекология и репродукция. 2020;14(5):644-655. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.179.
- Адамян Л. В., Азнаурова Я. Б., Филиппов О.С. COVID-19 и женское здоровье (обзор литературы). Проблемы репродукции. 2020;26(2):6-17. https://doi.org/10.17116/repro2020260216.
- Dashraath P., Wong J.L.J., Lim M.X.K., Lim L.M., Li S., Biswas A. et al. Coronavirus disease 2019 (COVID-19) pandemic and pregnancy. Am J Obstet Gynecol. 2020;222(6):521-531. https://doi.org/10.1016/j.ajog.2020.03.021.
- Poon L.C., Yang H., Dumont S., Lee J.C.S., Copel J.A., Danneels L. et al. ISUOG Interim Guidance on coronavirus disease 2019 (COVID-19) during pregnancy and puerperium: information for healthcare professionals - an update. Ultrasound Obstet Gynecol. 2020;55(6):848-862. https://doi.org/10.1002/uog.22061.
- Peng Z., Wang J., Mo Y., Duan W., Xiang G., Yi M. et al. Unlikely SARSCoV-2 vertical transmission from mother to child: a case report. J Infect Public Health. 2020;13(5):818-820. https://doi.org/10.1016/j.jiph.2020.04.004.
- Радзинский В.Е., Соловьёва А.В.,Федотов Н.Г. Анемизирующий синдром у современных женщин - нерешенная мировая проблема. Доктор.Ру. 2020;19(8):20-24. https://doi.org/10.31550/1727-2378-2020-19-8-20-24.
- Адамян Л.В., Артымук Н.В., Белокриницкая Т.Е., Гельфанд Б.Р., Куликов А.В., Кан Н.Е. и др. Септические осложнения в акушерстве: клинические рекомендации (протокол лечения). М.; 2017. 63 с. Режим доступа: https://isma.ivanovo.ru/attachments/20383
- Артымук Н.В., Белокриницкая Т.Е., Филиппов О.С., Марочко К.В. Особенности течения беременности, акушерская и терапевтическая тактика при новой коронавирусной инфекции COVID-19 у беременных. Акушерство и Гинекология. 2020;(12):6-13. https://doi.org/10.18565/aig.2020.12.6-13.
- Fraser I.S., Mansour D., Breymann C., Hoffman C., Mezzacasa A., Petraglia F. Prevalence of heavy menstrual bleeding and experiences of affected women in a European patient survey. Int J Gynaeco Obstet. 2015;128(3):196-200. Available at: https://pubmed.ncbi.nlm.nih.gov/25627706.
- Knol H.M., Mulder A.B., Bogchelman D.H., Kluin-Nelemans H.C., van der Zee A.G., Meijer K. The prevalence of underlying bleeding disorders in patients with heavy menstrual bleeding with and without gynecologic abnormalities. Am J Obstet Gynecol. 2013;209(3):202.e1-202.e7. https://doi.org/10.1016/j.ajog.2013.05.059.
- Есаян М.С., Гасанова Л.Г., Зайдиева З.С., Безуглова Е.С. Коррекция постковидной анемии у беременных с нарушением стоматологического статуса. Медицинский Совет. 2021;(13):144-150. https://doi.org/10.21518/2079-701X-2021-13-144-150.
- Артымук Н.В., Белокриницкая Т.Е. Дискуссионные вопросы рекомендаций по ведению беременных с COVID-19. Женское здоровье и репродукция. 2020;45(2). Режим доступа: https://whfordoctors.su/statyi/diskussionnyevoprosy-rekomendacij-po-vedeniju-beremennyh-s-covid-19.
- Breslin N., Baptiste C., Gyamfi-Bannerman C., Miller R., Martinez R., Bernstein K. et al. Coronavirus disease 19 infection among asymptomatic and symptomatic pregnant women: two weeks of confirmed presentations to an affiliated pair of New York City hospitals. Am J Obstet Gynecol MFM. 2020;2(2):100118. https://doi.org/10.1016/j.ajogmf.2020.100118.
- Pierce-Williams R.A.M., Burd J., Felder L., Khoury R., Bernstein P.S., Avila K. et al. Clinical course of severe and critical coronavirus disease 2019 in hospitalized pregnancies: a United States cohort study. Am J Obstet Gynecol MFM. 2020;2(3):100134. https://doi.org/10.1016/j.ajogmf.2020.100134.
- Kotlyar A., Grechukhina O., Chen A., Popkhadze S., Grimshaw A., Tal O. et al. Vertical transmission of COVID-19: a systematic review and meta-analysis. Am J Obstet Gynecol. 2021;224(1):35-53.e3. https://doi.org/10.1016/j.ajog.2020.07.049.
- Кравцова М. Железодефицитная анемия: аспекты лечения и профилактики в практике гинеколога. Акушерство и гинекология. 2019;3(17). Режим доступа: https://aig-journal.ru/articles/Jelezodeficitnaya-anemiyaaspekty-lecheniya-i-profilaktiki-v-praktike-ginekologa.html.
- Галимов А.И. Инфекционно-воспалительные осложнения после экстренного кесарева сечения и принципы их профилактики. Медицинский вестник Башкортостана. 2010;5(3):48-50. Режим доступа: https://cyberleninka.ru/article/n/infektsionno-vospalitelnye-oslozhneniyaposle-ekstrennogo-kesareva-secheniya-i-printsipy-ih-profilaktiki.
- Адамян Л.В., Филиппов О.С., Артымук Н.В., Белокринницкая Т.Е. Брусина Е.Б., Григорьев Е.В. и др. Гнойно-воспалительные заболевания и сепсис в акушерстве: клинические рекомендации (протокол лечения). М.; 2015. 35 с. Режим доступа: https://www.mrckb.ru/files/gnojnovospalitelnye-zabolevaniya-v-akusherstve.pdf.
- Brinkmann A., Röhr A.C., Köberer A., Fuchs T., Kruger W.A., König C. et al. Adequate anti-infective treatment: Importance of individual dosing and application. Anaesthesist. 2018;67(6):461-476. https://doi.org/10.1007/s00101-018-0443-4.
- Kaukonen K.-M., Bailey M., Pilcher D., Cooper D.J., Bellomo R. Systemic inflammatory response syndrome criteria indefining severe sepsis. N Engl J Med. 2015;372(17):1629-1638. https://doi.org/10.1056/NEJMoa1415236.
- Yang Z., Wang M., Zhu Z., Liu Y. Coronavirus disease 2019 (COVID-19) and pregnancy: a systematic review. J Matern Fetal Neonatal Med. 2022;35(8):1619-1622. https://doi.org/10.1080/14767058.2020.1759541.
- Chen D., Yang H., Cao Y., Cheng W., Duan T., Fan C. et al. Expert consensus for managing pregnant women and neonates born to mothers with suspected or confirmed novel coronavirus (COVID-19) infection. Int J Gynaecol Obstet. 2020;149(2):130-136. https://doi.org/10.1002/ijgo.13146.
- Nayak A.H., Kapote D.S., Fonseca M., Chavan N., Mayekar R., Sarmalkar M., Bawa A. Impact of the coronavirus infection in pregnancy: a preliminary study of 141 patients. J Obstet Gynaecol India. 2020;70(4):256-261. https://doi.org/10.1007/s13224-020-01335-3.
- Пескова Ю. От эффективной работы врачей первичного звена во многом зависит здоровье нации. Акушерство и гинекология. 2016;2(5). Режим доступа: https://aig-journal.ru/articles/Ot-effektivnoiraboty-vrachei-pervichnogo-zvena-vo-mnogom-zavisit-zdorove-nacii.html.
- Федорук А.В., Воробьев П.А., Некрасова Н.И., Доркина А.А. Анализ врачебной практики ведения больных железодефицитной анемией в различных возрастных группах. Клиническая геронтология. 2005;11(10):8-14. Fedoruk A.V., Vorob, ev P.A., Nekrasova N.I., Dorkina A.A. Review of medical practice on the management of patients with iron deficiency anemia in various age groups. Clinical Gerontology. 2005;11(10):8-14. (In Russ.)
- Кабасова К.К. Применение препарата Сорбифер Дурулес при лечении железодефицитной анемии. Вестник хирургии Казахстана. 2012;1(29):135. Режим доступа: https://cyberleninka.ru/article/n/primenenie-preparatasorbifer-durules-pri-lechenii-zhelezodefitsitnyh-anemiy.
- Ashraf M.A., Keshavarz P., Hosseinpour P., Erfani A., Roshanshad A., Pourdast A. et al. Coronavirus disease 2019 (COVID-19): a systematic review of pregnancy and the possibility of vertical transmission. J Reprod Infertil. 2020;21(3):157-168. Available at: https://pubmed.ncbi.nlm.nih.gov/32685412.
- Mascio D.D., Khalil A., Saccone G., Rizzo G., Buca D., Liberati M. et al. Outcome of coronavirus spectrum infections (SARS, MERS, COVID-19) during pregnancy: a systematic review and meta-analysis. Am J Obstet Gynecol. 2020;2(2):100107. https://doi.org/10.1016/j.ajogmf.2020.100107.
- Alzamora M.C., Paredes T., Caceres D., Webb C.M., Valdez L.M., La Rosa M. Severe COVID-19 during pregnancy and possible vertical transmission. Am J Perinatol. 2020;37(8):861-865. https://doi.org/10.1055/s-0040-1710050.
- Powers J.M., McCavit T.L., Buchanan G.R. Diagnosis and management of iron deficiency anemia: a survey of pediatric hematology/oncology specialists. Pediatr Blood Cancer. 2015;62(5):842-846. https://doi.org/10.1002/pbc.25433.
- Dong L., Tian J., He S., Zhu C., Wang J., Liu C., Yang J. Possible vertical transmission of SARS-CoV-2 from an infected mother to her newborn. JAMA. 2020;323(18):1846-1848. https://doi.org/10.1001/jama.2020.4621.
- Munro M.G., Critchley H.O.D., Fraser I.S., FIGO Menstrual Disorders Working Group. The FIGO classification of causes of abnormal uterine bleeding in the reproductive years. Fertil Steril. 2011;95(7):2204-2208. https://doi.org/10.1016/j.fertnstert.2011.03.079.
- Liu Y., Chen H., Tang K., Guo Y. Clinical manifestations and outcome of SARS-CoV-2 infection during pregnancy. J Infect. 2020;S0163- 4453(20)30109-2. https://doi.org/10.1016/j.jinf.2020.02.028.
- Juan J., Gil M.M., Rong Z., Zhang Y., Yang H., Poon L.C. Effect of coronavirus disease 2019 (COVID-19) on maternal, perinatal and neonatal outcome: systematic review. Ultrasound Obstet Gynecol. 2020;56(1):15-27. https://doi.org/10.1002/uog.22088.