Журнал "Медицинский совет" №12/2022
DOI: 10.21518/2079-701X-2022-16-12-86-94
И.Л. Никитина1, Л.Р. Саракаева1, В.Г. Баиров1, А.А. Сухоцкая1, А.П. Смородин1, Д.В. Рыжкова1, Л.Б. Митрофанова1, Е.А. Ефтич1, М.А. Меликян2, И.А. Кельмансон1
1 Национальный медицинский исследовательский центр имени В.А. Алмазова; 197341, Россия, Санкт-Петербург, ул. Аккуратова, д. 2
2 Национальный медицинский исследовательский центр эндокринологии; 117036, Россия, Москва, ул. Дмитрия Ульянова, д. 11
Введение. Врожденный гиперинсулинизм — редкая группа генетических заболеваний, характеризующихся аберрантной гиперсекрецией инсулина с развитием персистирующей гипогликемии у детей раннего возраста, которая обусловливает риск формирования тяжелых неврологических исходов.
Цель. Оценить психомоторное развитие и некоторые нейрофизиологические параметры детей, пролеченных по поводу врожденного гиперинсулинизма.
Материалы и методы. В обсервационное ретроспективное исследование были включены 73 ребенка с врожденным гиперинсулинизмом, которые получали стационарное лечение в НМИЦ имени В.А. Алмазова с использованием современного протокола оказания помощи при данной патологии в период с 2017 по 2021 гг. Была проведена оценка состояния психомоторного развития больных с использованием методики «Ages and Stages» и анализ нейрофизиологических параметров при проведении электроэнцефалографического исследования.
Результаты и обсуждение. Показатели психомоторного развития в целом у 69% обследованных детей через 6 и более месяцев после проведенного лечения соответствовали возрасту. Была выявлена статистически значимая ассоциация достижения нормальных показателей психомоторного развития с фокальной формой заболевания. Показатели коммуникативных навыков, мелкой и грубой моторики, а также навыка решения задач у детей с фокальной формой гиперинсулинизма оказались статистически значимо лучше, чем при диффузной форме заболевания. Возраст манифестации и верификации, минимальный уровень гликемии и максимальный уровень углеводной нагрузки достоверно не повлияли на формирование как отдельных навыков (за исключением грубой моторики), так и психомоторного развития в целом. Путем построения кривых Каплана-Мейера было установлено, что альфа-ритм формируется достоверно раньше у пациентов с фокальной формой и при верификации диагноза в более раннем возрасте, а именно в периоде новорожденности.
Заключение. Наибольшим модифицирующим влиянием на положительный исход показателей психомоторного развития обладает фокальная форма заболевания. Адекватные возрасту показатели грубой моторики фиксировались чаще в группе детей, имевших низкую скорость утилизации глюкозы. Была установлена ассоциация раннего появления альфа-ритма с фокальной формой врожденного гиперинсулинизма, а также с ранней верификацией заболевания.
Для цитирования: Никитина И.Л., Саракаева Л.Р., Баиров В.Г., Сухоцкая А.A., Смородин А.П., Рыжкова Д.В., Митрофанова Л.Б., Ефтич Е.А., Меликян М.А., Кельмансон И.А. Психомоторное развитие и нейрофизиологические параметры у детей в исходе терапии врожденного гиперинсулинизма. Медицинский Совет. 2022;(12):86-94. https://doi.org/10.21518/2079-701X-2022-16-12-86-94
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Neurodevelopmental outcomes and neurophysiological parameters in children with congenital hyperinsulinism
Irina L. Nikitina1, Leyla R. Sarakaeva1, Vladimir G. Bairov1, Anna A. Sukhotskaya1, Andrey P. Smorodin1, Daria V. Ryzhkova1, Lubov B. Mitrofanova1, Egine A. Eftich1, Maria A. Melikyan2, Igor A. Kelmanson1
1 Almazov National Medical Research Center; 2, Akkuratova St., St Petersburg, 197341, Russia
2 National Medical Research Center for Endocrinology; 11, Dmitry Ulyanov St., Moscow, 117036, Russia
Introduction. Congenital hyperinsulinism is a rare group of genetic disorders resulting in persistent hypoglycemia which can lead to delay of neurodevelopment.
Aim. To assess psychomotor development and certain neurophysiological parameters of children treated for congenital hyperinsulinism.
Materials and methods. This prospective and retrospective cohort study included 73 infants with congenital hyperinsulinism admitted to the National Almazov Research Centre from 2017 to 2021. All subjects underwent standard clinical examination including physical and neurological assessment as well as 18F-DOPA PET/CT, genetic testing, electroencephalography. Developmental screening was performed using “Ages and Stages” questionnaire in 33 subjects. Possible risk factors for neurodevelopmental sequelae due to hypoglycemia were analyzed.
Results and discussion. Normal neurodevelopment in general was observed in 23 subjects (69%), 10 patients had developmental delay. Focal form of CHI had the greatest modifying effect on positive neurodevelopmental outcome in general. Individual skills such as communication, fine and gross motor, problem solving in children with a focal form of CHI were significantly better than those with a nonfocal forms. Age of manifestation and verification of the disease, the minimum level of glycemia and the maximum level of glucose utilization did not significantly affect the formation of either individual skills (with the exception of gross motor skills) or psychomotor development in general. The indicators of gross motor skills in children with a lower level of glucose utilization turned out to be significantly better. Kaplan-Meier survival analysis showed that the alpha rhythm appearance was significantly earlier in patients with a focal form of CHI and with earlier verification of the diagnosis (<28 days of life).
Conclusion. The focal form of the disease has the greatest modifying effect on the positive outcome of the psychomotor development. The age-appropriate gross motor skills were observed more often in the group of children with low glucose disposal rates. The association of the early occurrence of the alpha rhythm with the focal form of congenital hyperinsulinism, as well as with the early verification of the disease, was found
For citation: Nikitina I.L., Sarakaeva L.R., Bairov V.G., Sukhotskaya A.A., Smorodin A.P., Ryzhkova D.V., Mitrofanova L.B., Eftich E.A., Melikyan M.A., Kelmanson I.A. Neurodevelopmental outcomes and neurophysiological parameters in children with congenital hyperinsulinism. Meditsinskiy sovet = Medical Council. 2022;(12):86-94. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-12-86-94
Conflict of interest: the authors declare no conflict of interest.
Введение
Врожденный гиперинсулинизм (ВГИ) — врожденное заболевание, в основе которого лежит нерегулируемая автономная гиперпродукция инсулина, которая приводит к тяжелым гипогликемиям и органическому необратимому повреждению головного мозга. Гипогликемия при врожденном гиперинсулинизме обусловлена неадекватной инсулина бета-клетками поджелудочной железы, чаще всего генетически детерминированной и приводящей к высокой скорости утилизации глюкозы в периферических тканях, стимуляции гликогеногенеза, подавлению гликогенолиза и глюконеогенеза. Тяжесть последствий гипогликемии при врожденном гиперинсулинизме усугубляется ингибированием липолиза и кетогенеза в условиях высокой концентрации инсулина, лишая, таким образом, центральную нервную систему (ЦНС) альтернативных источников энергии, что может привести к необратимым инвалидизирующим неврологическим последствиям [1, 2]. При несвоевременном оказании помощи дети с данным заболеванием могут погибнуть в раннем возрасте или иметь тяжелое необратимое повреждение головного мозга с утратой интеллекта, что согласно данным медицинской литературы до недавнего времени имело место у большинства детей с данным заболеванием [3–9]. В отличие от опухолевого гиперинсулинизма (инсулиномы), при ВГИ очаг секреции инсулина невозможно визуализировать обычными методами. Единственным способом диагностики этого заболевания является радиоизотопная технология ПЭТ-КТ с радиофармацевтическим препаратом [18F]фтор-L-дигидроксифенилаланин (18F-ДОФА), который по характеру распределения радиофармацевтического препарата позволяет выполнять дифференциальную диагностику очаговой и диффузной форм врожденного гиперинсулинизма, а также определить локализации аденоматозного очага при фокальной форме. Для эффективного хирургического лечения необходимо иметь информацию о границах между пораженной и здоровой тканью, в связи с чем в соответствии с международным протоколом необходимо проведение многократной интраоперационной биопсии до получения информации о неповрежденной ткани.
Начало XXI в. ознаменовалось разработкой и внедрением в клиническую практику современного протокола ведения пациентов с ВГИ, включающего вышеописанные диагностические и терапевтические этапы. Внедрение данного протокола в процессы оказания помощи детям с ВГИ в ряде стран мира позволило значительно повысить качество диагностики, персонифицировать терапию и, таким образом, значимо повлиять на исходы заболевания в долгосрочной перспективе, что в особенности затронуло пациентов с фокальной формой заболевания, для которых стало возможным полное выздоровление [10, 11].
Колоссальные успехи, достигнутые в отношении диагностических и терапевтических возможностей ведения пациентов с ВГИ, привели к значимому сокращению неблагоприятных неврологических исходов заболевания, тем не менее по результатам публикаций последних лет, посвященных изучению психомоторного развития пациентов с ВГИ, проблема нейрокогнитивного статуса данной категории пациентов по-прежнему остается актуальной [10, 11]. Поиск наиболее значимых факторов, ассоциированных как с самим заболеванием (морфологическая форма – фокальная, диффузная либо атипичная), так и с факторами, имеющими отношение к организации оказания медицинской помощи (возраст манифестации, верификации заболевания, возраст старта терапии, сочетание с др. коморбидностями, минимальные значения гликемии и т.д.), а также изучение особенностей реагирования центральной нервной системы на эпизоды гипогликемии являются очень важными и в перспективе способны определить протективные факторы в отношении наиболее благоприятного исхода заболевания с точки зрения неврологических последствий.
Оказание помощи при ВГИ является многокомпонентным процессом и зависит от множества факторов: медицинских, организационных, медико-социальных. По данным мультинационального исследования (Дания, Россия, Украина), проведенного в 2017 г., выявлено, что пациенты, получившие медицинскую помощь за пределами стран Скандинавии, демонстрировали значимо худшие показатели психомоторного развития. Более половины включенных в исследование детей из России имели тяжелые неврологические последствия ВГИ, что было обусловлено более длительным путем до экспертного центра [12]. В исследовании, проведенном группой ученых из Германии, были получены схожие данные: одним из факторов риска формирования неблагоприятных неврологических исходов у детей с ВГИ являлся факт рождения за границей, что также определяло более длительный путь до экспертного центра [13].
С 2017 г. все этапы современного международного протокола оказания помощи при ВГИ были организованы и начали выполняться в Российской Федерации на базе двух национальных центров: Национального медицинского исследовательского центра имени В.А. Алмазова (НМИЦ имени В.А. Алмазова) и Национального медицинского исследовательского центра эндокринологии (НМИЦ эндокринологии). Организация четкой маршрутизации пациентов с ВГИ самого раннего возраста в лечебно-диагностические подразделения экспертного уровня, преемственность диагностических и лечебных этапов, постоянное сопровождение опытным в данной области медицинским персоналом существенно сократили время пребывания в состоянии гипогликемии, ускорили принятие тактических решений в выборе метода терапии, что значительно увеличило количество благоприятных исходов с точки зрения достижения метаболического контроля. Однако остается открытым вопрос о влиянии данных изменений на неврологические исходы: на улучшение прогноза психомоторного развития (ПМР) и формирование нейрофизиологической активности мозга в соответствии с возрастными физиологическими нормативами. Эти факторы легли в основу проведенного исследования.
Целью настоящего исследования является оценка ПМР и некоторых нейрофизиологических параметров российской когорты детей, пролеченных по поводу ВГИ в течение последних 4 лет с использованием современного протокола. В соответствии с поставленной целью была проведена оценка показателей ПМР детей в исходе лечения, оценены нейрофизиологические характеристики головного мозга пациентов с ВГИ путем углубленного анализа электроэнцефалограммы (ЭЭГ), выполнен поиск предикторов благоприятных исходов функциональных характеристик ЦНС.
Пациенты и методы
В обсервационное ретроспективное проспективное исследование было включено 73 пациента из разных регионов России и стран ближнего зарубежья с верифицированным диагнозом ВГИ, получивших стационарное лечение в НМИЦ имени В.А. Алмазова в соответствии с современным протоколом в период с 2017 по 2021 гг. [14]. Дети последовательно маршрутизировались по соответствующим подразделениям клиники НМИЦ имени В.А. Алмазова. Критерии включения в исследование: наличие подтвержденного диагноза ВГИ, обследование и лечение по современному международному протоколу, согласие пациента и законного представителя на участие в исследовании. Обследование проводилось на двух стационарных визитах: первый визит включал первую госпитализацию в Центр экспертного уровня, где проводилась диагностика ВГИ с проведением ПЭТ-КТ с 18F-ДОФА, генетическое обследование методом NGS с использованием таргетной по ВГИ панели генов с последующим секвенированием по Сенгеру в случае выявления варианта, расцененного как вероятно патогенного (на базе НМИЦ имени В.А. Алмазова и НМИЦ эндокринологии). По результатам обследования определялась тактика ведения пациента. При фокальной форме заболевания проводилось хирургическое лечение. При диффузной форме проводилась медикаментозная терапия (октреотид, диазоксид, глюкагон), при фармакорезистентных формах пациент также направлялся на оперативное лечение. Второй визит проводился при госпитализации через 6 мес. и более после проведенного лечения, где осуществлялась оценка общеклинического и метаболического статуса пациента, психомоторного развития и нейрофизиологических параметров путем проведения ЭЭГ.
Характеристика выборки пациентов с ВГИ, включенных в исследование:
- распределение по полу: девочки – 59%, мальчики – 41%;
- распределение по форме заболевания: фокальная форма – 35%, диффузная форма – 49%, атипичная форма (при значении панкреатического индекса 1,3–1,5 и гистологическом подтверждении) – 16%.
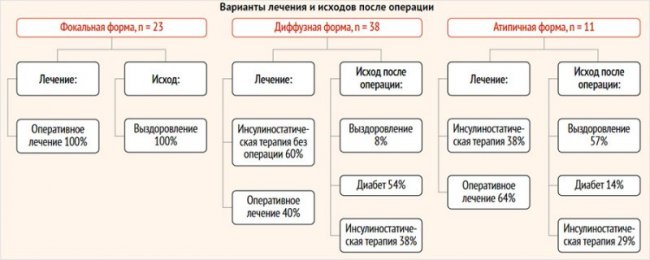
Медиана возраста детей, включенных в исследование, составила 10 [1–58] мес. Молекулярно-генетическое исследование было проведено 55 пациентам из 73 (75%). Патогенные варианты в генах калиевых каналов были обнаружены у 50 пациентов (91%), из них 44 пациента имели патогенный вариант в гене ABCC8 и 6 пациентов в гене KCNJ11. Варианты в гене GLUD1 были обнаружены у 1 пациента, в гене HNF1A – у 2 пациентов и в гене GCK – у 2 пациентов. Все пациенты с фокальной формой получили хирургическое лечение, в исходе которого у всех детей (100%) имело место выздоровление от ВГИ. Пациенты с нефокальной формой ВГИ (диффузной и атипичной) при наличии чувствительности к инсулиностатическим препаратам получали консервативную терапию. В случае фармакорезистентной нефокальной формы пациенты получали оперативное лечение, объем операции определялся по результатам интраоперационной биопсии. Консервативное лечение проводилось у 60% пациентов с диффузной формой заболевания и у 36% пациентов с атипичной формой. Оперативное лечение получили 40% пациентов с диффузной формой и 64% пациента с атипичной формой.
Оценка исходов проводилась на 2-м визите по результатам общеклинического обследования с обязательной антропометрией, оценкой соматического статуса, а также с оценкой состояния углеводного обмена на фоне проводимого лечения. Углеводный обмен оценивался путем многократного мониторинга гликемии во время госпитализации. Уровень глюкозы плазмы оценивали глюкозооксидазным методом при помощи набора реагентов GLUCL для анализатора Abbott Architect с8000 (референсный интервал – 3,89–5,5 ммоль/л).
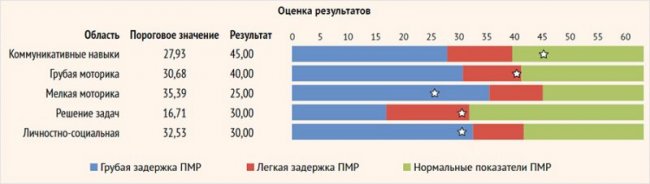
Оценка ПМР проводилась с использованием валидизированной методики «Ages and Stages» через 6 мес. и более после лечения [15]. Содержание методики: оценка показателей ПМР складывалась из дискретной оценки пяти сфер развития: коммуникативных навыков, грубой и мелкой моторики, решения задач и социальных навыков. С использованием оценочной шкалы проводилась стандартизированная оценка пяти сфер психомоторного развития. Для каждого теста, соответствующего определенному возрасту, имелась градация суммы набранных баллов по каждой сфере ПМР: «белая зона» – нормальные показатели ПМР, «серая зона» – умеренная задержка ПМР, «черная зона» – грубая задержка ПМР (рис. 1).
Рисунок 1. Ключ к валидизированной методике «Ages and Stages»
Соответствием ПМР ребенка его возрастной группе считалось наличие как минимум 3 сфер ПМР в «белой зоне» с условием, что показатели по остальным сферам укладывались в «серую зону». В ходе исследования показатели психомоторного развития по методике «Ages and Stages» были оценены у 33 детей с ВГИ, получивших лечение по международному протоколу, через 6 и более мес. после того или иного метода лечения.
Оценка нейрофизиологических характеристик пациентов с ВГИ проводилась методом ЭЭГ, которая выполнялась на энцефалографе «NICOLET ONE» (CareFusion (Viasys), USA) в стационарной комплектации в соответствии со стандартизированным протоколом проведения процедуры. Было обследовано 73 пациента. Описание результатов ЭЭГ выполнялось по существующему стандарту [16]. В качестве оцениваемых параметров исследовались возраст возникновения альфа-ритма и наличие пароксизмальной активности. Полученные показатели состояния центральной нервной системы детей с ВГИ были затем сопоставлены с факторами, которые были выбраны как вероятно имеющие отношение к исходу заболевания: форма заболевания, возраст дебюта гипогликемии и верификации диагноза, минимальный уровень гликемии и максимальная углеводная нагрузка за период наблюдения.
Статистический анализ полученных данных был выполнен с помощью программного обеспечения Jamovi 2.2.4. с применением стандартной описательной и аналитической статистики. Аналитические статистические методы включали в себя изучение ассоциации между отдельными клиническими формами заболевания, сформированностью отдельных навыков ПМР и фактом задержки ПМР в целом. Сравнение качественных признаков оценивалось с помощью критерия хи-квадрат. С учетом проведенных множественных сопоставлений по изучению отдельных аспектов ПМР была осуществлена поправка выявленных различий на возможную ошибку, связанную с повторными тестированиями (false discovery rate correction). Бинарный логистический регрессионный анализ использовался для выявления факторов, повлиявших на риск нарушения формирования отдельных навыков ПМР ребенка и задержки ПМР в целом. Для оценки влияния отдельных клинических характеристик на сроки начала формирования альфа-ритма на ЭЭГ детей использовался метод Каплана-Мейера. Различия были признаны статистически значимыми при вероятности ошибки менее 5% (p < 0,05) [17].
Результаты
Среди пациентов с ВГИ, включенных в исследование, 32% (23 чел.) пациентов имели фокальную форму заболевания, диффузная форма была обнаружена у 53% (39 чел.) больных, атипичная – у 15% (11 чел.). Медиана возраста детей, включенных в исследование, составила 10 [1–58] мес. Все пациенты с фокальной формой получили хирургическое лечение, в исходе которого у 100% имело место выздоровление, что было констатировано по данным гликемического контроля. Консервативное лечение проводилось у 60% пациентов с диффузной формой заболевания и у 36% пациентов с атипичной формой. Оперативное лечение получили 40% пациентов с диффузной формой и 64% пациентов с атипичной формой. Среди пациентов с диффузной формой, получивших оперативное лечение, 8% больных в исходе имели выздоровление, 54% – сахарный диабет, 38% – рецидив заболевания и возобновление инсулиностатической терапии. В исходе 57% детей с атипичной формой заболевания, получивших оперативное лечение, имели выздоровление, 14% – диабет, 29% – возобновление инсулиностатической терапии (рис. 2).
Рисунок 2. Распределение пациентов по формам и результатам лечения
Важным этапом исследования являлась оценка ПМР детей через 6 и более мес. после проведенного лечения. При оценке ПМР в целом было установлено, что 69% (23 чел.) обследованных детей не имели задержки ПМР, при этом результаты обследования 31% (10 чел.) детей оказались ниже возрастных нормативов. При анализе исхода ПМР в целом в зависимости от факторов, связанных с заболеванием, были получены данные о статистически достоверной ассоциации нормальных показателей ПМР с формой заболевания, а именно с фокальной формой ВГИ (χ2 = 15,57, p = 0,01), а также с ранней верификацией заболевания (до 28 суток жизни) (у 90% детей – нормальное ПМР при верификации заболевания до 28 суток жизни, χ2 = 4,31, р = 0,04). Так, среди детей с ВГИ, пролеченных по поводу фокальной формы, ни у одного ребенка не было выявлено задержки ПМР, в то время как при диффузной форме количество детей с задержкой ПМР составило 80%, а с атипичной формой – 20% в соответствующих группах. При этом на показатели ПМР в целом достоверно не повлияли возраст дебюта заболевания, минимальный уровень гликемии и максимальная углеводная нагрузка (табл. 1).
Таблица 1. Ассоциация исхода психомоторного развития в целом с факторами, связанными с характеристикой заболевания
Атипичная (%, чел.) | 20 (2/10) | 30 (6/23) | 15,57 | 2 | <0,01 |
Диффузная (%, чел.) | 80 (8/10) | 10 (3/23) | |||
Фокальная (%, чел.) | 0 (0/10) | 6 (14/23) | |||
Скорость утилизации глюкозы >10мг/кг/мин (%, чел.) | 50 (5/10) | 55 (12/2 | 0,01 | 1 | 0,91 |
Минимально зафиксированный уровень гликемии <1 ммоль/л, (%, чел.) | 60 (6/10) | 40 ( 10/23) | 0,76 | 1 | 0,38 |
Манифестация до 7 суток жизни, (%, чел.) | 80 ( 8/10) | 80 (18/23) | 0,01 | 1 | 0,91 |
Верификация до 28 суток жизни, (%, чел.) | 50 (5/10) | 90 (19/23) | 4,31 | 1 | 0,04 |
χ2 — сравнение проведено с использованием критерия хи-квадрат; df — число степеней свободы; р — уровень достоверности различий
В связи с выявленной зависимостью исхода ПМР от формы заболевания было проанализировано влияние формы ВГИ на формирование отдельных сфер ПМР: коммуникативных навыков, грубой и мелкой моторики, решения задач и социальных навыков. Было установлено, что наличие фокальной формы заболевания достоверно было ассоциировано с благоприятным исходом в отношении формирования коммуникативных навыков (р = 0,03), грубой и мелкой моторики (р = 0,01 и р = 0,04 соответственно), решения задач (р = 0,02), однако достоверных различий в формировании социальных навыков в зависимости от формы не было обнаружено (р = 0,51) (табл. 2).
Таблица 2. Ассоциация сформированности отдельных сфер психомоторного развития с формой заболевания
Атипичная форма ВГИ (n = 8) | Диффузная форма ВГИ (n = 11) | Фокальная форма ВГИ (n = 14) | χ2 | df | р | |
Коммуникативные навыки (%, чел.) | 80 ( 6/8) | 50 (5/11) | 90 (13/14) | 7,01 | 2 | 0,03 |
Грубая моторика (%, чел.) | 90 (7/8) | 30 (3/11) | 80 (11/14) | 9,60 | 2 | 0,01 |
Мелкая моторика (%, чел.) | 50 ( 4/8) | 50 (6/11) | 90 (13/14) | 6,22 | 2 | 0,04 |
Решение задач (%, чел.) | 80 (6/8) | 50 (6/11) | 100 ( 14/14) | 7,71 | 2 | 0,02 |
Социальные навыки (%, чел.) | 40 ( 3/8) | 60 (7/11) | 60 (8/14) | 1,34 | 2 | 0,51 |
χ2 — сравнение проведено с использованием критерия хи-квадрат; df — число степеней свободы; р — уровень достоверности различий
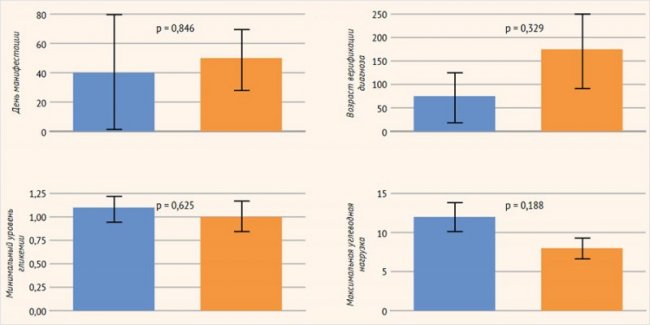
Методом бинарного логарифмического регрессионного анализа изучалось влияние следующих факторов, связанных с заболеванием, на сформированность отдельных сфер ПМР: форма заболевания, возраст дебюта заболевания, возраст верификации диагноза, минимальный уровень гликемии, максимальная углеводная нагрузка. В отношении формирования грубой моторики были получены статистически достоверные данные: потребность в меньшей углеводной нагрузке была ассоциирована с лучшими показателями грубой моторики (р = 0,026) (рис. 3). При этом модифицирующее влияние других факторов заболевания (день манифестации, возраст верификации диагноза, минимальный уровень гликемии, максимальная углеводная нагрузка) на формирование коммуникативных навыков, мелкой моторики, решения задач, социальных навыков не было выявлено (рис. 4).
Рисунок 3. Оценка модифицирующего влияния факторов, имеющих отношение к заболеванию, на сформированность сферы грубой моторики (метод бинарного логарифмического регрессионного анализа)
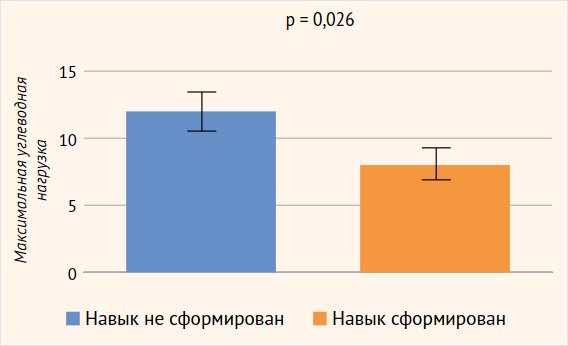
Рисунок 4. Оценка модифицирующего влияния факторов, имеющих отношение к заболеванию, на сформированность отдельных навыков (метод бинарного логарифмического регрессионного анализа)
Известно, что гипогликемия может стать причиной формирования органического поражения ЦНС, что может проявляться задержкой ПМР и особенностями нейрофизиологических характеристик пациентов с ВГИ. ПМР отражает степень соответствия развития ребенка его возрастным параметрам. Для более объективной оценки возрастной и физиологической зрелости ЦНС целесообразна не только оценка показателей ПМР, но и нейрофизиологических параметров. С точки зрения формирования прогноза пациентов с ВГИ представляло интерес проведение углубленного анализа ЭЭГ. На данном этапе исследования изучались некоторые нейрофизиологические параметры: наличие пароксизмальной активности и сроки формирования альфа-ритма. У 21 пациента с ВГИ была зафиксирована пароксизмальная активность (29% обследованных). При анализе распределения наличия пароксизмальной активности при различных формах заболевания было установлено, что у пациентов с диффузной формой пароксизмальная активность была зарегистрирована в 33% случаев, с фокальной – в 22% и при атипичной форме – в 27% случаев. При этом достоверной ассоциации появления пароксизмальной активности в зависимости от формы заболевания и других обозначенных выше факторов, связанных с заболеванием, получено не было (р > 0,05).
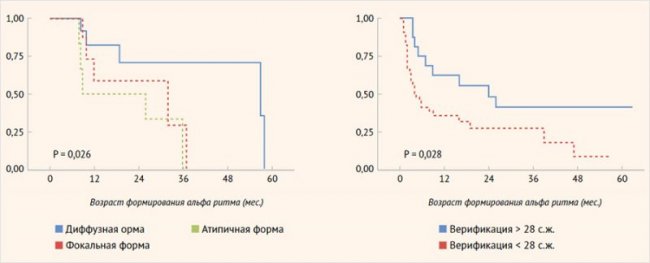
Иные результаты были получены при анализе сроков формирования альфа-ритма. У пациентов с фокальной формой возраст возникновения альфа-ритма был более ранним, а следовательно, более физиологичным по сравнению с пациентами с нефокальными формами ВГИ. Была выявлена прогностическая значимость фокальной формы ВГИ в отношении формирования альфа-ритма (р = 0,026). Кроме того, была установлена ассоциация возраста верификации диагноза с формированием альфа-ритма: чем раньше был установлен диагноз, тем раньше формировался альфа-ритм (р = 0,028) (рис. 5).
Рисунок 5. Прогнозирование формирования отдельных нейрофизиологических параметров по электроэнцефалографии в зависимости от факторов, связанных с заболеванием (метод Каплана-Майера)
Обсуждение
Результаты исследований, направленных на изучение неврологических последствий ВГИ у детей, претерпевают значимую эволюцию в зависимости от изменений возможностей диагностики и терапии. Так, результаты исследований, проведенных в начале XXI в., свидетельствовали о широкой распространенности неблагоприятных неврологических исходов заболевания, в то время как результаты последних лет указывают на значимое улучшение состояния ЦНС у детей с ВГИ в результате лечения по современному протоколу.
По данным проведенного в 2003 г. исследования группы ученых из Германии задержка ПМР отмечалась в 44% случаев, при этом у 18% пациентов имела место грубая задержка ПМР [18]. По данным длительного наблюдения, осуществленного в 2001 г., за 90 пациентами с ВГИ командой врачей F. Manny et al. (США) в 26% случаев отмечалась задержка ПМР или тяжелая умственная отсталость, эпилепсия – в 18% случаев. Неонатальное начало было основным фактором риска развития тяжелой умственной отсталости или эпилепсии. Пациенты, получавшие медикаментозное лечение, пострадали менее серьезно, чем пациенты, получавшие хирургическое лечение, не было никакой разницы в показателях ПМР у детей с диффузной и очаговой формами гиперинсулинизма [19]. Группа ученых из России и Дании в 2017 г. представила результаты длительного наблюдения за 75 пациентами с ВГИ. Нарушения в развитии нервной системы наблюдались у 35 пациентов (47%). Неблагоприятный исход развития нервной системы был связан с низким уровнем глюкозы (менее 1 ммоль/л) и задержкой старта терапии от дня манифестации до госпитализации в экспертный центр (>5 дней). Не было выявлено ассоциаций между ранним и поздним началом заболевания, мутациями калиевых каналов, тяжестью заболевания, очаговым и диффузным заболеванием или возрастом при последующем наблюдении [20]. В более позднем исследовании, проведенном группой ученых из Финляндии в 2021 г., число пациентов с когнитивным дефицитом сократилось до 21%. Обращает на себя внимание тот факт, что с течением времени отмечается гораздо большее число благоприятных исходов [21].
В проведенном нами исследовании когорты пациентов, пролеченных в течение последних 4 лет с использованием современного протокола оказания помощи при ВГИ, были получены данные о соответствии уровня развития физиологическому у 69% больных (2/3 пациентов). Было сделано заключение о том, что наибольшим модифицирующим влиянием на положительный исход ПМР обладает форма заболевания (фокальная форма), которая была ассоциирована с наибольшим количеством детей с отсутствием задержки ПМР в целом и с соответствующим возрасту (физиологическим) развитием 4 из 5 отдельных сфер ПМР. Следует уточнить, что в когорте все дети, имевшие фокальную форму, в исходе оперативного лечения имели выздоровление, т. е. стойкую нормогликемию. Кроме того, была установлена ассоциация между сферой грубой моторики и максимальным уровнем углеводной нагрузки в процессе лечения на диагностическом этапе: чем меньше была потребность в глюкозе, тем больше была вероятность формирования данного навыка в физиологические возрастные сроки.
В отношении нейрофизиологических параметров пациентов с ВГИ также была установлена ассоциация более раннего появления альфа-ритма с фокальной формой ВГИ, а также с ранней (в периоде новорожденности) верификацией заболевания. Таким образом, среди изученных нами факторов, которые обозначены как имеющие отношение к болезни, именно факт фокальной формы, хирургическое лечение которой привело к полному выздоровлению пациентов, оказался наиболее значимым в отношении прогноза сохранения физиологического развития и формирования возрастной электрической активности мозга. Полученные результаты подтверждают высокую значимость применения современных протоколов диагностики и лечения ВГИ, позволяющих в максимально ранние сроки определить форму заболевания, а в случае фокальной формы – провести оперативное лечение, а также свидетельствуют о необходимости совершенствования терапевтических подходов в отношении нефокальных форм данной патологии.
Заключение
Таким образом, среди изученных нами факторов, которые обозначены как имеющие отношение к болезни, именно факт фокальной формы, хирургическое лечение которой привело к полному выздоровлению пациентов, оказался наиболее значимым в отношении прогноза сохранения физиологического развития и формирования возрастной электрической активности мозга. Полученные результаты подтверждают высокую значимость применения современных протоколов диагностики и лечения ВГИ, позволяющих в максимально ранние сроки определить форму заболевания, а в случае фокальной формы – провести оперативное лечение, а также свидетельствуют о необходимости совершенствования терапевтических подходов в отношении нефокальных форм данной патологии.
Список литературы / References
- Guemes M., Rahman S.A., Kapoor R.R., Flanagan S., Houghton J.A.L., Misra S. et al. Hyperinsulinemic hypoglycemia in children and adolescents: Recent advances in understanding of pathophysiology and management. Rev Endocr Metab Disord. 2020;21(4):577-597. https://doi.org/10.1007/s11154-020-09548-7.
- Rasmussen A.G., Melikian M., Globa E., Detlefsen S., Rasmussen L., Petersen H. et al. The difficult management of persistent, non-focal congenital hyperinsu-linism: A retrospective review from a single, tertiary center. Pediatr Diabetes. 2020;21(3):441-455. https://doi.org/10.1111/pedi.12989.
- Rother K.I., Matsumoto J.M., Rasmussen N.H., Schwenk W.F. Subtotal pancreatectomy for hypoglycemia due to congenital hyperinsulinism: long-term follow-up of neurodevelopmental and pancreatic function. Pediatr Diabetes. 2001;2(3):115-122. https://doi.org/10.1034/j.1399-5448.2001.002003115.x.
- Dacou-Voutetakis C., Psychou F., Maniati-Christidis M. Persistent hyperinsulin-emic hypoglycemia of infancy: long-term results. J Pediatr Endocrinol Metab. 1998;11 Suppl 1:131-141. https://doi.org/10.1515/JPEM.1998.11.S1.131.
- Mazor-Aronovitch K., Gillis D., Lobel D., Hirsch H.J., Pinhas-Hamiel O., Modan-Moses D. et al. Long-term neurodevelopmental outcome in conservatively treated congenital hyperinsulinism. Eur J Endocrinol. 2007;157(3):491-497. https://doi.org/10.1530/EJE-07-0445.
- Sun H.-S., Feng Z.-P., Miki T., Seino S., French R.J. Enhanced neuronal damage after ischemic insults in mice lacking Kir6.2-containing ATP-sensitive K+ channels. J Neurophysiol. 2006;95(4):2590-2601. https://doi.org/10.1152/jn.00970.2005.
- Warren R.E., Frier B.M. Hypoglycaemia and cognitive function. Diabetes Obes Metab. 2005;7(5):493-503. https://doi.org/10.1111/j.1463-1326.2004.00421.x.
- Ludwig A., Ziegenhorn K., Empting S., Meissner T., Marquard J., Holl R. et al. Glucose metabolism and neurological outcome in congenital hyperinsu-linism. Semin Pediatr Surg. 2011;20(1):45-49. https://doi.org/10.1053/j.sempedsurg.2010.10.005.
- Lord K., Radcliffe J., Gallagher P.R., Adzick N.S., Stanley C.A., De Leon D.D. High Risk of Diabetes and Neurobehavioral Deficits in Individuals With Surgically Treated Hyperinsulinism. J Clin Endocrinol Metab. 2015;100(11):4133-4139. https://doi.org/10.1210/jc.2015-2539.
- Shield J.P. Fluorine-18 L-3,4-dihydroxyphenylalanine positron emission tomography: improving surgery and outcome in focal hyperinsulinism. Commentary to Mohnike et al.: Proposal for a standardized protocol for F-DOPA-PET (PET/CT) in congenital hyperinsulinism. Horm Res. 2006;66(1):43-44. https://doi.org/10.1159/000093472.
- Giri D., Hawton K., Senniappan S. Congenital hyperinsulinism: recent updates on molecular mechanisms, diagnosis and management. J Pediatr Endocrinol Metab. 2021;35(3):279-296. https://doi.org/10.1515/jpem-2021-0369.
- Helleskov A., Melikyan M., Globa E., Shcherderkina I., Poertner F., Larsen A.M. et al. Both Low Blood Glucose and Insufficient Treatment Confer Risk of Neurodevelopmental Impairment in Congenital Hyperinsulinism: A Multinational Cohort Study. Front Endocrinol (Lausanne). 2017;8:156. https://doi.org/10.3389/fendo.2017.00156.
- Roeper M., Salimi Dafsari R., Hoermann H., Mayatepek E., Kummer S., Meissner T. Risk Factors for Adverse Neurodevelopment in Transient or Persistent Congenital Hyperinsulinism. Front Endocrinol (Lausanne). 2020;11:580642. https://doi.org/10.3389/fendo.2020.580642.
- Петеркова В.А., Безлепкина О.Б., Меликян М.А., Губаева Д.Н., Болмасова А.В., Петряйкина Е.Е. и др. Диагностика и лечение врожденного гиперинсулиниз-ма у детей: Клинические рекомендации. М.; 2021. 57 с. Режим доступа: https://rae-org.ru/system/files/documents/pdf/klinreki_vgi_final_1.pdf.
- Najimidinova G., Faromuzova K. Care for Development in Three Central Asian Countries Report of a Process Evaluation in Tajikistan, Kyrgyz Republic, and Kazakhstan. UNICEF; 2011. 36 p. Available at: https://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.434.850&rep=rep1&type=pdf.
- Beniczky S., Hirsch LJ., Kaplan P.W., Pressler R., Bauer G., Aurlien H., Br0gger J.C., Trinka E. Unified EEG terminology and criteria for nonconvulsive status epilepticus. Epilepsia. 2013;54(Suppl_6):28-29. https://doi.org/10.1111/epi.12270.
- Navarro D.J., Foxcroft D.R. Learning statistics with jamovi: a tutorial for psychology students and other beginners. Version 0.75. 2022. 519 p. https://doi.org/10.24384/hgc3-7p15.
- Meissner T., Wendel U., Burgard P., Schaetzle S., Mayatepek E. Long-term follow-up of 114 patients with congenital hyperinsulinism. Eur J Endocrinol. 2003;149(1):43-51. https://doi.org/10.1530/eje.0.1490043.
- 19. Menni F., de Lonlay P, Sevin C., Touati G., Peigne C., Barbier V. et al. Neurologic Outcomes of 90 Neonates and Infants with Persistent Hyperinsulinemic Hypoglycemia. Pediatrics. 2001;107(3):476-479. https://doi.org/10.1542/peds.107.3.476.
- Mannisto J.M.E., Jaaskelainen J., Otonkoski T., Huopio H. Long-Term Outcome and Treatment in Persistent and Transient Congenital Hyperinsulinism: A Finnish Population-Based Study. J Clin Endocrinol Metab. 2021;106(4):e1542-e1551. https://doi.org/10.1210/clinem/dgab024.