Журнал "Медицинский совет" №19/2022
DOI: 10.21518/2079-701X-2022-16-19-9-20
Н.Е. Верисокина1,2*, Л.Я. Климов1, И.Н. Захарова3, А.Л. Заплатников3, В.В. Зубков4, А.А. Момотова1, В.А. Курьянинова1,5, Р.А. Атанесян1, Т.В. Железнякова2, М.А. Петросян1,2, Д.В. Бобрышев1, Д.А. Волков1, З.А. Магомадова1
1 Ставропольский государственный медицинский университет; 355017, Россия, Ставрополь, ул. Мира, д. 310
2 Ставропольский краевой клинический перинатальный центр; 355041, Россия, Ставрополь, ул. Ломоносова, 44
3 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
4 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова; 117997, Россия, Москва, ул. Академика Опарина, д. 4
5 Международный медицинский центр «СОГАЗ»; 191186, Россия, Санкт-Петербург, ул. Малая Конюшенная, д. 8
Введение. Витаминно-дефицитные состояния определяются у 50–80% беременных. Дефицит витамина D опасен значительным увеличением риска возникновения осложнений во время беременности, родов, а также влиянием на состояние ребенка.
Цель. Провести анализ взаимосвязи статуса витамина D и уровня провоспалительных цитокинов (ИЛ-1β, ИЛ-6) у детей, родившихся от матерей с эндокринной патологией.
Материалы и методы. Проведено клинико-антропометрическое и лабораторное обследование 218 новорожденных детей: 98 (45,0%) младенцев от матерей с ожирением, 32 (14,7%) – с гестационным сахарным диабетом на фоне ожирения, 22 (10,1%) – с гестационным сахарным диабетом, 31 (14,2%) – с сахарным диабетом I типа и 35 (16,0%) младенцев от женщин, не имевших ожирения и признаков нарушения толерантности к глюкозе.
Результаты. У новорожденных от матерей с ожирением, гестационным сахарным диабетом и сахарным диабетом I типа чаще регистрируется тяжелый дефицит кальцидиола, чем у детей, рожденных от матерей без эндокринной патологии. Новорожденные от матерей с ожирением, имели концентрацию ИЛ-1β в сыворотке крови в 2,6 раза больше, чем дети из группы контроля – 14,6 (4,7; 36,5) и 5,6 (1,5; 13,8) пг/мл соответственно (р = 0,04), новорожденные от женщин с гестационным сахарным диабетом на фоне ожирения – в 2,8 раза – 15,7 (6,5; 54,3) пг/мл (р = 0,02), с гестационным сахарным диабетом – в 4,5 раза – 25,4 (5,0; 40,5) пг/мл (р = 0,035), с сахарным диабетом I типа – в 6,1 раза – 34,3 (3,8; 61,3) пг/мл (р = 0,01). Новорожденные от матерей с сахарным диабетом I типа имели более высокий показатель ИЛ-6 в сыворотке крови в сравнении с группой контроля – 48,2 (21,3; 75,6) и 20,2 (5,1; 53,2) пг/мл (р = 0,006).
Заключение. Избыточная масса тела и нарушения толерантности к глюкозе у матери негативно влияют на обеспеченность витамином D, а в условиях его дефицита у плода провоцируют избыточную продукцию провоспалительных цитокинов у новорожденных.
Для цитирования: Верисокина Н.Е., Климов Л.Я., Захарова И.Н., Заплатников А.Л., Зубков В.В., Момотова А.А., Курьянинова В.А., Атанесян Р.А., Железнякова Т.В., Петросян М.А., Бобрышев Д.В., Волков Д.А., Магомадова З.А. Обеспеченность витамином D и уровень провоспалительных цитокинов у новорожденных от матерей с эндокринными заболеваниями. Медицинский Совет. 2022;(19):9-20. https://doi.org/10.21518/2079-701X-2022-16-19-9-20.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Vitamin D status and levels of pro-inflammatory cytokines in newborns born to mothers with endocrine diseases
Natalia E. Verisokina1,2*,Leonid Ya. Klimov1, Irina N. Zakharova3, Andrey L. Zaplatnikov3, Viktor V. Zubkov4, Alena A. Momotova1, Victoriya A. Kuryaninova1,5, Roza A. Atanesyan1, Tatiana V. Zhelezniakova2, Meline A. Petrosyan1,2, Dmitry V. Bobryshev1, Dmitriy A. Volkov1, Zalina A. Magomadova1
1 Stavropol State Medical University; 310, Mir St., Stavropol, 355017, Russia
2 Regional Clinical Perinatal Center; 44, Lomonosov St., Stavropol, 355041, Russia
3 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
4 Kulakov National Medical Research Center of Obstetrics, Gynecology and Perinatology; 4, Academician Oparin St., Moscow, 117997, Russia
5 SOGAZ International Medical Center; 8, M. Konyushennaya St., St Petersburg, 191186, Russia
Aim. To analyse the relationships between vitamin D status and levels of pro-inflammatory cytokines (IL-1β, IL-6) in children born to mothers with endocrine pathology.
Materials and methods. Clinical-anthropometric and laboratory examination included 218 newborns: 98 (45.0%) infants of obese mothers, 32 (14.7%) infants of gestational diabetic mothers with underlying obesity, 22 (10.1%) infants of gestational diabetic mothers, 31 (14.2%) infants of mothers with type I diabetes mellitus and 35 (16.0%) infants of mothers without obesity and signs of impaired glucose tolerance.
Results. Severe calcidiol deficiency is more often recorded in infants born to mothers with obesity, gestational diabetes mellitus and type I diabetes mellitus than in infants born to mothers without endocrine pathology. Serum IL-1β level was 2.6 times higher in newborns born to mothers with obesity than in the newborns from the control group — 14.6 (4.7; 36.5) and 5.6 (1.5; 13. 8) pg/ml, respectively (p = 0.04), 2.8 times higher in those born to women with gestational diabetes mellitus with underlying obesity —15.7 (6.5; 54.3) pg/ml (p = 0.02), 4.5 times higher in those born to mothers with gestational diabetes — 25.4 (5.0; 40.5) pg/ml (p = 0.035), and 6.1 times higher in those born to mothers with type I diabetes — 34.3 (3.8; 61.3) pg/ml (p = 0.01). Newborns born to mothers with type 1 diabetes mellitus had a higher serum IL-6 level as compared to the control group — 48.2 (21.3; 75.6) and 20.2 (5.1; 53.2) pg/ml (p = 0.006).
Conclusion. Overweight and impaired glucose tolerance in the mother negatively affect the vitamin D sufficiency status, and if a fetus experiences vitamin D deficiency, provoke excessive production of pro-inflammatory cytokines in newborns.
For citation: Verisokina N.E., Klimov L.Y., Zakharova I.N., Zaplatnikov A.L., Zubkov V.V., Momotova A.A., Kuryaninova V.A., Atanesyan R.A., Zhelezniakova T.V., Petrosyan M.A., Bobryshev D.V., Volkov D.A., Magomadova Z.A. Vitamin D status and levels of pro-inflammatory cytokines in newborns born to mothers with endocrine diseases. Meditsinskiy sovet = Medical Council. 2022;(19):9-20. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-19-9-20.
Conflict of interest: the authors declare no conflict of interest.
Введение
Неуклонное расширение границ репродуктивного возраста у женщин, наблюдаемое в масштабах человечества, является одним из значимых вызовов, с которым в течение последних десятилетий столкнулась перинатальная медицина во всем мире. Состояние здоровья определяется большим количеством факторов, при этом если у женщин в возрасте до 30 лет есть время на профилактику и лечение ряда заболеваний в прегравидарном периоде, то у женщин, принявших решение становиться матерью в четвертом, а иногда и в пятом десятилетии жизни, этого времени уже нет. Закономерно, что бремя эндокринной патологии в буквальном и переносном смысле увеличивается у женщин с годами, при этом тяжелое и отягощенное течение беременности на фоне эндокринопатии является крайне вероятным, а зачастую неизбежным сценарием, а новорожденный попадает в группу риска по многим параметрам, среди которых не только родовой травматизм, но и метаболические сдвиги, затрудняющие адаптацию к внеутробной жизни [1].
Ожирение является одной из важнейших медико-социальных проблем мирового масштаба и имеет тенденцию к прогрессивному росту. По данным Росстата за 2018 г., среди взрослого населения Российской Федерации ожирением страдает каждый 5-й, причем 60% из них – женщины [2, 3].
За последние 10 лет ожирение беременных в популяции достигло 15–38%. В первую очередь это связано с особенностями обменных процессов, иммунологической и гормональной перестройкой женского организма во время беременности. Почти вдвое чаще ожирение встречается у повторнородящих, но у большинства женщин ожирение формируется за 2–5 лет и более до наступления беременности [4, 5]. Частота встречаемости ожирения во время беременности в Российской Федерации составляет 12,3–38,0% [6].
Жировая ткань, как показывают результаты проведенных исследований, является своеобразным эндокринным органом, продуцирующим активные молекулы – адипокины, влияющие на чувство голода, метаболические процессы, репродуктивную функцию, формирование оксидативного стресса и нарушений функции сердечно-сосудистой системы [7]. Кроме того, в адипоцитах имеются рецепторы к витамину D, которые определяют взаимосвязь между уровнем кальцидиола и количеством жира в организме [8].
Витамин D, как и другие стероидные гормоны, синтезируется из холестерола. Ретикулоциты, мышечная ткань, а также жировая ткань для кальцитриола являются депо и обеспечивают поддержание необходимого уровня активных форм в течение 2–3 мес. [9, 10]. Наличие депо в жировой ткани свидетельствует о том, что ожирение может способствовать увеличению его депонирования, снижению образования витамина D и ускоренному разрушению в адипоцитах, что ведет к уменьшению концентрации кальцидиола в сыворотке крови. Это сопровождается не только снижением эффектов витамина D, но и оказывает непосредственное влияние на количество жировой ткани или, как показывают результаты исследований, может препятствовать снижению массы тела [11, 12]. В больших когортных исследованиях выяснено, что одна «лишняя» единица ИМТ способна снижать уровень 25(ОН)D на 1,15% [13]. Дефицит витамина D чаще всего отмечался при показателе индекса массы ≥40 кг/м2 [14].
Концентрация 25(OH)D в пуповинной крови плода зависит от концентрации витамина в крови матери за счет передачи кальцидиола плоду от матери с момента формирования плаценты и до срока родов, но уровень 1,25(OH)2D у плода в норме немного ниже, чем в сыворотке крови матери [15, 16].
Тесная взаимосвязь между беременной и плодом приводит к тому, что недостаточность витамина D в организме матери во время беременности создает дефицитное состояние у ребенка [17]. Кальцитриол способствует секреции инсулина и оказывает положительное влияние на липидный профиль, уровень глюкозы и С-пептида. Доказано, что при дефиците 25(ОН)D в плаценте снижается активность VDR-рецепторов, что приводит к преждевременному неконтролируемому апоптозу клеток плаценты, развитию плацентарной недостаточности и как следствие задержки роста плода и низкой оценке по шкале Апгар у новорожденных [18, 19].
Сразу после рождения дефицит витамина D не только нарушает формирование скелета плода, но и имеет определенное влияние на восприимчивость ребенка к болезням, также в более позднем возрасте [20].
S. Sureshchandra et al. изучили молекулярные механизмы влияния прегравидарного ожирения на уровень циркулирующих цитокинов, хемокинов, адипокинов и факторов роста, а также риск развития гестационного сахарного диабета, преэклампсии, артериальной гипертензии и отслойки плаценты [21].
Установлено, что прегравидарное ожирение характеризуется инсулинорезистентностью, высоким уровнем циркулирующих маркеров воспаления, снижением числа CD4+ Т-клеток, увеличением количества CD4+ Т-клеток памяти и сдвигом в сторону продукции Th2 цитокинов. Закономерно, что страдающие ожирением женщины имеют лабораторные признаки хронического субклинического асептического воспаления [21, 22].
При ожирении системное воспаление возникает за счет нефизиологического накопления триглицеридов в адипоцитах. Триглицериды в адипоцитах содержатся в виде крупной вакуоли, поэтому они способны нарушать функцию органелл, в частности, эндоплазматической сети. Происходит синтез белков с нарушенной конформацией и биологической активностью, что способствует развитию апоптоза клетки и формированию биологической реакции воспаления. На начальных этапах воспалительных процессов продуцируются провоспалительные цитокины ФНО-α, ИЛ-1β, ИЛ-6 [23]. Кроме того, висцеральная жировая ткань способна экспрессировать гены, кодирующие синтез биологически активных веществ, таких как цитокины, ростовые факторы и компоненты комплемента [24].
Активация системного воспаления у беременных женщин с ожирением приводит к нарушению антенатального развития плода, осложнениям адаптации новорожденного в неонатальном периоде и может влиять на постнатальное развитие ребенка и подростка [25]. У детей от матерей с ожирением отмечается более высокая масса тела и плаценты при рождении, повышение уровня инсулина, глюкозы, лептина, ИЛ-6 и С-реактивного белка в пуповинной крови [26].
В экспериментах на животных показано, что ожирение у матери индуцирует воспаление и инсулинорезистентность в мышцах плода в поздние сроки гестации. В условиях ожирения у матери в фетальных мышцах в 2 раза выше экспрессия TLR-4, повышено содержание ФНО-α, что служит подтверждением активации провоспалительных процессов [27].
S.K. Abell et al. предложили модель патогенеза формирования инсулинорезистентности (ИР), воспаления и эндотелиальной дисфункции при ожирении, беременности и гестационном сахарном диабете (рис. 1) [28].
Рисунок 1. Патогенез инсулинорезистентности, воспаления и эндотелиальной функции при ожирении, беременности и ГСД [29]
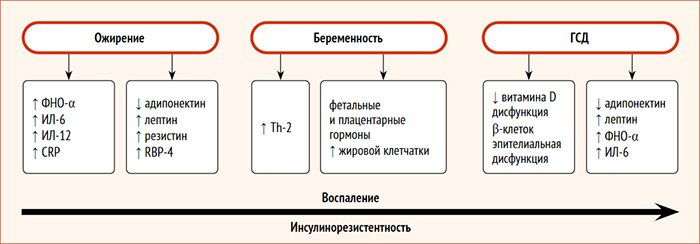
Ожирение характеризуется ИР, в формировании которой важную роль играет снижение уровня адипонектина и повышение содержания лептина и резистина [30]. Также важную роль в формировании ИР вследствие нарушения чувствительности клеток периферических тканей к метаболическим эффектам инсулина играет системное воспаление [31].
По данным международных исследований, около 17% всех беременностей осложняется гестационным сахарным диабетом (ГСД), при этом наблюдается неуклонная тенденция к росту заболеваемости [32, 33]. В России, по данным Государственного регистра сахарного диабета, распространенность ГСД составляет 8–9% [34]. Частота ГСД у лиц с ожирением и избыточным весом в 2–3 раза выше по сравнению с женщинами с нормальным весом [35].
D. Boriboonhirunsarn et al. считают, что избыточная прибавка массы тела (более 7 кг) именно во II триместре гестации является фактором риска развития ГСД [36, 37]. Предрасполагающим к развитию ГСД фактором является увеличение индекса массы тела (ИМТ) именно в I триместре беременности. Согласно исследованиям, беременные с ИМТ >23,5 кг/м2 в I триместре находились в группе высокого риска развития ГСД. Сочетание индекса массы тела >38,2 кг/м2 и окружности живота >91,5 см в 13 раз увеличивает риск развития ГСД [22, 38].
Ожирение и беременность являются лептинорезистентными состояниями. Лептин – белковый гормон, регулирующий обмен веществ во всем организме, поэтому он играет важную роль в патофизиологии ГСД [39, 40]. Концентрация лептина в сыворотке прямо пропорциональна массе жировой ткани. Увеличение концентрации лептина вследствие ожирения подавляет секрецию инсулина β-клетками поджелудочной железы, что способствует развитию ГСД [41]. В свою очередь, увеличение синтеза лептина при ГСД усиливает процессы воспаления за счет стимуляции синтеза провоспалительных цитокинов (IL-6 и TNF-α), что дополнительно повышает продукцию лептина [42].
Адипонектин – гормон, который может секретироваться как белой жировой тканью, так и плацентой. Адипонектин обладает противовоспалительным, инсулиносенсибилизирующим и антиатерогенным эффектами, также он активирует поглощение глюкозы скелетными мышцами и снижает выработку глюкозы в печени. Его уровень прогрессивно снижается при беременности, но еще большему снижению способствует ожирение, что и может приводить к гестационному сахарному диабету у беременных с избыточной массой тела [43].
Гипергликемия матери, а также изменения в фетоплацентарном комплексе могут вызывать нарушение коллагенообразования в сосудистом и стромальном компонентах тимуса плода. Изменение коллагенообразования, незрелость эпителиального компонента, цитокинпродуцирующей активности вилочковой железы, снижение гормон-продуцирующей функции тимуса и гипоинсулинемия приводят к нарушению созревания, пролиферации и дифференцировки Т-лимфоцитов [44]. Патологические процессы в тимусе, вызванные гипергликемией, могут приводить к снижению показателей иммунитета в раннем периоде адаптации новорожденных. Так, у детей от матерей с сахарным диабетом I типа и ГСД обнаружено достоверное снижение процентного содержания Т- и В-лимфоцитов [45].
Повышение количества NK-клеток и продукции ИЛ-8 активированными макрофагами у новорожденных от женщин с ГСД является основными защитными факторами, компенсирующими снижение функциональной активности клеточного звена иммунной системы [46].
Цель – провести анализ взаимосвязи статуса витамина D и уровня провоспалительных цитокинов (ИЛ-1β, ИЛ-6) у детей, родившихся от матерей с эндокринной патологией (ожирением, ГСД, СД I типа, ГСД на фоне ожирения).
Материалы и методы
Проведено клинико-антропометрическое и лабораторное обследование 218 новорожденных детей, рожденных с января 2017 г. по апрель 2019 г. в ГБУЗ СК «Ставропольский краевой клинический перинатальный центр»: 98 (45,0%) младенцев от матерей с ожирением, 32 (14,7%) – с ГСД на фоне ожирения, 22 (10,1%) – с ГСД, 31 (14,2%) – с СД I типа. В группу контроля вошли 35 (16,0%) младенцев от женщин, не имевших ожирения до наступления беременности и клинико-лабораторных признаков нарушения толерантности к глюкозе в периоде гестации.
Забор крови у всех новорожденных осуществлялся из центральной вены на 3-и сут. жизни. Определение содержания 25(ОН)D в сыворотке крови у детей проводилось методом иммуноферментного анализа (ELISA) с использованием тест-систем производства Euroimmunn (Германия).
Оценка полученных результатов уровня витамина D осуществлялась согласно критериям, отраженным в Национальной программе «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции» (2021) [47].
Концентрация ИЛ-1β и ИЛ-6 в образцах сыворотки крови новорожденных детей определялась методом ИФА с использованием тест-систем производства ЗАО «Вектор-Бест» (Россия). Для оценки уровня ИЛ-1β, ИЛ-6 общепринятых норм нет.
Ожирение у матерей диагностировали до наступления беременности по ИМТ более 30 кг/м2 [48].
Критериями ГСД считались уровни глюкозы во время беременности в плазме венозной крови натощак от 5,1 до 7,0 ммоль/л, через 60 мин. в ходе перорального глюкозотолерантного теста – 10 ммоль/л и более, а через 120 мин – 8,5 ммоль/л и более [49].
Анализ и статистическая обработка полученных результатов проводились с использованием программ AtteStat STATISTICA 10.0. В сравниваемых группах определяли среднее арифметическое (М), ошибку средней арифметической величины (m), минимум и максимум, медиану (Ме), а также 25-й и 75-й квартили (Q1; Q3). Межгрупповые различия выявляли по U-критерию Манна – Уитни, критерий Пирсона (χ2) с поправками для малых выборок. Различия считались достоверными при р ≤ 0,05.
Результаты
Средний возраст матерей с ожирением составил 32,3 ± 0,6 года, с ГСД – 31,9 ± 1,2 лет, с ГСД на фоне ожирения – 34,0 ± 0,9 года, с сахарным диабетом I типа – 29,2 ± 0,9 года, в группе сравнения – 28,3 ± 0,7 лет.
Среди пациенток с ожирением 28 (28,6%) были первородящими, 70 (71,4%) – повторнородящими; более половины женщин с ГСД на фоне ожирения составили повторнородящие – 26 (81,3%); 9 (40,9%) женщин с ГСД имели первые роды, повторные – 13 (59,1%); в группе матерей с СД I типа первые роды были у 13 (41,9%), повторные – 18 (58,1%) женщин. В контрольной группе первые роды зарегистрированы у 13 (37,1%), повторные – у 22 (62,9%) женщин.
Способ родоразрешения в большинстве случаев являлся оперативным: в группе женщин с ожирением – 70 (71,4%), в группе ГСД на фоне ожирения – 23 (71,9%), ГСД – 10 (45,5%), СД I типа – 25 (80,6%). В группе сравнения путем операции кесарева сечения родились 20 (57,1%) новорожденных.
В ходе анализа была выявлена высокая частота экстрагенитальной патологии у матерей, имевших эндокринную патологию (табл. 1).
Таблица 1. Структура экстрагенитальной патологии среди женщин с эндокринной патологией
| Экстрагенитальные заболевания | Количество наблюдений, абс. (%) | ||||
| Контроль,n = 35 | ОЖ,n = 98 | ОЖ + ГСД,n = 32 | ГСД, n = 22 | СД I типа, n = 31 | |
| Сердечно-сосудистая система,в т. ч. артериальная гипертензия | 3 (8,6%)- | 40 (40,8%)25 (25,5%) | 14 (43,7%)10 (31,3%) | 4 (18,2%)1 (4,5%) | 5 (16,1%)3 (9,7%) |
| Мочевыделительная система | 2 (5,7%) | 15 (15,3%) | 4 (12,5%) | 3 (13,6%) | 10 (32,2%) |
| Щитовидная железа | 2 (5,7%) | 19 (19,3%) | 4 (12,5%) | 4 (18,2%) | 8 (25,8%) |
| Другие | 12 (34,3%) | 34 (34,7%) | 7 (21,9%) | 9 (40,9%) | 13(41,9%) |
По полученным нами данным практически у каждой беременной женщины диагностируется экстрагенитальная патология. У женщин с ожирением и ГСД на фоне ожирения во время беременности в 40,8 и 43,7% случаев встречалась патология сердечно-сосудистой системы. Беременные с ГСД и СД I типа в 40,9 и 41,9% случаев имели другие заболевания (патологию нервной системы, желудочно-кишечного тракта, хронические заболевания дыхательных путей и т. д.). 32,2% женщин из группы СД I типа имели патологию мочевыделительной системы. В большинстве случаев течение хронических заболеваний ухудшается и в дальнейшем прогрессирует именно во время беременности.
По данным ВОЗ, последние годы отмечается рост частоты возникновения экстрагенитальной патологии у беременных на 28,3%. Связано это с тем, что за последние 5 лет отмечается увеличение общей заболеваемости взрослого населения. Следует отметить, что у 14–32% беременных женщин, экстрагенитальная патология является причиной осложнения течения беременности и родов [50].
Данные о гинекологической, акушерской патологии и патологии, возникшей во время беременности у матерей, представлены в табл. 2.
Таблица 2. Патология беременности у женщин с эндокринной патологией
| Патология беременности | Количество наблюдений, абс. (%) | ||||
| Контроль, n = 35 | ОЖ, n = 98 | ОЖ + ГСД, n = 32 | ГСД, n = 22 | СД I типа, n = 31 | |
| Инфекция | 6 (17,1%) | 18 (18,4%) | 4 (12,5%) | 6 (27,3%) | 5 (16,1%) |
| Преэклампсия | - | 17 (17,3%) | 2 (6,3%) | 1 (4,5%) | 5 (16,1%) |
| Анемия | 17 (48,6%) | 45 (45,9%) | 17 (53,1%) | 5 (22,7%) | 14 (45,1%) |
| Угроза прерывания и преждевременные роды | 17 (48,6%) | 34 (34,7%) | 11 (34,3%) | 8 (36,4%) | 10 (32,2%) |
| Плацентарная недостаточность | 8 (22,8%) | 37 (37,8%) | 11 (34,3%) | 8 (36,4%) | 9 (29,0%) |
| Многоводие | 5 (14,3%) | 24 (24,5%) | 12 (37,5%) | 3 (13,6%) | 12 (38,7%) |
| Токсикоз | 6 (17,1%) | 14 (14,3%) | 7 (21,9%) | 2 (9,0%) | 5 (16,1%) |
Следует отметить, что внутриутробное развитие детей от матерей с ожирением, ожирением на фоне ГСД, СД I типа чаще всего протекало на фоне анемии. Среди беременных с ГСД отмечается высокая частота угрозы прерывания беременности и плацентарной недостаточности.
Следует отметить, что эндотелиальная дисфункция при данных патологиях является одним из патогенетических механизмов, что подтверждается наличием плацентарной недостаточности в исследуемых группах. Гипергликемия, возникающая в данном случае, приводит к повышению продукции провоспалительных цитокинов, которые в свою очередь нарушают формирование системы «мать – плацента – плод» [51].
В группе новорожденных от матерей с ожирением доношенными родились 84 (85,7%), недоношенными – 14 (14,3%) детей; в группе ГСД на фоне ожирения – доношенными были 29 (90,6%) младенцев, а недоношенными – 3 (9,4%) ребенка; у матерей с ГСД доношенными родились 19 (86,4%), недоношенными – 3 (13,6%) детей; от матерей с CД I типа в срок появились на свет 23 (74,2%) младенца, раньше срока – 8 (25,8%). В группе сравнения все новорожденные дети родились в срок.
Основные клинико-антропометрические показатели детей, включенных в исследование, представлены в табл. 3.
Таблица 3. Клинико-антропометрическая характеристика новорожденных от матерей с эндокринной патологией
| Показатель при рождении | Количество наблюдений | ||||
| Контроль, n = 35 | ОЖ, n = 98 | ОЖ + ГСД, n = 32 | ГСД, n = 22 | СД I типа, n = 31 | |
| Me (Q1; Q3) | Me (Q1; Q3) | Me (Q1; Q3) | Me (Q1; Q3) | Me (Q1; Q3) | |
| Масса тела, г | 3400 (3090; 3600) | 3560 (3070; 3980) | 3800* (3485; 4215) | 3540 (3090; 4050) | 3700 [3080; 3950] |
| Длина тела, см | 52,0 (51,0; 53,0) | 52,0 (50,0; 54,0) | 54,0* (51,5; 55,0) | 52,5 (50,0; 54,0) | 52,0 (50,0; 54,0) |
| Окружность головы, см | 35,0 (35,0; 36,0) | 36,0 (35,0; 37,0) | 36,5* (36,0; 37,0) | 35,5 (35,0; 36,0) | 36,0 (35,0; 37,0) |
| ОША 1, баллы | 8,0 (7,0; 8,0) | 7,0* (7,0; 8,0) | 7,0 (7,0; 8,0) | 7,0 (7,0; 8,0) | 7,0* (7,0; 8,0) |
| ОША 5, баллы | 9,0 (8,0; 9,0) | 8,0* (8,0; 9,0) | 8,5 (8,0; 9,0) | 8,0 (8,0; 9,0) | 8,0* (8,0; 9,0) |
| Срок гестации, нед. | 39,0 (38,0; 40,0) | 38,0* (37,0; 39,0) | 38,0 (37,0; 39,0) | 38,5* (38,0; 39,0) | 38,0 (36,0; 39,0) |
| Примечание: * р < 0,05 при сравнении показателя с группой контроля. | |||||
Анализируя данные табл. 3, можно констатировать, что дети от матерей с ожирением в сравнении с детьми из контрольной группы имели статистически значимо меньший срок гестации (р = 0,0001), ниже были и показатели ОША на 1-й (р = 0,03) и 5-й (р = 0,02) мин. жизни.
В группе детей от матерей с ГСД на фоне ожирения масса при рождении, рост и окружность головы были статистически значимо выше, чем в контрольной группе (р = 0,002, р = 0,01 и р = 0,001 соответственно).
У новорожденных от матерей с ГСД гестационный возраст при рождении был меньше (р = 0,02), чем у детей контрольной группы.
Статистически значимо ниже, чем в контрольной группе была ОША на 1-й (р = 0,05) и 5-й (р = 0,04) мин. жизни у детей от матерей с СД I типа, показатели массы тела при рождении и окружности головы были больше, чем в контрольной группе, но статистически значимых отличий получено не было.
На рисунке 2 представлены данные о структуре обеспеченности витамином D детей контрольной группы и новорожденных исследуемой группы при различных заболеваниях матерей.
Рисунок 2. Уровень 25(ОН)D в сыворотке крови новорожденных исследуемых групп
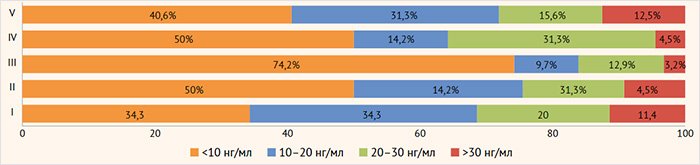
I – контроль, II – дети от матерей с ожирением, III – дети от матерей с СД I типа, IV – дети от матерей с ГСД, V – дети от матерей с ГСД на фоне ожирения
У новорожденных от матерей с ожирением, ГСД и СД I типа более чем в 50% случаев регистрируется тяжелый дефицит кальцидиола (менее 10 нг/мл), в то время как у детей, рожденных от матерей без эндокринной патологии, лишь в 34,3% случаев.
В группе детей от матерей с ожирением оптимальную концентрацию кальцидиола (более 30 нг/мл) в сыворотке крови имели 9,2% детей, с ГСД на фоне ожирения – 12,5%, с ГСД – 4,5%, с СД I типа –3,2% (рис. 2).
Показатель витамина D в сыворотке крови новорожденных, матери которых имели эндокринную патологию и получали поливитамины на протяжении беременности, выше в 1,7 раза в сравнении с детьми от матерей, не принимавших витаминно-минеральный комплекс (ВМК) (р = 0,001) (рис. 3).
Рисунок 3. Медиана 25(ОН)D новорожденных детей от матерей с эндокринопатиями в зависимости от приема витаминно-минерального комплекса во время беременности

Прием ВМК беременными женщинами позволяет повысить статистически значимо концентрацию кальцидиола в сыворотке крови новорожденных, но, к сожалению, не обеспечивает его оптимальной концентрации.
В табл. 4 приведены лабораторные данные младенцев от матерей с эндокринной патологией.
Таблица 4. Лабораторные показатели детей от женщин с эндокринной патологией
| Лабораторные показатели | Количество наблюдений | ||||
| Контроль, n = 35 | ОЖ, n = 98 | ОЖ + ГСД, n = 32 | ГСД, n = 22 | СД I типа, n = 31 | |
| Me (Q; Q) | Me (Q; Q) | Me (Q; Q) | Me (Q; Q) | Me (Q; Q) | |
| 25(OH)D, нг/мл | 14,5(8,3; 21,7) | 10,3*(4,5; 19,4) | 12,9(6,3; 20,6) | 12,2(5,2; 21,9) | 6,5*(4,0; 9,3) |
| ИЛ-1β, пг/мл | 5,6(1,5; 13,8) | 14,6* (4,7; 36,5) | 15,7* (6,5; 54,3) | 25,4* (5,0; 40,5) | 34,3* (3,8; 61,3) |
| ИЛ-6, пг/мл | 20,2(5,1; 53,2) | 40,6(5,3; 89,6) | 55,0(17,8; 90,1) | 59,8(5,2; 103,2) | 48,2*(21,3; 75,6) |
Примечание: * р < 0,05 при сравнении показателя с группой контроля. | |||||
В группе детей от матерей с ожирением и СД I типа концентрация 25(ОН)D оказалась ниже в 1,4 и 2,2 раза в сравнении с показателем контрольной группы (р = 0,05 и р = 0,001 соответственно). Медиана уровня витамина D у детей от матерей с ГСД на фоне ожирения и ГСД практически не отличалась, но была ниже, чем в группе сравнения, статистически значимых отличий получено не было.
Дети, рожденные от матерей с ожирением, имели концентрацию ИЛ-1β в сыворотке крови в 2,6 раза больше, чем дети из группы контроля (р = 0,04), новорожденные от женщин с ГСД на фоне ожирения – в 2,8 раза (р = 0,02), с ГСД – в 4,5 раза (р = 0,035), с СД I типа – в 6,1 раза (р = 0,01).
Новорожденные от матерей с СД I типа имели статистически значимо более высокий показатель ИЛ-6 в сыворотке крови в сравнении с группой контроля (р = 0,006). Медиана уровня ИЛ-6 у детей от матерей с ожирением, ГСД на фоне ожирения и ГСД была выше, чем в контрольной группе, но статистически значимых отличий получено не было.
В группе детей от матерей с ГСД между уровнем 25(ОН)D и ИЛ-6 выявлена отрицательная связь (r = -0,45, р = 0,03). Данный факт подтверждает данные о влиянии витамина D на уровень провоспалительных цитокинов.
В ходе исследования был проведен анализ концентрации витамина D и провоспалительных цитокинов в сыворотке крови новорожденных в исследуемых группах (табл. 5).
В группе детей, рожденных от матерей с ожирением, которые имели тяжелый дефицит витамина D, уровень ИЛ-1β статистически значимо выше, чем у детей из этой же группы с оптимальным содержанием кальцидиола (p = 0,02)
В группе детей от матерей с ГСД на фоне ожирения, которые имели содержание 25(ОН)D в сыворотке крови менее 10 нг/мл (дефицит), уровень ИЛ-6 выше, чем у детей из этой же группы с недостаточным уровнем витамина D (p = 0,026).
Таблица 5. Концентрация витамина D и провоспалительных цитокинов в сыворотке крови новорожденных
| 25(OH)D, нг/мл | КГ, n = 35Me (Q; Q) | ОЖ, n = 98Me (Q; Q) | ОЖ + ГСД, n = 32Me (Q; Q) | ГСД, n = 22Me (Q; Q) | СД I типа, n = 31Me (Q; Q) | |||||
| ИЛ-1β, пг/мл | ИЛ-6 | ИЛ-1β, пг/мл | ИЛ-6 | ИЛ-1β, пг/мл | ИЛ-6 | ИЛ-1β, пг/мл | ИЛ-6 | ИЛ-1β, пг/мл | ИЛ-6 | |
| Менее 10 нг/мл | 11,9 (4,0; 46) | 26,5 (15,3; 98,5) | 23,5 (11,2; 39,8) | 64,6 (16; 173,4) | 18,6 (13,1; 30,1) | 89,6 (26,7; 92,5) | 36,6 (12,4; 40,5) | 95,4 (70,2; 103,2) | 49,6 (10,7; 77,9) | 61,8 (27,9; 101,5) |
| От 10 до 20 нг/мл | 4,1 (0,9; 46,9) | 21 (3,7; 80,1) | 5,4 (1,3; 8,0) | 19,8 (3,1; 32,5) | 6,5 (2,5; 14,6) | 24,4 (7,8; 32,8) | - | - | - | |
| От 20 до 30 нг/мл | 1,5 (1,2; 1,5) | 6,3 (3,2; 6,3) | 5,2 (3,0; 25,6) | 4,4 (3,1; 18,4) | 132,2 (18,9; 82,7) | 18,4 (3,0; 11,4) | 4,7 (1,8; 4,72) | 16,3 (3,1; 16,3) | 17,8 (1,4; 77,4) | 37,9 (26,4; 43,5) |
| Более 30 нг/ мл | 4,6 (2,3; 43,5) | 5,2 (3,4; 64,3) | 8,9 (5,0; 9,6) | 67,8 (33,3; 69,2) | 9,7 (7,9; 30,1) | 69,2 (59,1; 76,1) | - | - | - | |
| Примечание: р < 0,05 (критерий Манна – Уитни). | ||||||||||
Наблюдается статистически значимое снижение уровня провоспалительных цитокинов в группе новорожденных от матерей с ГСД – концентрация ИЛ-1β и ИЛ-6 выше у детей с тяжелым дефицитом витамина D, чем у новорожденных с недостаточностью 25(ОН)D (p = 0,004 и p = 0,033 соответственно). Аналогичные данные получены в группе детей от матерей с СД I типа.
В группе детей, рожденных от матерей без эндокринной патологии, прослеживается снижение ИЛ-1β и ИЛ-6 при повышении уровня витамина D. Так, в данной группе показатель ИЛ-1β достоверно выше при тяжелом дефиците 25(ОН)D в отличие от детей, имеющих недостаточность кальцидиола (p = 0,02), а ИЛ-6 статистически значимо выше, чем у детей с дефицитом витамина D (p = 0,03).
Обсуждение
Эндокринная патология, обусловливающая формирование инсулинорезистентности, является важнейшим фактором развития гиповитаминоза D, который, в свою очередь, также оказывает крайне отрицательное влияние на течение беременности, определяя частоту осложнений во время беременности.
Л.И. Мальцевой и соавт. в 2017 г. проведена оценка состояния здоровья новорожденных в зависимости от обеспеченности их матерей витамином D во время беременности. В исследование вошли новорожденные от 101 пациентки из группы высокого риска развития преэклампсии. Беременные имели гипертоническую болезнь, патологию почек, антифосфолипидный синдром и дефицит массы тела, а также эндокринные патологии. У всех беременных на сроке 14–16 нед. гестации наряду c общеклиническим обследованием определяли степень обеспеченности витамином D по уровню 25(OH)D, витамин D-связывающего белка в сыворотке крови и снижение уровня кальция в крови. Показано, что назначение 2000 МЕ витамина D и 1,5 г кальция с начала II триместра беременности повышает обеспеченность витамином D и кальцием, предотвращает развитие осложнений у беременных и новорожденных [52].
В 2021 г. в исследовании на базе Национального медицинского центра им. В.А. Алмазова наблюдались 56 доношенных новорожденных, рожденных от матерей с нормальным индексом массы тела и с ожирением. Определялся уровень TNF-α, TGF-β, IL-18, IL-13, IL-10 и IFN-γ в пуповинной крови. У детей от матерей, страдающих ожирением, уровни TNF-α и IFN-γ в сыворотке пуповинной крови были повышены. Выявлена потенциальная связь увеличения частоты хронических воспалительных заболеваний и ожирения у детей, что подтверждает наши наблюдения иммунной дисрегуляции у потомства матерей с ожирением [53].
Заключение
Эндокринопатии у женщин зачастую сопровождаются, а в периоде беременности практически в 100% случаев осложняются, генитальной и экстрагенитальной патологией. Увеличение во всем мире доли женщин с избыточной массой тела, ожирением и нарушением толерантности к глюкозе – реальность сегодняшнего и завтрашнего дня.
Избыточная масса тела, формирующаяся инсулинорезистентность и обусловленные этим нарушения толерантности к глюкозе негативно влияют на обеспеченность витамином D, а в условиях его дефицита у плода и новорожденного, по-видимому, провоцирует избыточную продукцию провоспалительных цитокинов (ИЛ-1β, ИЛ-6) как у беременных, так и у новорожденных. Относительная неэффективность приема ВМК у беременных с эндокринной патологией может объясняться двумя обстоятельствами. Во-первых, содержание холекальциферола в ВМК, предназначенных для профилактики витаминной недостаточности, как правило, не превышает 500 МЕ, в то время как у пациенток с прегравидарным ожирением, инсулинорезистентностью, манифестирующими ГСД и тем более у женщин с СД I типа имеется исходно низкий уровень витамина D и повышенный синтез лабораторных маркеров воспаления. А во-вторых, без приема беременными с СД I типа, ожирением и ГСД препаратов холекальциферола их потребности, а соответственно, и антенатальные потребности плода удовлетворены быть не могут, при этом используемые дозы должны превышать таковые для женщин без избыточной массы тела и нарушений толерантности к глюкозе. Закономерно, что стартовавшая несколько лет назад в нашей стране целенаправленная работа акушерско-гинекологической службы по внедрению системы прегравидарной и антенатальной профилактики гиповитаминоза D должна положительным образом отразиться и на течении беременности, и на обеспеченности новорожденных.
Список литературы / References
- Krajewska M., Witkowska-Sedek E., Ruminska M., Stelmaszczyk-Emmel A., Sobol M., Majcher A., Pyrzak B. Vitamin D effects on selected antiInflammatory and pro-inflammatory markers of obesity-related chronic inflammation. Front Endocrinol. 2022;(13):920340. https://doi.org/10.3389/fendo.2022.920340.
- Чубаров Т.В., Бессонова А.В., Жданова О.А., Артющенко А.И., Шаршова О.Г. Факторы риска развития ожирения в различные периоды детства. Ожирение и метаболизм. 2021;18(2):163-168. https://doi.org/10.14341/omet12756.
- Алиева Ф.Х. Особенности течения беременности и родов у пациенток с различными степенями ожирения. Пермский медицинский журнал. 2019;36(1):21-26. https://doi.org/10.17816/pmj36121-26.
- Климов Л.Я., Атанесян Р.А., Верисокина Н.Е., Шанина С.В., Долбня С.В., Курьянинова В.А. и др. Роль эндокринной патологии матери в патогенезе нарушений внутриутробного и постнатального развития детей: современный взгляд в рамках концепции пищевого программирования (обзор литературы). Медицинский совет. 2018;(17):38-46. https://doi.org/10.21518/2079-701X-2018-17-38-46.
- Горбатенко Н.В., Беженарь В.Ф., Фишман М.Б. Влияние ожирения на развитие нарушения репродуктивной функции у женщин. Ожирение и метаболизм. 2017;1(14):3-8. https://doi.org/10.14341/omet201713-8.
- Радзинский В.Е., Боташева Т.Л. Ожирение. Диабет. Беременность: версии и контраверсии, клинические практики, перспективы. М.: ГЭОТАР-Медиа; 2020. 515 с. Режим доступа: https://medknigaservis.ru/wp-content/uploads/2020/02/NF0015674.files.pdf.
- Moon J.H., Jang H.C. Gestational diabetes mellitus: diagnostic approaches and maternal-offspring complications. Diabetes Metab J. 2022;46(1):3-14. https://doi.org/10.4093/dmj.2021.0335.
- Климов Л.Я., Верисокина Н.Е., Алавердян Л.С., Курьянинова В.А., Железнякова Т.В., Атанесян Р.А. Адипокины у детей, рожденных от матерей с ожирением. Российский вестник перинатологии и педиатрии. 2018;63(4):182. Режим доступа: https://cyberleninka.ru/article/n/adipokiny-u-detey-rozhdennyh-ot-materey-s-ozhireniem.
- Платонова Н.М., Рыбакова А.А., Никанкина Л.В., Малышева Н.М., Андреева Е.Н., Покусаева В.Н. и др. Витамин D и беременность: современное состояние проблемы в центральных регионах РФ. Проблемы эндокринологии. 2020;66(6):81-87. https://doi.org/10.14341/probl12693.
- Захарова И.Н., Мальцев С.В., Зубков В.В., Курьянинова В.А., Дмитриев А.В., Мальцева Л.И. и др. Влияние витамина D на течение беременности и здоровье новорожденных и детей раннего возраста: современный взгляд на проблему. РМЖ. Мать и дитя. 2020;3(3):174-181. https://doi.org/10.32364/2618-8430-2020-3-3-174-181.
- Громова О.А., Тошин И.Ю. Витамин D - смена парадигмы. М.: ГЭОТАРМедиа; 2017. 576 с. Режим доступа: https://medknigaservis.ru/wp-content/uploads/2021/01/NF0018995.files_.pdf.
- Mansur J.L., Oliveri B., Giacoia E., Fusaro D., Costanzo P.R. Vitamin D: before, during and after pregnancy: effect on neonates and children. Nutrients. 2022;14(9):19-30. https://doi.org/10.3390/nu14091900.
- Thorne-Lyman A., Fawzi W.W. Vitamin D during pregnancy and maternal, neonatal and infant health outcomes: a systematic review and metaanalysis. Paediatr Perinat Epidemiol. 2012;26(1):75-90. https://doi.org/10.1111/j.1365-3016.2012.01283.x
- Каронова Т.Л., Гринева Е.Н., Михеева Е.П., Беляева О.Д., Красильникова Е.И., Никитина И.Л. Уровень витамина D и его взаимосвязь с количеством жировой ткани и содержанием адипоцитокинов у женщин репродуктивного возраста. Проблемы эндокринологии. 2012;58(6):19-23. https://doi.org/10.14341/probl201258619-23.
- Harvey N.C., Holroyd C., Ntani G., Javaid K., Cooper P., Moon R. Vitamin D supplementation in pregnancy: a systematic review. Health Technol Assess. 2014;45(18):34-38. https://doi.org/10.3310/hta18450.
- Климов Л.Я., Алавердян Л.С., Верисокина Н.Е., Курьянинова В.А., Атанесян Р.А., Железнякова Т.В. и др. Клинико-антропометрические и лабораторные показатели новорожденных от матерей с нарушениями метаболизма глюкозы. Медицинский вестник Северного Кавказа. 2018;13(2):359-363. https://doi.org/10.14300/mnnc.2018.13049.
- Баранов И.И., Дорофейков В.В., Зазерская И.Е., Заплатников А.Л., Захарова И.Н., Каронова Т.Л. и др. Междисциплинарное руководство по профилактике и лечению дефицита витамина D в прегравидарном периоде, во время беременности и после родов. СПб.: Эко-Вектор; 2020. 79 с. Режим доступа: https://www.elibrary.ru/item.asp?id=44361844.
- Захарова И.Н., Мальцев С.В., Зубков В.В., Курьянинова В.А., Дмитриев А.В., Малявская С.И. и др. Витамин D, Маловесные, рожденные раньше срока и доношенные новорожденные дети: время изменить парадигму. РМЖ. Мать и дитя. 2020;3(2):142-148. https://doi.org/10.32364/2618-8430-2020-3-2-142-148.
- Hossain N., Kanani F.H., Ramzan S., Kausar R., Ayaz S. Obstetric and neonatal outcomes of maternal vitamin D supplementation: results of an open label randomized controlled trial of antenatal vitamin D supplementation in Pakistani women. Journal of Clinical Endocrinology and Metabolism. 2014;99(7):2448-2455. https://doi.org/10.1210/jc.2013-3491.
- Денисова Т.Г., Грузинова Е.Н., Васильева Э.Н., Сидоров А.Е., Денисова Е.А. Обеспеченность витамином D пациенток с неразвивающейся беременностью. Acta Medica Eurasica. 2021;(1):11-17. https://doi.org/10.47026/2413-4864-2021-1-11-17.
- Sureshchandra S., Marshall N.E., Wilson R.M., Barr T., Rais M., Purnell J.Q., Thornburg K.L., Messaoudi I. Inflammatory determinants of pregravid obesity in placenta and peripheral blood. Front Physiol. 2018;7(9):10-19. https://doi.org/10.3389/fphys.2018.01089.
- Оразмурадов А.А., Ахматова А.Н., Аракелян Г.А., Савенкова И.В., Минаева А.В. Ожирение и гестационное увеличение массы тела в развитии гестационного сахарного диабета и его осложнений. Акушерство и гинекология. Новости. Мнения. Обучение. 2020;8(3):86-89. Режим доступа: https://acu-gin-journal.ru/ru/jarticles_acu/520.html?SSr=1901348c4a20ffffffff27c__07e60a02141313-5922.
- Witkowska-Sedek E., Pyrzak B. Chronic inflammation and the growth hormone/insulin-like growth factor-1 axis. Cent Eur J Immunol. 2020;45(4):469-475. https://doi.org/10.5114/ceji.2020.103422.
- Чабанова Н.Б., Матаев С.И., Василькова Т.Н., Трошина И.А. Метаболические нарушения при адипоцитокиновом дисбалансе и гестационные осложнения. Ожирение и метаболизм. 2017;14(1):9-16. https://doi.org/10.14341/omet201719-16.
- Джумагазиев А.А., Конь И.Я., Безрукова Д.А., Богданьянц М.В., Акмаева Л.М., Усаева О.В. Ожирение у детей: распространенность, возможные причины и следствия. Вопросы детской диетологии. 2018;16(3):49-56. https://doi.org/10.20953/1727-5784-2018-3-49-56.
- Kesavan K., Devaskar S.U. Intrauterine Growth Restriction: Postnatal Monitoring and Outcomes. Pediatr Clin North Am. 2019;66(2):403-423. https://doi.org/10.1016/j.pcl.2018.12.009.
- Farhangi M.A., Mesgari-Abbasi M., Hajiluian G. Adipose tissue inflammation and oxidative stress: the ameliorative effects of vitamin D. Inflammation. 2017;(40):1688-1697. https://doi.org/10.1007/s10753-017-0610-9.
- Abell S.K., De Courten B., Boyle J. A., Teede H.J. Inflammatory and other biomarkers: role in pathophysiology and prediction of gestational diabetes mellitus. Int J Mol Sci. 2015;16(6):13442-13473. https://doi.org/10.3390/ijms160613442.
- Прохоренко Т.С., Саприна Т.В., Будеева С.В. Перспективные маркеры риска развития и прогноза течения гестационного сахарного диабета. Терапевтический архив. 2016;88(4):112-116. https://doi.org/10.17116/terarkh2016884112-116.
- Безрукова Д.А., Джумагазиев А.А., Отто Н.Ю., Шилина Н.М., Дикарева Л.В., Малышева И.П., Безруков Т.Д. Ранние и поздние эффекты материнского ожирения в диаде «мать-дитя». Вопросы детской диетологии. 2021;19(4):46-55. https://doi.org/10.20953/1727-5784-2021-4-46-55.
- Бельмер С.В. Частные вопросы пищевого программирования: фетальное программирование. Вопросы детской диетологии. 2016;14(1):26-31. https://doi.org/10.20953/1727-5784-2016-1-26-31.
- Eades C.E., Cameron D.M., Evans J.M.M. Prevalence of gestational diabetes mellitus in Europe: a metaanalysis. Diabetes Res Clin Pract. 2017;(129):173-181. https://doi.org/10.1016/j.diabres.2017.03.030.
- Масель А.С., Сабирова Э.М., Каприор Е.В., Никитина И.Л. Эволюция представлений о гестационном сахарном диабете (обзор). Педиатрия. Приложение к журналу Consilium Medicum. 2018;(3):85-91. Режим доступа: https://omnidoctor.ru/library/izdaniya-dlya-vrachey/pediatriyaconsilium-medicum/ped2018/ped2018_3/evolyutsiya-predstavleniy-ogestatsionnom-sakharnom-diabete-obzor.
- Папышева О.В., Котайш Г.А., Савенкова И.В., Аракелян Г.А., Лукановская О.Б., Дамирова С.Ф. Влияние прегестационного ожирения на перинатальные исходы у женщин c гестационным сахарным диабетом. Акушерство и гинекология: новости, мнения, обучение. 2019;7(3 Прил.):25-30. https://doi.org/10.24411/2303-9698-2019-13903.
- Pan H., Guo J., Su Z. Advances in understanding the interrelations between leptin resistance and obesity. Physiol Behav. 2014;(130):157-169. https://doi.org/10.1016/j.physbeh.2014.04.003.
- Boriboonhirunsarn D. Second trimester weight gain > 7 kg increases the risk of gestational diabetes after normal first trimester screening. J Obstet Gynaecol Res. 2017;43(3):462-467. https://doi.org/10.1111/jog.13231.
- Feng Y., Jiang C.D., Chang A.M., Shi Y. Interactions among insulin resistance, inflammation factors, obesity-related gene polymorphisms, environmental risk factors, and diet in the development of gestational diabetes mellitus. J Matern Fetal Neonetal Med. 2019;32(2):339-347. https://doi.org/10.1080/14767058.2018.1446207.
- Behboudi-Gandevani S., Amiri M., Yarandi R.B., Tehrani F.R. The impact of diagnostic criteria for gestational diabetes on its prevalence: a systematic review and meta-analysis. Diabetol Metab Syndr. 2019;1(11):11. https://doi.org/10.1186/s13098-019-0406-1.
- Zakharova I., Klimov L., Kuryaninova V., Nikitina I., Malyavskaya S., Dolbnya S. et al. Vitamin D Insufficiency in Overweight and Obese Children and Adolescents. Front Endocrinol (Lausanne). 2019;1(10):103. https://doi.org/10.3389/fendo.2019.00103.
- Смирнова Е.Н., Шулькина С.Г. Содержание лептина, растворимых рецепторов лептина и индекса свободного лептина у больных с метаболическим. Ожирение и метаболизм. 2017;14(1):30-34. https://doi.org/10.14341/omet2017130-34.
- Roca-Rodriguez M.D.M., Lopez-Tinoco C., Fernandez-Deudero A., Murri M., Garcia-Palacios M.V., Garcia-Valero M.D.A. Unfavorable cytokine and adhesion molecule profiles during and after pregnancy, in women with gestational diabetes mellitus. Endocrinology Diabetes Nutr. 2017;64(1):18-25. https://doi.org/10.1016/j.endinu.2016.10.003.
- Seoane-Collazo P., Martínez-Sаnchez N., Milbank E., Contreras C. Incendiary leptin. Nutrients. 2020;12(2):472. https://doi.org/10.3390/nu12020472.
- Климов Л.Я., Захарова И.Н., Курьянинова В.А., Никитина И.Л., Каронова Т.Л., Малявская С.И. и др. Недостаточность витамина D и ожирение у детей и подростков: насколько взаимосвязаны две глобальные пандемии. Роль витамина D в патогенезе ожирения и инсулинорезистентности (часть 1). Медицинский совет. 2017;(19):214-220. https://doi.org/10.21518/2079-701X-2017-19-214-220.
- Чистякова Г.Н., Ремизова И.И., Газиева И.А., Ляпунов В.А., Устьянцева Л.С. Особенности иммунной системы детей, родившихся у женщин с гестационным сахарным диабетом. Российский вестник перинатологии и педиатрии. 2015;60(2):42-48. Режим доступа: https://www.ped-perinatology.ru/jour/article/view/74.
- Якорнова Г.В., Ремизова И.И., Чистякова Г.Н., Устьянцева Л.С. Динамика провоспалительных цитокинов у детей, родившихся у женщин с осложненной беременностью, в зависимости от течения раннего периода адаптации. Российский вестник перинатологии и педиатрии. 2015;(4):50-56. Режим доступа: https://www.ped-perinatology.ru/jour/article/viewFile/135/176.
- Geca T., Kwasniewska A. The influence of gestational diabetes mellitus upon the selected parameters of the maternal and fetal system of insulinlike growth factors (IGF- 1, IGF-2, IGFBP1-3) - a review and a clinical study. J Clin Med. 2020;9(10):32-56. https://doi.org/10.3390/jcm9103256.
- Намазова-Баранова Л.С., Захарова И.Н., Громова О.А., Мальцев С.В., Боровик Т.Э., Плудовски П. Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции». М.: ПедиатрЪ; 2018. 96 с. Режим доступа: https://www.elibrary.ru/item.asp?id=34881251.
- Драпкина О.М., Самородская И.В., Старинская М.А., Ким О.Т., Неймарк А.Е. Ожирение: оценка и тактика ведения пациентов. М.: ФГБУ “НМИЦ ТПМ” Минздрава России; Силицея-Полиграф, 2021. 174 с. Режим доступа: https://gnicpm.ru/wp-content/uploads/2020/01/e-monography_obesity.pdf.
- Дедов И.И., Краснопольский В.И., Сухих Г.Т. Российский национальный консенсус «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение». Сахарный диабет. 2012;58(4):4-10. https://doi.org/10.14341/2072-0351-5531.
- Волкова М.А. Структура экстрагенитальной патологии у беременных. Вестник Ивановской медицинской академии. 2021;26(2):53-54. https://doi.org/10.52246/1606-8157_2021_26_2_53.
- Дударева Ю.А., Сероштанова Д.Н. Роль эндотелиальной дисфункции и субклинического воспаления в развитии акушерских и перинатальных осложнений у пациенток с сахарным диабетом. Acta Biomedica Scientifica. 2021;6(3):9-16. https://doi.org/10.29413/ABS.2021-6.3.1.
- Васильева Э.Н., Мальцева Л.И., Денисова Т.Г., Герасимова Л.И. Особенности состояния здоровья новорожденных в зависимости от обеспеченности их матерей витамином D во время беременности. Казанский медицинский журнал. 2017;98(5):691-695. https://doi.org/10.17750/KMJ2017-691.
- Новикова В.П., Петренко Ю.В., Иванов Д.О., Прокопьева Н.Э., Гурина О.П., Блинов А.Е. и др. Цитокиновый статус новорожденных детей, матери которых страдают ожирением. Вопросы детской диетологии. 2021;19(4):76-80. https://doi.org/10.20953/2224-5448-2020-3-11-14.