
Журнал "Медицинский совет" № 23/2022
DOI: 10.21518/2079-701X-2022-16-23-224-230
С.И. Семенченко1,2, https://orcid.org/0000-0003-1157-6753
А.Э. Каспарова2, https://orcid.org/0000-0001-7665-2249
Л.А. Чегус2, https://orcid.org/0000-0002-9698-8038
Е.Е. Чёрная2, https://orcid.org/0000-0002-9899-3279
1 Окружная клиническая больница; 628012, Россия, Ханты-Мансийск, ул. Калинина, д. 40
2 Ханты-Мансийская государственная медицинская академия; 628011, Россия, Ханты-Мансийск, ул. Мира, д. 40
Имплантация эмбрионов является ключевым фактором, ограничивающим эффективность вспомогательных репродуктивных технологий, и зависит от качества бластоцисты и восприимчивости эндометрия. Предложены различные методы лечения, направленные на улучшение рецептивности слизистой оболочки матки, в том числе скретчинг эндометрия. При этом основные механизмы, лежащие в основе данного вмешательства, остаются неясными. Более того, не определены оптимальный срок воздействия на слизистую оболочку матки и группы пациенток, в которых оно может оказать положительное влияние. Цель – исследовать основные механизмы и оценить эффективность локального повреждения эндометрия, выполненного в различные сроки перед переносом эмбрионов в программе вспомогательных репродуктивных технологий у женщин с наличием и отсутствием неудач имплантации в анамнезе на основе анализа научной литературы. Изучены клинические исследования, систематические обзоры и метаанализы в базах данных PubMed, Embase, Cochrane Library, Web of Science, издательств Elsevier, Springer, Wiley, на платформах eLIBRARY, Research Gate, в открытых источниках научного и образовательного сегмента сети интернет. Литературный поиск проведен по ключевым словам: скретчинг эндометрия, локальное повреждение эндометрия, неудачи имплантации, рецептивность эндометрия, вспомогательные репродуктивные технологии, бесплодие. Глубина поиска – 20 лет. Основные механизмы влияния скретчинга на повышение рецептивности эндометрия включают децидуализацию, развитие местной воспалительной реакции, а также улучшение синхронизации между слизистой оболочкой матки и перенесенным эмбрионом за счет предупреждения преждевременного созревания эндометрия. Исследования, показавшие положительный эффект локального повреждения слизистой оболочки матки, преимущественно были проведены у пациенток с повторными неудачами имплантации и с осуществлением вмешательства в лютеиновую фазу цикла, предшествовавшего стимуляции. Вместе с тем работы, выполненные в неселективной популяции женщин и не стандартизированные по времени воздействия, в большинстве случаев не выявили преимуществ скретчинга эндометрия. В связи с этим требуется проведение дополнительных качественных рандомизированных контролируемых исследований с большим объемом выборки и четким выделением групп пациентов, для которых данное вмешательство может принести пользу.
Для цитирования: Семенченко С.И., Каспарова А.Э., Чегус Л.А., Чёрная Е.Е. Эффективность эндометриального скретчинга при лечении бесплодия с помощью вспомогательных репродуктивных технологий. Медицинский Совет. 2022;(23):224-230. https://doi.org/10.21518/2079-701X-2022-16-23-224-230
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Effectiveness of endometrial scratching in infertility treatment with assisted reproductive technologies
Sergey I. Semenchenko1,2, https://orcid.org/0000-0003-1157-6753
Angelika E. Kasparova2, https://orcid.org/0000-0001-7665-2249
Larisa A. Chegus2, https://orcid.org/0000-0002-9698-8038
Ekaterina E. Chernaya2, https://orcid.org/0000-0002-9899-3279
1 District Clinical Hospital; 40, Kalinin St., Khanty-Mansiysk, 628012, Russia
2 Khanty-Mansiysk State Medical Academy; 40, Mira St., Khanty-Mansiysk, 628011, Russia
Embryo implantation is a key factor limiting the effectiveness of assisted reproductive technologies, and depends on the quality of the blastocyst and the susceptibility of the endometrium. Various methods of treatment aimed at improving the receptivity of the uterine mucosa, including endometrial scratching, have been proposed. At the same time, the main mechanisms underlying this intervention remain unclear. Moreover, the optimal duration of exposure to the uterine mucosa and the groups of patients in which it can have a positive effect have not been determined. The study aims to investigate the main mechanisms and evaluate the effectiveness of local endometrial damage performed at various times before embryo transfer in the program of assisted reproductive technologies in women with and without a history of implantation failures based on the analysis of scientific literature. Clinical studies, systematic reviews and meta-analyses were studied in PubMed, Embase, Cochrane Library, Web of Science databases, Elsevier, Springer, Wiley publishers, on eLibrary, Research Gate platforms, in open sources of the scientific and educational segment of the Internet. The literature search was conducted by keywords: endometrial scratching, local endometrial damage, implantation failures, endometrial receptivity, assisted reproductive technologies, infertility. The search depth is 20 years. The main mechanisms of the effect of scratching on increasing endometrial receptivity include decidualization, the development of a local inflammatory reaction, as well as improved synchronization between the uterine mucosa and the transferred embryo by preventing premature maturation of the endometrium. Studies that showed a positive effect of local damage to the uterine mucosa were mainly conducted in patients with repeated implantation failures and with intervention in the luteal phase of the cycle preceding stimulation. At the same time, the work performed in a non-selective population of women and non-standardized by exposure time, in most cases, did not reveal the advantages of endometrial scratching. In this regard, additional qualitative randomized controlled trials with a large sample size and a clear identification of groups of patients for whom this intervention may benefit are required.
For citation: Semenchenko S.I., Kasparova A.E., Chegus L.A., Chernaya E.E. Effectiveness of endometrial scratching in infertility treatment with assisted reproductive technologies. Meditsinskiy sovet = Medical Council. 2022;(23):224-230. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-23-224-230
Conflict of interest: the authors declare no conflict of interest.
Введение
В настоящее время вспомогательные репродуктивные технологии (ВРТ) являются одним из самых эффективных методов лечения бесплодия. Ежегодно в мире проводится более 2,5 млн циклов экстракорпорального оплодотворения (ЭКО), в результате которых происходит свыше 500 000 родов [1]. Несмотря на все достижения в области ВРТ, частота наступления беременности не превышает 35% на перенос эмбриона и менее 30% циклов лечения приводят к живорождению [2–4]. Ключевым фактором, ограничивающим результативность программ ЭКО, является имплантация эмбрионов, которая зависит от качества бластоцисты и восприимчивости слизистой оболочки матки [5, 6]. По оценкам специалистов на качество эмбрионов приходится две трети всех неудач имплантации, в то время как невосприимчивый эндометрий может быть причиной оставшейся трети [7]. При этом прикрепление может не произойти при переносе эмбрионов хорошего качества [8].
В настоящее время предложены различные методы лечения, направленные на улучшение рецептивности слизистой оболочки матки, в том числе ее локальное повреждение. Однако основные механизмы, лежащие в основе данного вмешательства, остаются неясными. Кроме того, на сегодняшний день отсутствует общепринятое мнение об оптимальном сроке воздействия на эндометрий по отношению к циклу ЭКО, а также о том, в каких группах пациенток оно может оказать положительное влияние [5, 9, 10]. В связи с этим дальнейшее изучение данной проблемы представляется актуальным.
Цель – исследовать основные механизмы и оценить эффективность локального повреждения эндометрия, выполненного в различные сроки перед переносом эмбрионов в программе вспомогательных репродуктивных технологий у женщин с наличием и отсутствием неудач имплантации в анамнезе на основе анализа научной литературы.
Материалы и методы
Изучены работы зарубежных и отечественных авторов, в том числе рандомизированные контролируемые исследования (РКИ), систематические обзоры и метаанализы в базах данных PubMed, Embase, Cochrane Library, Web of Science, издательств Elsevier, Springer, Wiley, на платформах eLIBRARY, Research Gate, в открытых источниках научного и образовательного сегмента сети интернет. Информационный поиск проводился по следующим ключевым словам: скретчинг эндометрия, локальное повреждение эндометрия, неудачи имплантации, рецептивность эндометрия, вспомогательные репродуктивные технологии, бесплодие. Глубина поиска составила 20 лет.
Результаты и обсуждение
Несмотря на относительно высокую частоту оплодотворения яйцеклеток и постоянно улучшающиеся условия культивирования эмбрионов, имплантация остается этапом, лимитирующим эффективность программ ЭКО. Основной причиной неудачи прикрепления эмбрионов хорошего качества является нарушение рецептивности эндометрия, под которой понимают его способность обеспечить все необходимые этапы имплантации: аппозицию, адгезию на поверхности слизистой оболочки матки и инвазию [11].
Отсутствие беременности после неоднократных переносов эмбрионов называют «повторной неудачей имплантации» (ПНИ). Однако общепринятое определение этого понятия в настоящее время отсутствует. Ряд авторов в качестве основного критерия рассматривают количество предыдущих неудачных переносов свежих или размороженных эмбрионов. При этом ПНИ наиболее часто определяют после по крайней мере 3 безуспешных циклов лечения [12–14]. Некоторые исследователи ставят диагноз ПНИ уже после 2 предшествующих неудач имплантации [15–17]. Другие авторы полагают, что следует также уделять внимание количеству и качеству перенесенных эмбрионов, и рассматривают ПНИ как неспособность достичь клинической беременности после 3 последовательных попыток ЭКО, при которых в каждом цикле переносится от 1 до 2 эмбрионов высокого качества [18, 19]. C. Coughlan et al. (2014) предложили более строгие диагностические критерии и определили ПНИ как отсутствие эффекта после переноса по меньшей мере 4 свежих или размороженных эмбрионов хорошего качества в течение минимум 3 циклов в возрасте до 40 лет [12].
Неудачи имплантации при переносе эмбрионов хорошего качества могут быть обусловлены патологическими процессами в слизистой оболочке матки. Одним из вмешательств, предложенных для улучшения восприимчивости эндометрия, является его физическое повреждение (скретчинг) [5]. Первое проспективное исследование, посвященное влиянию скретчинга (scratch, англ. – царапина) в цикле, предшествовашему протоколу ЭКО, было опубликовано в 2003 г. и включало 134 пациентки [20]. Авторы показали, что биопсия эндометрия, выполненная на 8, 12, 21 и 26-й дни спонтанного менструального цикла перед протоколом стимуляции, приводила к существенному (примерно в 2 раза) увеличению показателей имплантации, клинической беременности и живорождения (48,9% в группе вмешательства против 23,6% в контроле) [20].
Однако основной механизм того, как локальное воздействие на эндометрий может улучшить его рецептивность, в настоящее время остается неясным [5]. При этом было выдвинуто несколько гипотез. Во-первых, повреждение пролиферативного эндометрия вызывает его децидуализацию, т. е. процесс, который происходит при подготовке к беременности и, следовательно, содействует имплантации [21, 22]. Barash A. et al. (2003) указывают, что еще в 1907 г. опубликовано сообщение о быстром росте клеток эндометрия, похожих на децидуальные клетки беременности, после повреждения слизистой оболочки матки у морских свинок [20].
Во-вторых, предполагают, что биопсия эндометрия инициирует воспалительную реакцию, которая способствует его переходу из невосприимчивого в восприимчивое состояние [11]. Травма слизистой оболочки матки запускает секрецию цитокинов, интерлейкинов, факторов роста, которые привлекают моноциты и индуцируют их дифференцировку в макрофаги и дендритные клетки. Они в свою очередь стимулируют стромальные и эпителиальные клетки экспрессировать специфический набор хемокинов и молекул адгезии, участвующих во взаимодействии матки и бластоцисты, что улучшает имплантацию эмбриона [11, 22, 23]. В эксперименте на мышах было показано, что в группе животных с локальным повреждением эндометрия отмечалось значительное повышение локального уровня цитокинов (фактора, ингибирующего лейкемию (ЛИФ), и онкостатина М (OSM)), а также увеличение количества имплантированных эмбрионов [24] (рис. 1).
Рисунок 1. Имплантированные эмбрионы в мышиной матке на 8-й день беременности
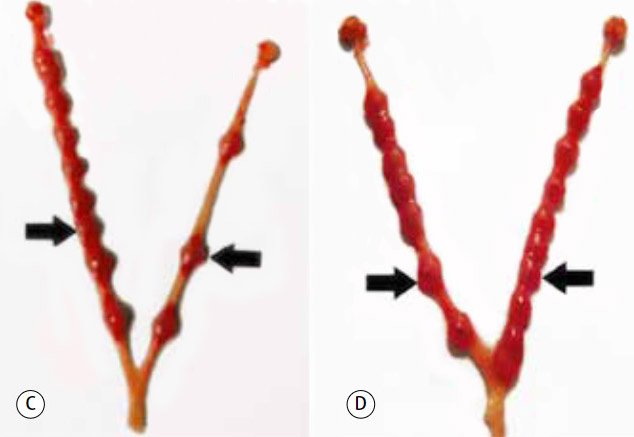
Группа III (скретчинг правого маточного рога; C). Группа IV (скретчинг с обеих сторон; D). Стрелки указывают на имплантированные эмбрионы [24]
Group III (scratching of the right uterine horn; C). Group IV (scratching on both sides; D). Cursors point to implanted embryos [24]
Естественные клетки-киллеры (NK-клетки) являются основным источником иммунорегуляторных цитокинов в эндометрии, и считается, что их количество уменьшается во время контролируемой стимуляции яичников [25]. Повреждение слизистой оболочки матки обеспечивает нормализацию в ней количества NK-клеток [26]. Кроме того, известно, что у 20–25% пациентов с ПНИ отмечается незрелость маточных клеток-киллеров. Скретчинг эндометрия, выполненный в середине лютеиновой фазы, повышает локальную экспрессию IL-15 в середине лютеиновой фазы следующего цикла. Секреция IL-15 способствует созреванию NK-клеток, что необходимо для успешной имплантации, т. к. они регулируют местный ангиогенез и инвазию спиральных артерий [27]. Цитокины, факторы роста и NK-клетки, стимулируя ангиогенез, обеспечивают адекватный приток крови к ткани и предотвращают отторжение эмбриона [25]. Стимуляция ангиогенеза в слизистой оболочке матки после ее преднамеренного повреждения подтверждается увеличением экспрессии белков ангиогенеза, а также количества предшественников эндотелиальных клеток (CD34) в эндометрии, являясь возможным механизмом повышения вероятности имплантации бластоцисты [28]. Основные события, происходящие в слизистой оболочке матки при ее локальном повреждении, представлены на рис. 2.
Рисунок 2. Предполагаемая модель событий в результате повреждения слизистой оболочки матки, приводящих к увеличению ее рецептивности [11]
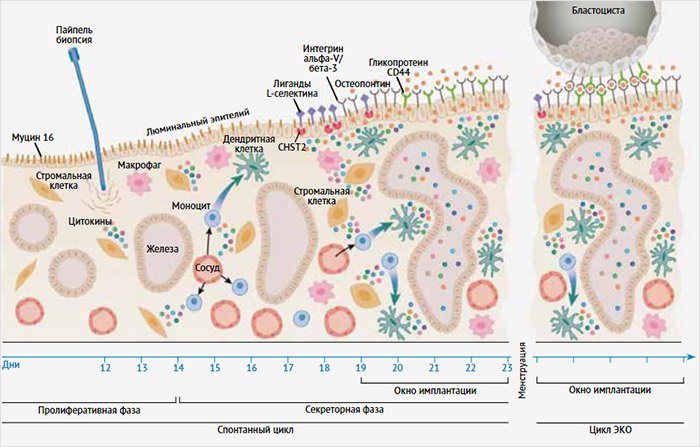
Согласно третьей гипотезе высокие концентрации эстрадиола во время стимуляции яичников приводят к раннему повышению уровня прогестерона, вызывая аномальное созревание эндометрия. При этом он опережает свое развитие и может быть менее восприимчивым к имплантации бластоцисты [5, 29]. Полагают, что повреждение эндометрия замедляет его созревание, и это приводит к лучшей синхронизации между слизистой оболочкой матки и перенесенным эмбрионом [21, 22].
Тем не менее в настоящее время отсутствует единое мнение относительно оптимального метода повреждения эндометрия, количества необходимых процедур, а также о предпочтительном сроке данного вмешательства по отношению к циклу ЭКО [5, 9, 10, 30].
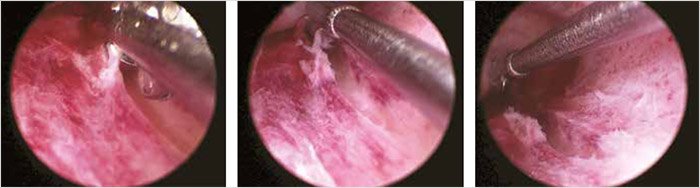
За последние годы проведено большое количество исследований по стимуляции слизистой оболочки матки с помощью Pipelle de Cornier [10, 17, 20, 31–35], катетера для биопсии эндометрия [6, 9, 21], кюретки Новака [36], гистероскопии [37] или гистероскопии в сочетании с повреждением эндометрия [38, 39, 40] (рис. 3).
Рисунок 3. Скретчинг эндометрия при гистероскопии [41]
Манипуляция выполнялась один раз [6, 9, 10, 17, 21, 31–36, 42] либо дважды [38, 43, 44]. В одном исследовании [20] осуществлялось 4 биопсии слизистой оболочки матки.
При этом большинство авторов проводили повреждение эндометрия во время лютеиновой фазы цикла, предшествовавшего переносу эмбрионов [6, 9, 31–33, 35, 39, 42]. Некоторые исследователи выполняли скретчинг в фолликулярную фазу цикла стимуляции яичников [10, 21]. Только в одной работе сравнивалось повреждение слизистой оболочки матки в день пункции фолликулов с отсутствием такового [36]. Недавнее крупное РКИ не стандартизировало время выполнения скретчинга эндометрия с диапазоном проведения вмешательства с 3-го дня предшествующего цикла до 3-го дня цикла переноса эмбрионов [17].
Первые РКИ продемонстрировали значительное (примерно в 2 раза) повышение показателей беременности, что подтвердил кокрейновский обзор 2015 г. [5]. Дальнейшие наблюдения показали противоречивые результаты. Однако многие работы, не выявившие преимуществ локального повреждения слизистой оболочки матки, выполнялись в неселективной популяции либо у женщин, проходивших первый цикл ВРТ [9, 10, 17, 32, 34, 45], а также имели высокий риск ошибки. В недавнем исследовании проводилась оценка методологических проблем в 25 РКИ, посвященных влиянию скретчинга эндометрия на результаты программ ЭКО [46]. Авторы показали, что большая часть наблюдений имели по крайней мере одну или несколько проблем, касающихся регистрации испытаний, статистических методов, воспроизводимости исходных либо промежуточных результатов.
Следует отметить, что большинство исследований, показавших положительный эффект скретчинга, были выполнены у пациенток с ПНИ [35, 38, 42, 43]. Так, многоцентровое РКИ, проведенное в Дании и опубликованное в 2019 г., включало 304 участницы с одной или более неудачной предыдущей попыткой ЭКО [35]. В группе вмешательства (151 пациентка) проводился скретчинг катетером Pipelle de Cornier в середине лютеиновой фазы перед стимуляцией яичников. В контрольной группе, состоявшей из 153 женщин, повреждение эндометрия не выполнялось. Авторы не обнаружили существенной разницы в показателях имплантации, клинической беременности и живорождения в сравниваемых группах. Однако при анализе подгрупп установлено, что у женщин с тремя или более предыдущими неудачами имплантации частота клинической беременности и живорождения значительно увеличилась после скретчинга эндометрия: с 31,1 до 53,6% (p = 0,024) и с 26,7 до 46,4% (p = 0,042) соответственно. По результатам исследования не выявлено разницы в отношении пренатальных осложнений (преэклампсии, задержки внутриутробного развития, гестационного диабета и преждевременных родов), а также по полу, росту и весу при рождении, порокам развития плода и плаценты между двумя группами [35].
Авторы кокрейновского обзора также считают, что повреждение эндометрия может принести пользу только женщинам с двумя или более предыдущими неудачными переносами эмбрионов [5].
Полагают, что положительный эффект скретчинга зависит от предшествующего состояния слизистой оболочки матки [9]. При этом у пациенток с неоднократными неудачами имплантации чаще отмечаются аномальные особенности эндометрия [47]. Показано, что женщины с ПНИ имеют специфический профиль экспрессии генов слизистой оболочки матки [48], поэтому у них чаще будут отмечаться неудачи имплантации, связанные с эндометрием [35]. Следовательно, его повреждение с большей вероятностью окажет благоприятное действие у пациенток с рецидивирующей неудачей имплантации, чем в неселективной популяции [9, 41].
Необходимо отметить, что в большинстве наблюдений, в которых отмечался положительный эффект скретчинга, повреждение эндометрия осуществлялось в середине лютеиновой фазы цикла, предшествовавшего переносу эмбрионов. Например, метаанализ этого года показал, что механическая стимуляция эндометрия может улучшить показатели живорождения, клинической беременности и снизить частоту абортов у пациенток с нормальными результатами гистероскопии [49]. Польза была еще больше, когда вмешательство проводилось в лютеиновую фазу цикла [49]. В самом деле, это предполагаемое «окно имплантации» с наибольшим содержанием цитокинов, факторов роста и моноцитов в эндометрии [23], когда эффект от его повреждения может быть максимальным [32]. Кроме того, поскольку децидуализация, вызванная травмой эндометрия у мышей, наиболее выражена под действием прогестерона, для получения положительного результата авторы предлагают проводить манипуляцию именно в секреторной фазе [20].
Напротив, выполнение скретчинга в фолликулярной фазе цикла стимуляции [10] либо в день пункции фолликулов [36] не дает эндометрию необходимого времени для восстановления к моменту переноса свежих эмбрионов. Действительно, в эксперименте на кроликах гистологически показано, что полное восстановление слизистой оболочки матки после локального повреждения может занять до 2 нед. [50]. Полагают, что при проведении манипуляции незадолго до переноса эмбрионов провоспалительные цитокины, макрофаги и дендритные клетки не могут образовываться достаточно быстро и в необходимом количестве, что может привести к нарушению восприимчивости эндометрия [36].
Так, в РКИ REFRESH изучался эффект скретчинга в фолликулярной фазе цикла стимуляции у 200 пациенток [10]. Однако оно было прекращено досрочно (в исследование планировалось включить 360 женщин) в связи с более высокой частотой выкидышей (25% в группе вмешательства против 8% в контроле). При этом показатель живорождения был сопоставим в интервенционной и контрольной группах (32 и 36% соответственно).
В другой работе повреждение эндометрия было выполнено кюреткой Новака в день получения яйцеклеток [36]. Это РКИ, включавшее 156 пациенток, выявило уменьшение частоты имплантации (7,9 против 22,9%, р < 0,05), показателей клинической (12,3 против 32,9%, р < 0,05) и продолжающейся беременности (9,6 против 29,1%, р < 0,05) в экспериментальной группе по сравнению с контролем [36].
Заключение
Таким образом, основные механизмы влияния скретчинга на повышение рецептивности эндометрия обусловлены децидуализацией, развитием местной воспалительной реакции, а также предупреждением преждевременного созревания слизистой оболочки матки, что способствует улучшению синхронизации между эндометрием и перенесенным эмбрионом.
Большинство работ, показавших положительный эффект локального повреждения слизистой оболочки матки, были проведены у пациенток с ПНИ и с осуществлением вмешательства в лютеиновую фазу цикла, предшествовавшего стимуляции. Напротив, исследования, выполненные в неселективной популяции женщин и не стандартизированные по времени воздействия, не выявили преимуществ скретчинга эндометрия. При этом многие из них имели высокий риск ошибки. Возможно, положительный эффект локального повреждения может быть меньше, чем ожидалось в этих наблюдениях, и проявляется только в определенных группах пациенток (в частности у женщин с ПНИ). Это обусловливает необходимость проведения дополнительных хорошо организованных РКИ с большим объемом выборки и четким выделением групп пациентов, для которых скретчинг эндометрия может быть полезным.
Список литературы / References
- Fauser B.C. Towards the global coverage of a unified registry of IVF out-comes. Reprod Biomed Online. 2019;38(2):133-137. https://doi.org/10.1016/j.rbmo.2018.12.001.
- Gunby J., Bissonnette F., Librach C., Cowan L. Assisted reproductive technologies (ART) in Canada: 2006 results from the Canadian ART Register. Fertil Steril. 2010;93(7):2189-2201. https://doi.org/10.1016/j.fertnstert.2009.03.102.
- Toftager M., Bogstad J., Løssl K., Prætorius L., Zedeler A., Bryndorf T. et al. Cumulative live birth rates after one ART cycle including all subsequent frozen-thaw cycles in 1050 women: secondary outcome of an RCT comparing GnRH-antagonist and GnRH-agonist protocols. Hum Reprod. 2017;32(3):556-567. https://doi.org/10.1093/humrep/dew358.
- De Geyter C., Calhaz-Jorge C., Kupka M.C., Wyns C., Mocanu E., Motrenko T. et al. ART in Europe, 2014: results generated from European registries by ESHRE. Hum Reprod. 2018;33(9):1586-1601. https://doi.org/10.1093/humrep/dey242.
- Nastri C.O., Lensen S.F., Gibreel A., Raine-Fenning N., Ferriani R.A., Bhattacharya S., Martins W.P. Endometrial injury in women undergoing assisted reproductive techniques (review) summary of findings for the main comparison. Cochr Database Syst Rev. 2015;(3):CD009517. https://doi.org/10.1002/14651858.CD009517.pub3.
- Van Hoogenhuijze N.E., Mol F., Laven J.S.E., Groenewoud E.R., Traas M.A.F., Janssen C.A.H. et al. Endometrial scratching in women with one failed IVF/ICSI cycle - outcomes of a randomised controlled trial (SCRaTCH). Hum Reprod. 2021;36(1):87-98. https://doi.org/10.1093/humrep/deaa268.
- Macklon N.S., Stouffer R.L., Giudice L.C., Fauser B.C. The science behind 25 years of ovarian stimulation for in vitro fertilization. Endocr Rev. 2006;27(2):170-207. https://doi.org/10.1210/er.2005-0015.
- Vitagliano A., Andrisani A., Alviggi C., Vitale S.G., Valenti G., Sapia F. et al. Endometrial scratching for infertile women undergoing a first embryo transfer: a systematic review and meta-analysis of published and unpublished data from randomized controlled trials. Fertil Steril. 2019;111(4):734-746.e2. https://doi.org/10.1016/j.fertnstert.2018.12.008.
- Mak J.S.M., Chung C.H.S., Chung J.P.W., Kong G.W.S., Saravelos S.H., Cheung L.P., Li T.C. The effect of endometrial scratch on natural-cycle cryopreserved embryo transfer outcomes: a randomized controlled study. Reprod Biomed Online. 2017;35(1):28-36. https://doi.org/10.1016/j.rbmo.2017.04.004.
- Mackens S., Racca A., Van de Velde H., Drakopoulos P., Tournaye H., Stoop D. et al. Follicular-phase endometrial scratching: a truncated randomized controlled trial. Hum Reprod. 2020;35(5):1090-1098. https://doi.org/10.1093/humrep/deaa018.
- Gnainsky Y., Granot I., Aldo P., Barash A., Or Y., Mor G., Dekel N. Biopsyinduced inflammatory conditions improve endometrial receptivity: the mechanism of action. Reproduction. 2015;149(1):75-85. https://doi.org/10.1530/REP-14-0395.
- Coughlan C., Ledger W., Wang Q., Liu F., Demirol A., Gurgan T. et al. Recurrent implantation failure: definition and management. Reprod Biomed Online. 2014;28(1):14-38. https://doi.org/10.1016/j.rbmo.2013.08.011.
- Koot Y.E.M., Hviid Saxtorph M., Goddijn M., de Bever S., Eijkemans M.J.C., Wely M.V. et al. What is the prognosis for a live birth after unexplained recurrent implantation failure following IVF/ICSI? Hum Reprod. 2019;34(10):2044-2051. https://doi.org/10.1093/humrep/dez120.
- Busnelli A., Somigliana E., Cirillo F., Baggiani A., Levi-Setti P.E. Efficacy of therapies and interventions for repeated embryo implantation failure: a systematic review and meta-analysis. Sci Rep. 2021;11(1):1747. https://doi.org/10.1038/s41598-021-81439-6.
- Polanski L.T., Baumgarten M.N., Quenby S., Brosens J., Campbell B.K., Raine-Fenning N.J. et al. What exactly do we mean by ‘recurrent implantation failure’? A systematic review and opinion. Reprod Biomed Online. 2014;28(4):409-423. https://doi.org/10.1016/j.rbmo.2013.12.006.
- Huang P., Wei L., Li X. A study of intrauterine infusion of human chorionic gonadotropin (hCG) before frozen-thawed embryo transfer after two or more implantation failures. Gynecol Endocrinol. 2017;33(1):67-69. https://doi.org/10.1080/09513590.2016.1207164.
- Lensen S., Osavlyuk D., Armstrong S., Stadelmann C., Hennes A., Napier E. et al. A Randomized Trial of Endometrial Scratching before In Vitro Fertilization. N Engl J Med. 2019;380(4):325-334. https://doi.org/10.1056/NEJMoa1808737.
- Simon A., Laufer N. Repeated implantation failure: clinical approach. Fertil Steril. 2012;97(5):1039-1043. https://doi.org/10.1016/j.fertnstert.2012.03.010.
- Rigos I., Athanasiou V., Vlahos N., Papantoniou N., Profer D., Siristatidis C. The Addition of Endometrial Injury to Freeze-All Strategy in Women with Repeated Implantation Failures. J Clin Med. 2021;10(10):2162. https://doi.org/10.3390/jcm10102162.
- Barash A., Dekel N., Fieldust S., Segal I., Schechtman E., Granot I. Local injury to the endometrium doubles the incidence of successful pregnancies in patients undergoing in vitro fertilization. Fertil Steril. 2003;79(6):1317-1322. https://doi.org/10.1016/S0015-0282(03)00345-5.
- Zhou L., Li R., Wang R., Huang H.X., Zhong K. Local injury to the endometrium in controlled ovarian hyperstimulation cycles improves implantation rates. Fertil Steril. 2008;89(5):1166-1176. https://doi.org/10.1016/j.fertnstert.2007.05.064.
- Li R., Hao G. Local injury to the endometrium: its effect on implantation. Curr Opin Obstet Gynecol. 2009;21(3):236-239. https://doi.org/10.1097/GCO.0b013e32832a0654.
- Gnainsky Y., Granot I., Aldo P.B., Barash A., Or Y., Schechtman E. et al. Local injury of the endometrium induces an inflammatory response that promotes successful implantation. Fertil Steril. 2010;94(6):2030-2036. https://doi.org/10.1016/j.fertnstert.2010.02.022.
- Zhang X.H., Liu Z.Z., Tang M.X., Zhang Y.H., Hu L., Liao A.H. Morphological Changes and Expression of Cytokine After Local Endometrial Injury in a Mouse Model. Reprod Sci. 2015;22(11):1377-1386. https://doi.org/10.1177/1933719115580999.
- Siristatidis C., Vrachnis N., Vogiatzi P., Chrelias C., Retamar A.Q., Bettocchi S., Glujovsky D. Potential pathophysiological mechanisms of the beneficial role of endometrial injury in in vitro fertilization outcome. Reprod Sci. 2014;21(8):955-965. https://doi.org/10.1177/1933719114525270.
- Junovich G., Mayer Y., Azpiroz A., Daher S., Iglesias A., Zylverstein C. et al. Ovarian stimulation affects the levels of regulatory endometrial NK cells and angiogenic cytokine VEGF. Am J Reprod Immunol. 2011;65(2):146-153. https://doi.org/10.1111/j.1600-0897.2010.00892.x.
- Lamazou F., Oger P., Meicler P., Kerbrat G., Soudre G., Genauzeau E. et al. Patients with repeated implantation failure and Natural Killer cells immaturity: the efficiency of the endometrial scratching strategy. Hum Reprod. 2020;35(Suppl.):295. https://doi.org/10.1093/humrep/35.Supplement_1.1.
- Yang J.H., Chen C.D., Chou C.H., Wen W.F., Tsao P.N., Lee H., Chen S.U. Intentional endometrial injury increases embryo implantation potentials through enhanced endometrial angiogenesis. Biol Reprod. 2019;100(2):381-389. https://doi.org/10.1093/biolre/ioy205.
- Fatemi H.M., Popovic-Todorovic B. Implantation in assisted reproduction: a look at endometrial receptivity. Reprod Biomed Online. 2013;27(5):530-538. https://doi.org/10.1016/j.rbmo.2013.05.018.
- Potdar N., Gelbaya T., Nardo L.G. Endometrial injury to overcome recurrent embryo implantation failure: a systematic review and meta-analysis. Reprod Biomed Online. 2012;25(6):561-571. https://doi.org/10.1016/j.rbmo.2012.08.005.
- Nastri C.O., Ferriani R.A., Raine-Fenning N., Martins W.P. Endometrial scratching performed in the non-transfer cycle and outcome of assisted reproduction: a randomized controlled trial. Ultrasound Obstet Gynecol. 2013;42(4):375-382. https://doi.org/10.1002/uog.12539.
- Yeung T.W.Y., Chai J., Li R.H.W., Lee V.C.Y., Ho P.C., Ng E.H.Y. The effect of endometrial injury on ongoing pregnancy rate in unselected subfertile women undergoing in vitro fertilization: a randomized controlled trial. Hum Reprod. 2014;29(11):2474-2481. https://doi.org/10.1093/humrep/deu213.
- Mahran A., Ibrahim M., Bahaa H. The effect of endometrial injury on first cycle IVF/ICSI outcome: A randomized controlled trial. Int J Reprod Biomed. 2016;14(3):193-198. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4899760.
- Liu W., Tal R., Chao H., Liu M., Liu Y. Effect of local endometrial injury in proliferative vs. luteal phase on IVF outcomes in unselected subfertile women undergoing in vitro fertilization. Reprod Biol Endocrinol. 2017;15(1):75. https://doi.org/10.1186/s12958-017-0296-8.
- Olesen M.S., Hauge B., Ohrt L., Olesen T.N., Roskær J., Bæk V. et al. Therapeutic endometrial scratching and implantation after in vitro fertilization: a multicenter randomized controlled trial. Fertil Steril. 2019;112(6):1015-1021. https://doi.org/10.1016/j.fertnstert.2019.08.010.
- Karimzade M.A., Oskouian H., Ahmadi S., Oskouian L. Local injury to the endometrium on the day of oocyte retrieval has a negative impact on implantation in assisted reproductive cycles: a randomized controlled trial. Arch Gynecol Obstet. 2010;281(3):499-503. https://doi.org/10.1007/s00404-009-1166-1.
- El-Toukhy T., Campo R., Khalaf Y., Tabanelli C., Gianaroli L., Gordts S.S. et al. Hysteroscopy in recurrent in-vitro fertilisation failure (TROPHY): a multicentre, randomised controlled trial. Lancet. 2016;387(10038):2614-2621. https://doi.org/10.1016/S0140-6736(16)00258-0.
- Narvekar S.A., Gupta N., Shetty N., Kottur A., Srinivas M., Rao K.A. Does local endometrial injury in the nontransfer cycle improve the IVF-ET outcome in the subsequent cycle in patients with previous unsuccessful IVF? A randomized controlled pilot study. J Hum Reprod Sci. 2010;3(1):15-19. https://doi.org/10.4103/0974-1208.63116.
- Seval M.M., Şükür Y.E., Özmen B., Kan Ö., Sönmezer M., Berker B., Atabekoğlu C. Does adding endometrial scratching to diagnostic hysteroscopy improve pregnancy rates in women with recurrent in-vitro fertilization failure? Gynecol Endocrinol. 2016;32(12):957-960. https://doi.org/10.1080/09513590.2016.1190818.
- Mitic D., Basic M., Petric A., Stamenovic S. The effects of local endometrial injury made by hysteroscopy on in vitro fertilization outcome. Vojnosanit Pregl. 2018;75(6):570-575. https://doi.org/10.2298/VSP160526233M.
- Günther V., von Otte S., Maass N., Alkatout I. Endometrial “Scratching” An update and overview of current research. J Turk Ger Gynecol Assoc. 2020;21(2):124-129. https://doi.org/10.4274/jtgga.galenos.2020.2019.0175.
- Karimzadeh M.A., Ayazi Rozbahani M., Tabibnejad N. Endometrial local injury improves the pregnancy rate among recurrent implantation failure patients undergoing in vitro fertilisation/intra cytoplasmic sperm injection: A randomised clinical trial. Aust N Z J Obstet Gynaecol. 2009;49(6):677-680. https://doi.org/10.1111/j.1479-828X.2009.01076.x.
- Gibreel A., El-Adawi N., Elgindy E., Al-Inany H., Allakany N., Tournaye H. Endometrial scratching for women with previous IVF failure undergoing IVF treatment. Gynecol Endocrinol. 2015;31(4):313-316. https://doi.org/10.3109/09513590.2014.994603.
- Kanazawa E., Nakashima A., Yonemoto K., Otsuka M., Yoshioka N., Kuramoto T. et al. Injury to the endometrium prior to the frozen-thawed embryo transfer cycle improves pregnancy rates in patients with repeated implantation failure. J Obstet Gynaecol Res. 2017;43(1):128-134. https://doi.org/10.1111/jog.13182.
- Metwally M., Chatters R., White D., Hall J., Walters S. Endometrial scratch in women undergoing first-time IVF treatment: a systematic review and meta-analysis of randomized controlled trials. Reprod Biomed Online. 2022;44(4):617-629. https://doi.org/10.1016/j.rbmo.2021.11.021.
- Li W., Suke S., Wertaschnigg D., Lensen S., Wang R., Gurrin L., Mol B.W. Randomised controlled trials evaluating endometrial scratching: assessment of methodological issues. Hum Reprod. 2019;34(12):2372-2380. https://doi.org/10.1093/humrep/dez207.
- Makrigiannakis A., Petsas G., Toth B., Relakis K., Jeschke U. Recent advances in understanding immunology of reproductive failure. J Reprod Immunol. 2011;90(1):96-104. https://doi.org/10.1016/j.jri.2011.03.006.
- Koot Y.E.M., van Hooff S.R., Boomsma C.M., van Leenen D., Groot Koerkamp M.J., Goddijn M. et al. An endometrial gene expression signature accurately predicts recurrent implantation failure after IVF. Sci Rep. 2016;(6):19411. https://doi.org/10.1038/srep19411.
- Lin L.J., Liu J., Xu L.Z., Chen H. The impact of endometrial mechanical stimulation in women with normal hysteroscopic findings undergoing IVF/ ICSI: a meta-analysis. Clin Exp Obstet Gynecol. 2022;49(1):027. https://doi.org/10.31083/j.ceog4901027.
- Li L., Shi J., Zhang Q.F., Yan J., Yan L.Y., Shen F. et al. Effect of curettage and copper wire on rabbit endometrium: a novel rabbit model of endometrial mechanical injury. Chin Med J (Engl). 2011;124(11):1708-1713. Available at: https://journals.lww.com/cmj/Fulltext/2011/07000/Effect_of_curettage_and_copper_wire_on_rabbit.20.aspx