Журнал "Медицинский совет" №15/2023
DOI: 10.21518/ms2023-295
И.О. Боровиков, И.И. Куценко, О.И. Боровикова, А.А. Андреева, Л.А. Филиппова, В.А. Авакимян, Ю.В. Никогда; Кубанский государственный медицинский университет; 350063, Россия, Краснодар, ул. Митрофана Седина, д. 4
Введение. В статье рассмотрен опыт лечения пациенток с рецидивирующим вульвовагинальным кандидозом в сочетании со смешанным вагинальным дисбиозом – вариант комплексной локальной терапии препаратами, содержащими сертаконазола нитрат и бензилдиметил[3-(миристоиламино)пропил]аммоний хлорид моногидрат.
Цель. Оценить эффективность местной терапии пациенток с рецидивирующей формой вульвовагинального кандидоза на фоне смешанного неспецифического вагинального дисбиоза.
Материалы и методы. Проведено проспективное открытое рандомизированное клиническое исследование оценки результатов лечения препаратами, содержащими сертаконазола нитрат в дозе 300 мг (Флюковаг®, вагинальные суппозитории 2 раза с промежутком в 7 дней) и бензилдиметил [3-(миристоиламино)пропил]аммоний хлорид моногидрат в дозе 15 мг (Мирамистин®, вагинальные суппозитории 1 раз в сутки на ночь в течение 10 дней) женщин со смешанными неспецифическими инфекционными заболеваниями влагалища на фоне рецидивирующего вульвовагинального кандидоза (n = 68). Методы: оценка состояния вагинальной микробиоты – ПЦР «АмплиПрайм® ФлороЦеноз / Бактериальный вагиноз-FL» (ООО «НекстБио», Российская Федерация), pH вагинального секрета, критерии Hay – Ison, оценка чувствительности к антимикотикам Candida spp. (стандарты NCCLS).
Результаты и обсуждение. Представленный опыт локальной комплексной терапии пациенток с рецидивирующим вульвовагинальным кандидозом в сочетании со смешанным вагинальным дисбиозом с использованием препаратов, содержащих сертаконазола нитрат (Флюковаг®) и бензилдиметил[3-(миристоиламино)пропил]аммоний хлорид моногидрат (Мирамистин®), с последующей контаминацией пробиотиком показал высокую клиническую (94,1 ± 2,3%) и микробиологическую (81,9 ± 2,1%) эффективность, сопровождающуюся безопасностью и удовлетворительной комплаентностью.
Заключение. Комплексный подход к лечению смешанных неспецифических форм вагинального дисбиоза на фоне рецидивирующего вульвовагинального кандидоза обладает высокой клинической эффективностью и удовлетворительным комплаенсом.
Для цитирования: Боровиков И.О., Куценко И.И., Боровикова О.И., Андреева А.A., Филиппова Л.А., Авакимян В.А., Никогда Ю.В. Возможности локальной терапии рецидивирующего кандидоза на фоне смешанного вагинального дисбиоза. Медицинский Совет. 2023;(15):83-93. https://doi.org/10.21518/ms2023-295
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Possibilities of local therapy of recurrent candidiasis against the background of mixed vaginal dysbiosis
Igor O. Borovikov, Irina I. Kutsenko, Olga I. Borovikova, Anastasia A. Andreeva, Lyudmila A. Filippova, Veronika A. Avakimyan, Julia V. Nikogda; Kuban State Medical University; 4, Mitrofan Sedin St., Krasnodar, 350063, Russia
Introduction. The article describes the experience of treating patients with recurrent vulvovaginal candidosis combined with mixed vaginal dysbiosis using a variant of complex local therapy with drugs containing sertaconazole nitrate and benzyldimethyl-[3-(myristoylamino) propyl] ammonium chloride monohydrate.
Aim. To evaluate the efficacy of local therapy in patients with recurrent vulvovaginal candidosis with underlying mixed non-specific vaginal dysbiosis.
Materials and methods. A prospective open randomized clinical trial to evaluate the outcomes of treatment with drugs containing sertaconazole nitrate at a dose of 300 mg (Flucovag® , vaginal suppositories, two times with an interval of 7 days) and benzyl-dimethyl-[3-(myristoylamino)propyl] ammonium chloride monohydrate at a dose of 15 mg (Miramistin® vaginal suppositories once a day at bedtime for 10 days) in women with mixed nonspecific infectious vaginal diseases with underlying recurrent vulvovaginal candidosis (n = 68) was conducted. Methods: vaginal microbiota evaluation with AmpliPrime® Florocenosis/Bacterial vaginosis-FL PCR (NextBio LLC, Russian Federation), vaginal pH, Hay/Ison scoring criteria, antimycotic sensitivity evaluation against Candida spp. (NCCLS standards).
Results and discussion. This kind of local complex therapy in patients with recurrent vulvovaginal candidosis combined with mixed vaginal dysbiosis using drugs containing sertaconazole nitrate (Flucovag® ) and benzyl-dimethyl [3-(myristoylamino) propyl]ammonium chloride monohydrate (Miramistin ® ), followed by probiotic contamination showed high clinical (94.1 ± 2.3%) and microbiological (81.9 ± 2.1%) efficacy combined with safety and satisfactory compliance.
Conclusion. A comprehensive approach to the treatment of mixed nonspecific vaginal dysbiosis with underlying recurrent vulvovaginal candidosis showed high clinical efficacy and satisfactory compliance.
For citation: Borovikov I.O., Kutsenko I.I., Borovikova O.I., Andreeva A.A., Filippova L.A., Avakimyan V.A., Nikogda J.V. Possibilities of local therapy of recurrent candidiasis against the background of mixed vaginal dysbiosis. Meditsinskiy sovet = Medical Council. 2023;(15):83-93. (In Russ.) https://doi.org/10.21518/ms2023-295
Conflict of interest: the authors declare no conflict of interest.
Введение
Вульвовагинальный кандидоз и неспецифический вульвовагинит / вагинальный дисбиоз являются
одной из наиболее распространенных причин обращения женщин к врачам – акушерам-гинекологам:
около 75–80% женщин имеют эпизод кандидозного вагинита по крайней мере один раз
в течение жизни, а у 9-45% из них ВВК носит рецидивирующий характер, что
способствует формированию высокого стрессового уровня у таких пациенток [1-3].
Обычно
вульвовагинальный кандидоз индуцируется различными провоцирующими факторами,
включая факторы хозяина, локальные иммунные механизмы, соматическую патологию,
беременность, изменение биохимического состава вагинального секрета, нерациональную
антибактериальную терапию, дисгормональные расстройства и различный уровень
сексуальной активности [4–6]. При этом в большинстве случаев не представляется
возможным определить тот или иной триггер, ответственный за рецидив [1, 3, 5]. Несмотря
на то что в России преобладающим видом, ответственным за проявления вульвовагинального
кандидоза, является Candida albicans,
все больше исследований подтверждают наличие других (non-albicans) видов грибов семейства Candida, таких как C.
glabrata, C. tropicalis, C. krusei и C. parapsilosis, которые довольно часто отвечают за рецидивирующее
течение заболевания 6, [7]. При этом инфекции, вызванные non-albicans-штаммами Candida,
часто не реагируют на обычные дозы антимикотиков первой линии, что требует альтернативных
подходов к терапии [9–11].
Еще
одной проблемой современной клинической гинекологии является распространение
смешанных форм вульвовагинальной инфекции, когда на фоне персистирующей
кандидозной флоры развивается другая патогенная и особенно условно-патогенная
микрофлора, способствующая образованию патологических сообществ, бактериальной
биопленки на эпителиоцитах влагалища, что не только усложняет этиологическую
диагностику такого рода патологических процессов, но и серьезно мешает
проведению этиотропной терапии [7–9]. Неспецифические смешанные вагинальные
инфекции в настоящее время становятся все более актуальной проблемой, они широко
распространены (30–80% от всех инфекционных заболеваний вульвы и влагалища) и
не только способны клинически изменять состояние женщины за счет наличия патологических
выделений из влагалища, неприятного запаха, зуда и диспареунии, но также быть
кофактором в репликации вирусов, ответственных за злокачественную
неопластическую трансформацию, и отрицательно влиять на фертильность [2, 4, 12].
Для
лечения смешанной неспецифической вульвовагинальной инфекции необходим
комплексный подход для наиболее широкого поражения патологических
этиологических факторов со способностью к разрушению биопленки, но с
минимальным влиянием на лактофлору влагалища [3, 5, 13, 14]. При этом предпочтение следует отдавать
местным формам лекарственных препаратов, что помогает избежать ряда побочных
эффектов, вызванных системным приемом [3, 14, 15]. Однако наиболее
распространенные вагинальные лекарственные формы (кремы, таблетки и растворы)
имеют ряд недостатков, таких как вытекание из влагалища и короткое время действия,
требующее длительного применения. Данные неудобства могут быть преодолены путем
применения препаратов с высокими мукоадгезивными свойствами, что увеличивает длительность
их воздействия и всасывание через слизистую оболочку влагалища [3, 7, 16].
Такими свойствами обладает препарат в виде вагинальных суппозиториев,
содержащий сертаконазола нитрат и являющийся производным имидазола и
бензотиофена, который не только обладает широким (фунгицидным и
фунгистатическим) спектром действия в отношении грибов рода Candida spp. (в том числе non-albicans), но и способствует элиминации патогенной и
условно-патогенной микрофлоры нижнего отдела гениталий, таких как Streptococcus, Staphylococcus, а также Gardnerella vaginalis, Enterococcus faecalis и Bacteroides, за счет способности подавлять синтез эргостерола, входящего в состав мембран грибковых и бактериальных клеток, одновременно конкурируя с другим ее компонентом – триптофаном, что приводит к дезорганизации и увеличению проницаемости клеточной мембраны, деструкции и элиминации микроорганизма [17–19 [ПМ1] ]. Кроме того, бензотиофен, обладающий высокими липофильными свойствами, что помогает проникновению препарата в ткани, способствует уменьшению симптомов воспаления [18].
Учитывая, что одной из наиболее серьезных проблем медицины является устойчивость к существующим на данный момент антибактериальным препаратам, все больше внимания уделяется антисептическим средствам, для которых эта проблема не так актуальна. И в данной ситуации особенно интересным является локальное применение такого соединения, как бензилдиметил[3-(миристоиламино)пропил]аммоний хлорид, известного под названием Мирамистин®, обладающего широким спектром антимикробного и даже антимикотического и противовирусного действия, оказывающего бактерицидное действие в отношении как грамположительных, так и грамотрицательных микроорганизмов, а также анаэробных бактерий (самостоятельно, в ассоциациях и биопленке), включая штаммы с резистентностью к антибиотикам [20]. При этом не было проведено широких исследований по эффективности применения влагалищных (в виде суппозиториев) форм этого препарата.
Цель исследования – оценить эффективность местной терапии пациенток с рецидивирующей формой вульвовагинального кандидоза на фоне смешанного неспецифического вагинального дисбиоза.
Материалы и методы
Дизайн исследования: проспективное открытое рандомизированное клиническое. Обследованы женщины (n = 68) с диагнозом «смешанное неспецифическое инфекционное заболевание влагалища» (шифры по Международной классификации болезней 10-го пересмотра: N89. Другие невоспалительные заболевания влагалища;
N76.1 Подострый и хронический вагинит; В37.3 Кандидоз вульвы и вагины),
проведено их лечение. Обследование согласно приказу Минздрава России №1130н от
20.10.2020 г. «Об утверждении Порядка оказания медицинской помощи по профилю
«акушерство и гинекология» и клиническим протоколам «Бактериальный вагиноз»
(год утверждения 2022), «Воспалительные болезни шейки матки, влагалища и
вульвы» (год утверждения 2021). Исследовательская клиническая база – кафедра
акушерства, гинекологии и перинатологии Кубанского государственного
медицинского университета.
Исследуемые
получали локальную комплексную антимикотическую и антибактериальную терапию
двумя препаратами:
1) антимикотическое
средство, содержащее сертаконазола нитрат в дозе 300 мг (Флюковаг®, АО
Отисифарм, Россия; код анатомо-терапевтическо-химической классификации (ATX):
G01AF (производные имидазола) №ЛП-007371 от 08.09.2021), – вагинальные
суппозитории 2 раза с промежутком в 7 дней;
2) антисептическое
средство (миристоиламино)пропил]аммоний хлорид моногидрат в дозе 15 мг (Мирамистин®,
ООО «ИНФАМЕД», Россия; код ATX: G01AX (противомикробные препараты и антисептики
другие) №ЛП-008114 от 28.04.2022) – вагинальные суппозитории 1 раз в сутки на
ночь в течение 10 дней.
После
лечения проводилась контаминация лактобактериями (пробиотик, содержащий L.
casei rhamnosus Doderleini).
Всего исследуемые пациентки совершали 5 визитов (табл. 1).
Таблица 1. График исследований пациенток
| Исследование | Визит (день) | ||||
| 1 | 2 (3–4-й день) | 3 (14-й день после окончания терапии) | 4 (3-й месяц после окончания терапии) | 5 (6-й месяц после окончания терапии) | |
| Информированное согласие, сбор анамнеза, обследование (приказ МЗ РФ 1130н, КП), забор биологического материала | + | – | – | – | – |
| Верификация диагноза → рандомизация → назначение лечения | – | + | – | – | – |
| Оценка вагинальной микрофлоры (pH, микроскопия, полимеразная цепная реакция, культуральный – Candida spp.) | – | + | + | + | + |
| Контроль эффективности терапии и комплаенса | – | – | + | + | + |
Основные
критерии включения:
– клинико-анамнестические
признаки рецидивирующего вульвовагинального кандидоза (3 и более обострения в год на протяжении 3 и
более лет), признаки вагинального дисбиоза;
– верификация Candida spp., ПЦР-детекция (полимеразная
цепная реакция) микрофлоры, ассоциированной с вагинальным дисбиозом;
– информированное
добровольное согласие.
Методы исследования: бактериоскопия соскобов из уретры, влагалища
и цервикального канала (окраска по Граму) с оценкой микробиоценоза по критериям Hay – Ison (4 степени); pH-метрия
вагинального содержимого (экспресс-тест FemExam – диапазон 3,0–7,0). ПЦР-анализ
в режиме реального времени проводился на отечественной тест-системе
(«АмплиПрайм® ФлороЦеноз / Бактериальный вагиноз-FL»). Детекция Candida spp. – методы
прямой микроскопии и культуральный с определением чувствительности Candida
spp. к антимикотикам – протокол CLSIM27-A3 (метод микроразведений в жидких
питательных средах с титрованием субстанции антимикотиков в концентрациях от
128 до 0,03 мкг/мл) – стандарт NCCLS (National Committee for Clinical Laboratory Standards).
Критерии эффективности лечения: исчезновение клинической симптоматики и микробиологическая
санация, отсутствие рецидивов заболевания в течение всего периода наблюдения.
Комплаентность
лечения оценивалась по клинико-психологической тестовой методике (шкала Мориски
– Грина) [22], также определялось наличие нежелательных побочных явлений в виде
аллергических и общесоматических реакций.
Анализ полученных данных: методы описательной статистики с вычислением средней
арифметической и ее стандартной ошибки (различия считались достоверными при р <
0,05).
Результаты
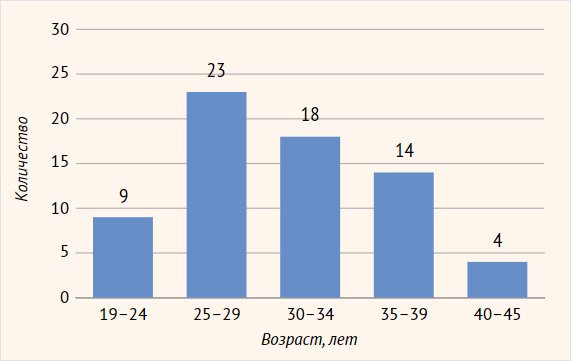
Наблюдалось 68 женщин (средний возраст 26,4 ± 3,1 года) с
диагнозом «смешанное неспецифическое инфекционное заболевание влагалища» и «рецидивирующий
вульвовагинальный кандидоз» (рис. 1).
Рисунок 1. Распределение пациенток по возрасту
Средняя длительность генитального кандидоза составляла 3,8
± 1,5 года (95% доверительный интервал (ДИ) 3–8 лет), частота рецидивов была в
среднем 3,9 ± 1,4 раза в год (95% ДИ 3–6).
Субъективными клиническими признаками заболевания
являлись предъявляемые большинством женщин исследуемой группы жалобы на патологические
выделения различной интенсивности из половых путей с неприятным запахом (92,6%;
63/68), зуд в области вульвы и влагалища (88,2%; 60/68), болезненность при
мочеиспускании (45,6%; 31/68) и во время полового акта (диспареуния) (64,7%;
44/68). Объективное гинекологическое исследование у всех (100%) пациенток
показало воспалительный процесс в области влагалища, сопровождающийся
гиперемией, отеком слизистой и патологическим характером белей; цервицит диагностирован
у 47,1% (32/68) пациенток.
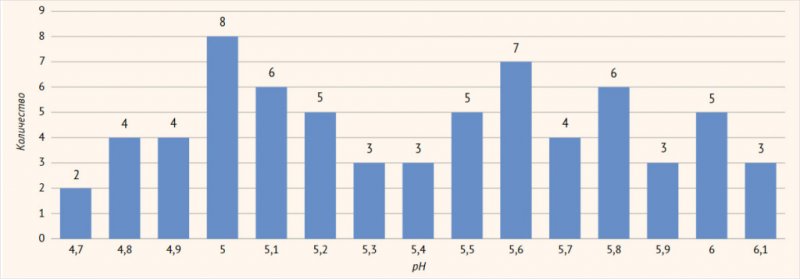
Исследование кислотности вагинального секрета показало
средний pH у исследуемого контингента пациенток – 4,9 ± 1,2 (95% ДИ 4,7–6,1; р <
0,05), свидетельствующий, что несмотря на верифицированный диагноз «рецидивирующий
вульвовагинальный кандидоз», у большинства пациенток детектируется ощелачивание
вагинального секрета за счет присутствия анаэробной микрофлоры (рис. 2).
Рисунок
2.
pH
вагинального секрета
Микроскопическая картина соответствовала критериям
вагинального дисбиоза на фоне грибковой контаминации: клетки, гифы или мицелий
дрожжевых грибов определялись у 100% женщин, ключевые клетки – у 69,1% (47/68),
повышенное количество (более 10 в поле зрения) кокковой флоры (грамположительные/грамотрицательные)
– у 64,7% (44/68), палочковой – у 60,3% (41/68), клеток Mobiluncus – у 39,7% (27/68). Лактобациллярная микрофлора в достаточном
количестве (не менее 5 в поле зрения) не определялась у всей когорты
обследуемых.
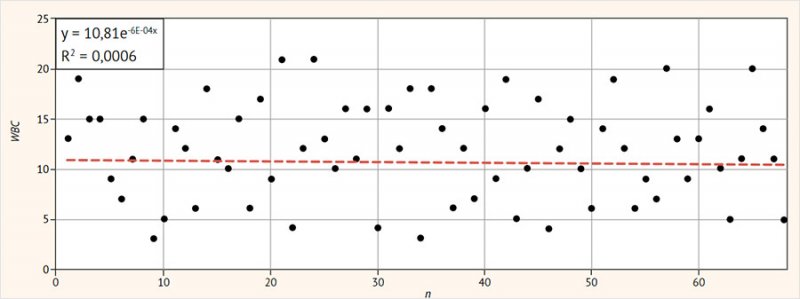
Среднее количество лейкоцитов во влагалищных мазках
составляло 10,8 ± 4,4 с высоким разбросом значений (95% ДИ 4–21; р < 0,05) (рис. 3).
Рисунок 3. Количество лейкоцитов
в вагинальных мазках
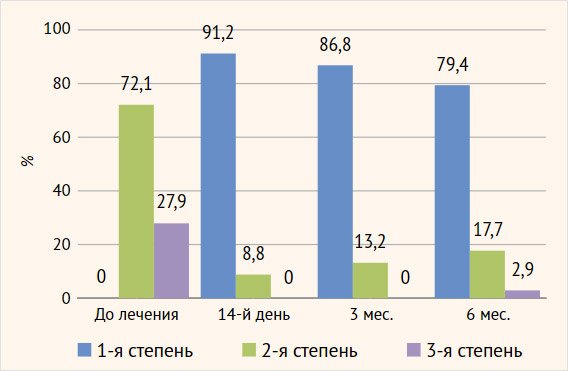
Оценка вагинального микробиоценоза (критерии
Hay – Ison) показала вторую (промежуточную) и третью (бактериальный
вагиноз) степень в 72,1% (49/68) и 27,9% (19/68) случаев соответственно.
ПЦР-анализ в режиме реального времени у данного
контингента женщин выявил преобладание анаэробной условно-патогенной флоры с измененным
коэффициентом соотношений концентраций ДНК Lactobacillus
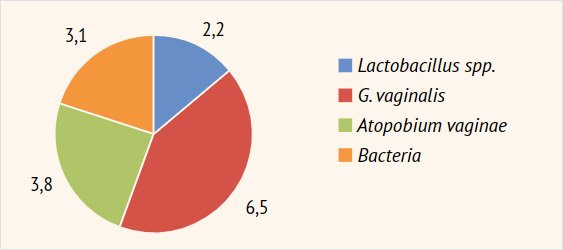
spp. и G. vaginalis, Atopobium vaginae, а также общего
количества бактерий (Bacteria) (рис. 4).
Рисунок 4. Таксономия
вагинальной микробиоты (ПЦР), lg GE/ml
Проведенное микробиологическое исследование показало, что
преобладающим этиологическим фактором является C. albicans (самостоятельно и в ассоциациях – 76,5%), при этом
клиническое значение имеют достаточно часто встречающиеся грибы C. parapsilosis – 16,2% и C. tropicalis – 11,8% (рис. 5).
Рисунок
5. Таксономия грибов Candida spp. (n = 68)

Все выделенные у пациенток штаммы С. albicans оказались наиболее чувствительны к миконазолу и сертаконазолу
(минимальная ингибирующая концентрация (МИК) для миконазола – 0,125 мкг/мл и
менее, для сертаконазола – 0,03 мкг/мл и менее с количеством чувствительных
штаммов 80,5 и 98,6% соответственно) (табл.
2).
Таблица 2. Чувствительность Candida spp. к антимикотикам
Candida spp. | Минимальная ингибирующая концентрация, мкг/мл | ||||||||
Miconazole | Ketoconazole | Sertaconazole | |||||||
П-МИК | Б-МИК 50 | Б-МИК 80 | П-МИК | Б-МИК 50 | Б-МИК 80 | П-МИК | Б-МИК 50 | Б-МИК 80 | |
C. albicans (n = 52) | 0,03–0,125 | 64–128 | 128 | 0,25–0,5 | 0,25–4 | 1–8 | 0,015–0,03 | 0,03–0,06 | 0,25 |
80,5% | 37,5% | 98,6% | |||||||
C. parapsilosis (n = 11) | 0,25 | 128 | 128 | 0,06–0,125 | 34–64 | 64 | 0,015–0,03 | 0,03–0,06 | 0,125–0,25 |
58,6% | 25,7% | 92,8% | |||||||
C. tropicalis (n = 8) | 0,25–0,5 | 0,5–4 | 1–8 | 0,03–4 | 64 | 128 | 0,015–0,03 | 0,25 | 0,25 |
57,9% | 31,6% | 94,7% | |||||||
C. glabrata (n = 6) | 0,03–0,06 | 16 | 32 | 0,25–0,5 | 0,5–4 | 1–8 | 0,03 | 0,06 | 0,03 |
75,7% | 21,6% | 89,2% | |||||||
C. krusei (n = 4) | 0,25 | 0,5–1 | 1 | 0,06–0,125 | 34–64 | 64 | 0,015 | 0,03 | 0,03 |
37,5% | 25,0% | 87,5% | |||||||
C. kefyr (n = 4) | 0,03–32 | 0,06 | 16 | 0,5 | 2 | 16 | 0,03 | 0,06 | 0,03 |
69,7% | 44,3% | 91,4% | |||||||
Примечание. П-МИК – минимальная ингибирующая
концентрация планктонных микроорганизмов; Б-МИК50, Б-МИК80 – концентрация
антимикотика со снижением оптической плотности в биопленках на 50 и 80%
соответственно.
Похожая картина отмечается и для других штаммов Candida spp. Так, C. parapsilosis и С. krusei, обладающие природной резистентностью к флуконазолу,
сохраняли ее и в биопленках: МИК, не влияющая на жизнеспособность
вышеперечисленных штаммов, составила 1024 мкг/мл в концентрациях как 50%, так и
80%. Кроме того, МИК, тормозящая рост биопленок, более чем в 1000 раз превышала
МИК планктонных образцов. Биопленки всех обнаруженных штаммов грибов также были
резистентны к кетоконазолу. Сертаконазол, по нашим данным, проявлял наибольшую
активность к биопленкам и планктонным образцам всех детектируемых видов Candida spp.: выделено минимальное количество резистентных штаммов
(чувствительность C. parapsilosis
составила 92,8%, C. tropicalis –
94,7%, C. glabrata – 89,2%, C. krusei – 87,5%, C. kefyr – 91,4%).
Клиническая эффективность. Через 2 нед. (14-й
день после окончания терапии) у всех пациенток отмечено достоверное (p < 0,05) уменьшение
жалоб и клинических симптомов генитального кандидоза и неспецифического
вагинального дисбиоза: патологические вагинальные выделения исчезли у 92,7%
(63/68) пациенток, зуд – у 91,2% (62/68), а болезненность при половом акте и
мочеиспускании – у 94,1% (64/68) и 98,5% (67/68) соответственно (рис. 6).
Рисунок 6. Клиническая
эффективность терапии
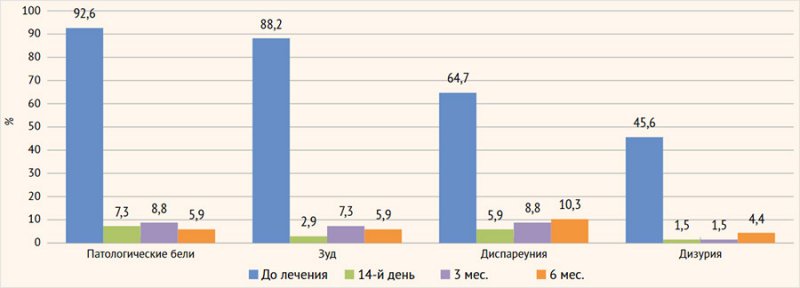
В течение полугодового мониторинга не было выявлено
существенных изменений в клинической симптоматике у исследуемого контингента
женщин: патологические бели и ощущения в виде зуда в области вульвы и влагалища
отмечены у 5,9% (4/68) пациенток, диспареуния – у 10,3% (7/68) и дизурия – у
4,4% (3/68) женщин.
После проведенной терапии (14-й день) pH вагинального
секрета снизился и составил в среднем 4,1 ± 0,3 (p < 0,05), оставаясь
на уровне нормальных значений (в среднем 4,3 ± 0,4) на всем сроке мониторинга
(6 мес.) (табл. 3). Высокие цифры pH (выше 4,5)
оставались у 5,9% (4/68) пациенток.
Таблица 3. Динамика pH, количества
лейкоцитов и цитологического коэффициента вагинального секрета в процессе терапии
| Этап лечения | pH | Количество лейкоцитов | Цитологический коэффициент |
До лечения | 4,9 ± 1,2 | 10,8 ± 4,4 | 0,8 ± 0,1 |
Через 14 дней | 4,1 ± 0,3 | 5,8 ± 1,4 | 1,5 ± 0,2 |
Через 3 месяца | 4,2 ± 0,6 | 7,3 ± 2,1 | 1,2 ± 0,1 |
Через 6 месяцев | 4,3 ± 0,4 | 7,9 ± 1,6 | 1,1 ± 0,2 |
Как указано выше, среднее количество лейкоцитов
вагинальных мазков в среднем составляло 10,8 ± 4,4 в поле зрения, а через 14
дней после лечения данный параметр уменьшился почти в 2 раза и составил 5,8 ± 1,4
(значения нормы), и через 6 мес. также наблюдалась нормэргическая лейкоцитарная
реакция – 7,9 [Я2] ± 1,6 (табл. 3). При этом лейкоцитарную реакцию
влагалища при смешанных вагинальных дисбиозах не следует рассматривать как
диагностический признак эффективности терапии, что связано с разнородностью
клинико-микробиологических проявлений при аэробно-анаэробной и кандидозной
инфекциях.
Клеточный состав пациенток с рецидивирующим генитальным
кандидозом на фоне неспецифического смешанного вагинального дисбиоза отличался
низким цитологическим коэффициентом (количество лейкоцитов / количество
эпителиальных клеток) – 0,8 ± 0,1 (табл. 3).
Через 14 дней после терапии на фоне нормализации лейкоцитарной реакции
слизистой влагалища произошло уменьшение клеток слущенного эпителия и
увеличение цитологического коэффициента до 1,5 ± 0,2, что косвенно
свидетельствует об активации репаративных процессов; через 6 мес. мониторинга
среднее значение цитологического коэффициента составило 1,1 ± 0,2 (выше
исходного).
Показанные клинические и микроскопические изменения в
исследуемой когорте больных рецидивирующим генитальным кандидозом на фоне смешанного
неспецифического вагинального дисбиоза показывают высокую клиническую
эффективность предлагаемой комплексной (антимикотической и антибактериальной)
локальной терапии данной патологии.
Микробиологическая
эффективность. Оценка вагинального биоценоза (критерии Hay – Ison)
через 2 нед. после терапии показала нормоценоз (1-я степень) у 91,2% (62/68)
пациенток, через 3 мес. количество таких пациенток незначительно уменьшилось –
86,8% (59/68) и к полугодовому сроку мониторинга составило 79,4% (54/68) (рис. 7).
Рисунок 7. Динамика
вагинального биоценоза (критерии Hay – Ison)
Бактериоскопия вагинальных мазков на 14-й день после
лечения выявила наличие клеток, гиф и мицелия Candida spp. у 8,8% (6/68) женщин, в течение полугодового мониторинга
количество таких пациенток возросло соответственно до 16,2% (11/68) и 22,1% (15/68).
ПЦР-оценка клинической эффективности лечения смешанных
вагинальных дисбиозов на фоне рецидивирующего вульвовагинального кандидоза
через 14 дней после лечения зарегистрировала достоверное увеличение количества
лактобактерий у пролеченных женщин: в среднем с 2,2 ± 0,15 до 10,4 ± 2,3 lg
GE/ml (p < 0,05): пациентки с нормальным количеством лактофлоры составили
95,6% (65/68), что, по-видимому, было обусловлено назначением контаминационной
терапии пробиотиком, содержащим L. casei rhamnosus Doderleini. При этом
в тот же промежуток времени отмечается существенное (более чем в 4 раза) снижение
G. vaginalis – с 6,5 ± 1,1 до 1,4 ± 0,15
lg GE/ml (p < 0,05) (G. vaginalis выявлена
у 6/68; 8,8% пациенток) и A. vaginae –
с 3,8 ± 0,6 до 0,9 ± 0,05 lg GE/ml (детекция у 3/68; 4,4% женщин), а также грамположительной
и грамотрицательной аэробной условно-патогенной микрофлоры (Bacteria) с 3,1 ± 0,4 до
0,3 ± 0,01 lg GE/ml (p < 0,05). Также на фоне проведенной терапии отмечено
практически полное исчезновение количества грибов рода Candida spp. (0,4 ± 0,01 lg GE/ml): их ДНК определена в минимальных
количествах у 7/68 (10,3%) пациенток (рис.
8).
Рисунок 8. Динамика
вагинальной микробиоты (ПЦР)
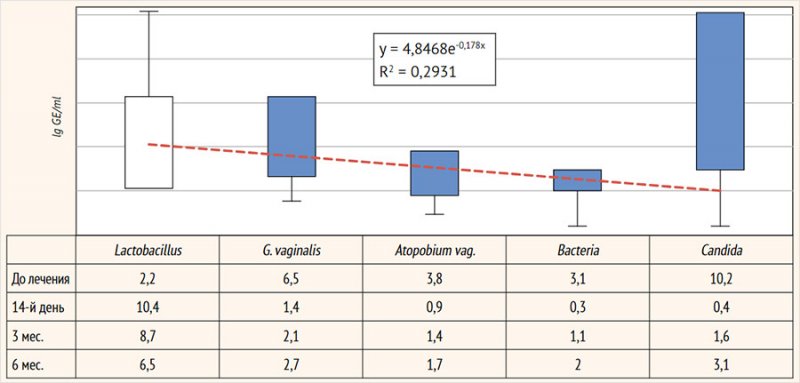
Через 6 мес. после лечения зафиксировано некоторое
снижение количества ДНК лактобациллярной микрофлоры – 6,5 ± 1,3 lg GE/ml
(отсутствие на данном сроке эффекта от терапии пробиотиками) с некоторым
увеличением, не достигающим исходных значений, ДНК G. vaginalis и A. vaginae –
2,7 ± 0,5 и 1,7 ± 0,3 lg GE/ml соответственно, а также условно-патогенной
аэробной микрофлоры – 2,0 ± 0,2 lg GE/ml. ПЦР-детекция G. vaginalis на этом сроке отмечена у 11,8% (8/68) пациенток, A. vaginae – у 13,2% (9/68), а аэробной
условно-патогенной микрофлоры (Bacteria) – у 10,3%
(7/68) женщин.
Коэффициент соотношений
(КС) ДНК лактофлоры
и анаэробов (G. vaginalis и Atopobium vag.), исходно равный 0,3 ± 0,15 (КС менее 0,5 соответствует
вагинальному дисбиозу), на 14-й день после окончания терапии вырос до 2,4 ± 1,1
(КС более 1 – вагинальный дисбиоз не установлен), 6-месячная детекция показала
некоторое снижение КС, не выходящее за пределы нормальных значений (1,8 ± 0,6),
что может свидетельствовать об эффективности предлагаемого комплексного
лечения. КС ниже референсных значений (менее 0,5) при наблюдении в течение 6 мес. оставался у 13,2% (9/68)
пациенток.
Анализ динамики штаммов Candida spp. выявил, что через
2 нед. после окончания лечения C. albicans (самостоятельно и в ассоциациях) детектировалась в клинических
концентрациях у 7,3% (5/68) женщин (исходно 76,5%), а через 6 мес. таких пациенток
стало 17,6% (12/68) – увеличилось в 2,4 раза (табл. 4). C. parapsilosis, обнаруживаемая
исходно у 16,2% (11/68) пациенток, через 2 нед. после лечения выявлена лишь у 1
женщины (1,5%), а C. tropicalis и C. glabrata – у 2 (2,9%). При наблюдении в течение 6 мес. заметная
отрицательная динамика отмечена для C. albicans, которая выявлена у 16,2% (11/68) женщин, что может, с одной стороны, быть
объяснено устойчивостью данных грибов к предлагаемому антимикотику (хотя
первичная детекция не выявила устойчивых штаммов, что подтверждает их
отсутствие на 14-дневном сроке наблюдения), а с другой – нарушением локального
гомеостаза влагалища, способствующего повторной контаминации данным видом
грибов и рецидивам данной инфекции. C. krusei и C. kefyr после
лечения не определялись на всех сроках мониторинга.
Таблица 4. Динамика изменения грибов рода Candida spp. в процессе терапии, n/%
Этап лечения | C. albicans | C. glabrata | C. tropicalis | C. parapsilosis | C. krusei | C. kefyr |
До лечения | 52/76,5% | 6/8,8% | 8/11,8% | 11/16,2% | 4/5,9% | 4/5,9% |
Через 14 день | 5/7,3% | 2/2,9% | 2/2,9% | 1/1,5% | 0/0,0% | 0/0,0% |
Через 3 месяц | 8/11,8% | 1/1,5% | 1/1,5% | 2/2,9% | 0/0,0% | 0/0,0% |
Через 6 месяцев | 11/16,2% | 1/1,5% | 2/2,9% | 0/0,0% | 0/0,0% | 0/0,0% |
Таким образом, в ходе оценки результатов проведенной
комплексной местной антимикотической и антисептической терапии выявлено, что у
женщин со смешанным неспецифическим вагинальным дисбиозом и рецидивирующим генитальным
кандидозом интравагинальное введение сертаконазола нитрата в дозе 300 мг
(суппозитории Флюковаг®) и (миристоиламино)пропил]аммония хлорида моногидрата в
дозе 15 мг (суппозитории Мирамистин®) показали высокую эффективность
клинического и микробиологического излечения с длительной ремиссией.
Комплаентность. Системных
побочных эффектов от проводимой терапии в ходе исследования не
зарегистрировано. Удовлетворительный комплаенс терапии (4 балла по шкале
Мориски – Грина) выявлен у 94,1% (64/68) пациенток. Среди нежелательных
побочных эффектов отмечено жжение во время местного применения суппозиториев
«Мирамистин®» — 4,4% (3/68). При применении суппозиториев «Флюковаг®» как
системных, так и местных нежелательных проявлений не было зарегистрировано.
Обсуждение
Рецидивирующие вульвовагинальные инфекции в настоящее
время не только стали эпидемиологической и клинической проблемой, но и имеют
серьезные социальные последствия [2, 11, 16, 22]. Понимание патогенетических
механизмов их комменсализма, совместного образования биопленок, препятствия
проникновению и адекватному терапевтическому воздействию наиболее
распространенных лекарственных средств необходимо для разработки эффективных
стратегий их терапии. Всемирная организация здравоохранения и Центр по контролю
за заболеваниями (Centers for Disease Control and Prevention – CDC)
предоставляют ежегодно обновляющиеся рекомендации по менеджменту состояний,
проявляющихся патологическими вагинальными выделениями[1] [22, 23]. При
этом, несмотря широкое применение антибактериальных и противогрибковых
препаратов, не происходит существенного сдвига в количестве вагинальных
инфекций, а, наоборот, увеличивается количество хронических рецидивирующих
течений с детектируемой смешанной (аэробно-анаэробно-грибковой)
условно-патогенной микрофлорой [1, 5, 11, 24]. Это можно объяснить, с одной
стороны, неправильно установленным диагнозом без учета всех комменсальных
микроорганизмов, участвующих в патогенезе заболевания, и, соответственно, с
другой стороны, назначением неправильного лечения, которое способствует возникновению
устойчивых штаммов микроорганизмов [3, 16, 25]. Исследования последнего десятилетия
существенно расширили представления о роли микробных вагинальных сообществ, при
этом уделяя внимание в большей степени бактериальной части микробиоценоза и
недооценивая роль грибов, которые также могут существенно изменять патогенез
смешанных вагинальных инфекций, способствуя их рецидивирующему течению и
устойчивости к проводимой терапии [1, 7, 14]. Несмотря на дискутабельность и
сложность выявления причин рецидивирующего течения вульвовагинальных инфекций,
в настоящее время считается, что этому способствуют как исходные нарушения
вагинального гомеостаза (локальные иммунные и цитобиохимические девиации), так
и в не меньшей степени резистентность микроорганизмов и обусловленное этим
сохранение остаточной инфекции, которое можно связать с нерациональным приемом
антибактериальных и антимикотических лекарственных средств и наличием
бактериально-грибковой биопленки [2, 10, 26]. Вышеперечисленные сложности
способствуют поиску новых препаратов, основными параметрами которых следует
считать преодоление устойчивости к наиболее распространенным инфекционным агентам,
участвующим в рецидивах вульвовагинальных инфекций, длительность терапевтического
воздействия и способность к разрушению бактериально-микотической биопленки и
минимальное количество побочных эффектов.
Сертаконазола нитрат представляет собой следующее
поколение антимикотиков и, являясь производным бензотиофена и имидазола,
оказывает двойное (фунгистатические и фунгицидное) действие, связанное с
ингибированием синтеза компонента клеточной стенки гриба – эргостерина,
ведущего к разрыву плазматической мембраны и, соответственно, гибели клетки, а
высокие мукоадгезивные свойства данной субстанции увеличивают длительность его
воздействия на слизистую оболочку влагалища [17–19, 25]. Длительный период нахождения
сертаконазола нитрата во влагалище позволяет препарату быть эффективным при
одно-двукратном применении [20].
Озабоченность по поводу микробной толерантности к
существующим антибактериальным препаратам стимулирует исследования альтернативных
способов локальной терапии генитальных инфекций, а именно применения антисептических
лекарственных средств. При этом, несмотря на достаточно скудную информацию по
применению (миристоиламино)пропил]аммония хлорида моногидрата (Мирамистин®) при
данной нозологии, проведенные исследования показывают оптимистичные результаты
[25]. Так, в одном недавно проведенном сравнительном исследовании (2020) эффективности
против Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli, Enterococcus faecium и C. albicans
шести антисептических препаратов – цетилпиридиния хлорида, октенидина,
повидон-йода, полигексаметилен-бигуанида, хлоргексидина и мирамистина именно
мирамистин показал наиболее существенные результаты [21].
Проведенное
исследование посвящено оценке эффективности комплексной (противогрибковой и
антисептической) терапии пациенток с рецидивирующим вульвовагинальным
кандидозом и смешанным неспецифическим вагинальным дисбиозом. Наблюдение за
пациентками после лечения проводилось в течение полугода с оценкой клинической
и микробиологической эффективности, фиксацией рецидивов заболевания. При этом
нами отмечена высокая эффективность местного применения препаратов
сертаконазола нитрата (Флюковаг®) и (миристоиламино)пропил]аммония хлорида
моногидрата (Мирамистин®) в отношении как купирования симптомов вульвовагинита
(клиническая эффективность составила 94,1 ± 2,3% (p < 0,05) в отношении
нивелирования жалоб), так и нормализации вагинального микробиоценоза (микробиологическая
эффективность – 79,4% по критериям Hay – Ison, 86,8% – по ПЦР коэффициенту
соотношений лактобактерий к анаэробной и аэробной микрофлоре, 79,4% – по
исчезновению грибов рода Candida spp.).
Заключение
Таким
образом, проведенное исследование показало высокую клиническую и
микробиологическую эффективность местной терапии противогрибковым (Флюковаг®) и
антисептическим (Мирамистин®) лекарственными препаратами при лечении пациенток
с диагнозами «рецидивирующий вульвовагинальный кандидоз» и «смешанная форма
вагинального дисбиоза», при этом характеризующееся высоким уровнем комплаенса.
Список литературы / References
- Тихомирова ЕВ, Балан ВЕ, Овчинникова ВВ. Современные взгляды на лечение при рецидивирующем урогенитальном кандидозе. Российский вестник акушера-гинеколога. 2020;20(5):116-120. https://doi.org/10.17116/rosakush202020051116.
- Мураков СВ, Владимирова ЕВ, Ковалык ВП, Маркова ЮА, Владимиров АА, Стромская УА и др. Вульвовагинальный кандидоз: актуальные аспекты этиопатогенеза, диагностики и лечения. РМЖ. Медицинское обозрение. 2020;4(10):625-631. https://doi.org/10.32364/2587-6821-2020-4-10-625-631.
- Solis NV, Park YN, Swidergall M, Daniels KJ, Filler SG, Soll DR. Candida albicans White-Opaque Switching Influences Virulence but Not Mating during Oropharyngeal Candidiasis. Infect Immun. 2018;86(6):e00774-17. https://doi.org/10.1128/IAI.00774-17.
- Fukazawa EI, Witkin SS, Robial R, Vinagre JG, Baracat EC, Linhares IM. Influence of recurrent vulvovaginal candidiasis on quality of life issues. Arch Gynecol Obstet. 2019;300(3):647-650. https://doi.org/10.1007/s00404-019-05228-3.
- Borges KRA, Pimentel IV, Lucena LCLDS, Silva MACND, Monteiro SG, Monteiro CA et al. Adhesion and biofilm formation of Candida parapsilosis isolated from vaginal secretions to copper intrauterine devices. Rev Inst Med Trop Sao Paulo. 2018;60:e59. https://doi.org/10.1590/S1678-9946201860059.
- Нейфельд ИВ, Рогожина ИЕ, Скупова ИН. Оптимизация комплексной терапии хронического рецидивирующего вульвовагинального кандидоза в амбулаторной практике. РМЖ. 2017;(2):91-97. Режим доступа: https://www.rmj.ru/articles/ginekologiya/Optimizaciya_kompleksnoy_terapii_hronicheskogo_recidiviruyuschego_vulyvovaginalynogo_kandidoza_v_ambulatornoy_praktike.
- Rosati D, Bruno M, Jaeger M, Ten Oever J, Netea MG. Recurrent Vulvovaginal Candidiasis: An Immunological Perspective. Microorganisms. 2020;8(2):144. https://doi.org/10.3390/microorganisms8020144.
- Журавлева ЮА, Болотова АВ, Гептинг НА, Паршина АН, Бунеева ЛВ. Опыт клинического применения препарата Мульти-Гин ФлораФем в практике акушера-гинеколога для профилактики рецидивов вульвовагинального кандидоза. Российский вестник акушера-гинеколога. 2022;22(2):91-96. https://doi.org/10.17116/rosakush20222202191.
- Пестрикова ТЮ, Юрасова ЕА, Ковалева ТД, Гуцалова ТБ, Темнюк ТВ, Брутян СГ. Инновационный подход к тактике ведения кандидозного вульвовагинита у беременных. Российский вестник акушера-гинеколога. 2022;22(4):118-125. https://doi.org/10.17116/rosakush202222041118.
- Погосян ШМ, Межевитинова ЕА, Донников АЕ, Прилепская ВН, Бурменская ОВ, Непша ОС, Быстрицкий АА. Генетическая предрасположенность к рецидивирующему течению вульвовагинального кандидоза. Гинекология. 2017;19(4):20-25. Режим доступа: https://gynecology.orscience.ru/2079-5831/article/view/28626.
- Боровиков ИО, Куценко ИИ, Рубинина ЭР. Опыт клинического менеджмента смешанных инфекций урогенитального тракта у женщин. РМЖ. Мать и дитя. 2018;1(1):26-32. https://doi.org/10.32364/2618-8430-2018-1-1-26-32.
- Sun Z, Ge X, Qiu B, Xiang Z, Jiang C, Wu J, Li Y. Vulvovaginal candidiasis and vaginal microflora interaction: Microflora changes and probiotic therapy. Front Cell Infect Microbiol. 2023;13:1123026. https://doi.org/10.3389/fcimb.2023.1123026.
- Paterniti I, Casili G, Filippone A, Lanza M, Ardizzone A, Capra AP et al. A New Approach for the Treatment of Recurrent Vulvovaginal Candidiasis with a Combination of Pea Protein, Grape Seed Extract, and Lactic Acid Assessed In Vivo. J Fungi (Basel). 2022;8(12):1251. https://doi.org/10.3390/jof8121251.
- Phillips NA, Rocktashel M, Merjanian L. Ibrexafungerp for the Treatment of Vulvovaginal Candidiasis: Design, Development and Place in Therapy. Drug Des Devel Ther. 2023;17:363-367. https://doi.org/10.2147/DDDT.S339349.
- Мгерян АН. Вульвовагинальный кандидоз: эффективность терапии клотримазолом. Эффективная фармакотерапия. 2019;15(26):36-41. Режим доступа: https://umedp.ru/articles/vulvovaginalnyy_kandidoz_effektivnost_terapii_klotrimazolom_.html.
- Hatamiazar M, Mohammadnejad J, Khaleghi S. Chitosan-Albumin Nanocomposite as a Promising Nanocarrier for Efficient Delivery of Fluconazole Against Vaginal Candidiasis. Appl Biochem Biotechnol. 2023. https://doi.org/10.1007/s12010-023-04492-z.
- Кутуева ФР, Глушаков РИ, Тапильская НИ, Николаева АЕ, Поромов АА, Пустотина ОА. Флюковаг: эффективность и безопасность применения у пациенток с вульвовагинальным кандидозом. Проспективное многоцентровое открытое рандомизированное сравнительное клиническое исследование. Гинекология. 2023;25(1):55-61. https://doi.org/10.26442/20795696.2023.1.202037.
- Albash R, Elmahboub Y, Baraka K, Abdellatif MM, Alaa-Eldin AA. Ultradeformable liposomes containing terpenes (terpesomes) loaded fenticonazole nitrate for treatment of vaginal candidiasis: Box-Behnken design optimization, comparative ex vivo and in vivo studies. Drug Deliv. 2020;27(1):1514-1523. https://doi.org/10.1080/10717544.2020.1837295.
- Abdellatif MM, Khalil IA, Elakkad YE, Eliwa HA, Samir TM, Al-Mokaddem AK. Formulation and Characterization of Sertaconazole Nitrate Mucoadhesive Liposomes for Vaginal Candidiasis. Int J Nanomedicine. 2020;15:4079-4090. https://doi.org/10.2147/IJN.S250960.
- Rembe JD, Thompson VD, Stuermer EK. Antimicrobials cetylpyridiniumchloride and miramistin demonstrate non-inferiority and no “protein-error” compared to established wound care antiseptics in vitro. AIMS Microbiol. 2022;8(4):372-387. https://doi.org/10.3934/microbiol.2022026.
- Morisky DE, Green LW, Levine DM. Concurrent and predictive validity of a self-reported measure of medication adherence. Med Care. 1986;24(1):67-74. https://doi.org/10.1097/00005650-198601000-00007.
- Kalia N, Singh J, Kaur M. Microbiota in vaginal health and pathogenesis of recurrent vulvovaginal infections: a critical review. Ann Clin Microbiol Antimicrob. 2020;19(1):5. https://doi.org/10.1186/s12941-020-0347-4.
- Swidsinski A, Guschin A, Tang Q, Dörffel Y, Verstraelen H, Tertychnyy A et al. Vulvovaginal candidiasis: histologic lesions are primarily polymicrobial and invasive and do not contain biofilms. Am J Obstet Gynecol. 2019;220(1):91.e1-91.e8. https://doi.org/10.1016/j.ajog.2018.10.023.
- Kalia N, Singh J, Sharma S, Kaur M. SNPs in 3’-UTR region of MBL2 increases susceptibility to recurrent vulvovaginal infections by altering sMBL levels. Immunobiology. 2019;224(1):42-49. https://doi.org/10.1016/j.imbio.2018.10.009.
- Эфендиева ЗН. Сертаконазол в терапии вульвовагинального кандидоза. Медицинский совет. 2019;(13):94-98. https://doi.org/10.21518/2079-701X-2019-13-94-98.
- Swingler S, Gupta A, Gibson H, Heaselgrave W, Kowalczuk M, Adamus G, Radecka I. The Mould War: Developing an Armamentarium against Fungal Pathogens Utilising Thymoquinone, Ocimene, and Miramistin within Bacterial Cellulose Matrices. Materials (Basel). 2021;14(10):2654. https://doi.org/10.3390/ma14102654.