Журнал "Медицинский совет" №21/2023
DOI: 10.21518/ms2023-427
А.В. Перетечикова, ORCID: 0009-0009-9984-2147
О.Н. Воскресенская, ORCID: 0000-0002-7330-633X
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Россолимо, д. 11, корп. 1
Введение. Изучение клинической картины и прогностических факторов развития постковидного синдрома (ПКС) остается актуальной задачей для врачей различных специальностей.
Цель. Изучить клинические проявления и вероятные предикторы формирования ПКС в неврологической практике.
Материалы и методы. В исследование включено 34 пациента в возрасте от 18 до 65 лет, проходящих лечение в Клинике нервных болезней им. А.Я. Кожевникова по поводу основного заболевания: головные боли напряжения (ГБН), мигрень (М), скелетно-мышечные боли (СМБ), переболевшие документально подтвержденной коронавирусной инфекцией (КИ, COVID-19). Основную группу (ОГ) составили 21 пациент (средний возраст 47,95 ± 12,21 лет), дополнительно к проявлениям основного заболевания предъявляющие жалобы на нарушение памяти, снижение концентрации внимания и работоспособности, быструю утомляемость, тревогу и внутреннее напряжение, пониженный фон настроения и нежелание что-либо делать, головную боль, возникшие впервые во время, сразу по окончании или в течение 2 мес. после перенесенной КИ, что соответствовало критериям ПКС. В группу сравнения (ГС) включено 13 пациентов (средний возраст 38 ± 12 лет), которые предъявляли жалобы только в рамках их основных заболеваний и не отмечали каких-либо особенностей в их течении в связи с перенесенной КИ. Дополнительно к основным методам исследования применялось анкетирование: утомляемости (шкала MFI-20), тревоги (шкала Спилбергера – Ханина), депрессии (шкала Бека), когнитивных нарушений (MOCA-тест), нарушения концентрации внимания (тест Мюнстерберга), симптомов центральной сенситизации (CSI), качества жизни (SF-36).
Результаты. Клинические проявления ПКС заключались в легких или субъективных когнитивных нарушениях (КН) без изменения концентрации внимания и астенического симптомокомплекса. Пациенты ОГ были более старшего возраста, имели среднетяжелое и тяжелое течение острого периода КИ и риски сердечно-сосудистой патологии, статистически достоверно отличались от ГС более высокими баллами по шкалам: депрессии Бека, Спилбергера – Ханина, CSI, MFI-20 – и более низким баллом по шкале MOCA.
Выводы. В качестве возможных предикторов формирования ПКС могут выступать: возраст старше 40 лет, среднетяжелое и тяжелое течение КИ, наличие рисков сердечно-сосудистой патологии, депрессия и повышенная личностная тревожность, более высокие показатели центральной сенситизации.
Для цитирования: Перетечикова АВ, Воскресенская ОН. Клинические проявления и вероятные предикторы формирования постковидного синдрома в неврологической практике. Медицинский совет. 2023;17(21):168–173. https://doi.org/10.21518/ms2023-427.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Clinical manifestations and possible predictors of the formation of post-covid syndrome in neurological practice
Anna V. Peretechikova, ORCID: 0009-0009-9984-2147
Olga N. Voskresenskaya, ORCID: 0000-0002-7330-633X
Sechenov First Moscow State Medical University (Sechenov University); 11, Bldg. 1, Rossolimo St., Moscow, 119991, Russia
Introduction. Studying clinical manifistations and prognostic factors for the development of post-covid syndrome (PCS) remains an actual task for doctors of various specialties.
Aim. To study the clinical manifestations and probable predictors of the formation of PCS in neurological practice.
Materials and methods. The study included 34 patients aged 18 to 65 years undergoing treatment at the A.Ya. Kozhevnikov Clinic of Nervous Diseases for the underlying disease: tension headaches (GBN), migraine (M), musculoskeletal pain (SMB), who had a documented coronavirus infection (CI) COVID-19. The main group (OG) consisted of 21 patients (average age 47.95 ± 12.21 years), in addition to the manifestations of the underlying disease, complaining of memory impairment, decreased concentration and performance, fatigue, anxiety and internal tension, low mood background and unwillingness to do anything, headache that occurred for the first time during, immediately after the end or within 2 months after the transferred CI, which met the criteria of the PCC. The comparison group (GS) included 13 patients (average age 38 ± 12 years) who complained only about their underlying diseases and did not note any peculiarities in their course due to the transferred CI. In addition to the main research methods, questionnaires were used: fatigue (MFI-20 scale), anxiety (Spielberger – Khanin scale), depression (Beck scale), cognitive impairment (MOCA test), impaired concentration (Munsterberg test), symptoms of central sensitization (CSI), quality of life (SF-36).
Results. Clinical manifestations of PKS consisted in mild or subjective cognitive impairment (CN) without a change in concentration and asthenic symptom complex. OG patients were older, had moderate and severe acute period of CI and risks of cardiovascular pathology, statistically significantly differed from HS with higher scores on the scales: Beck depression, Spielberger – Khanin, CSI, MFI-20 and a lower score on the MOCA scale.
Conclusions. Possible predictors of the formation of PKS can be: age over 40 years, moderate and severe course of CI, the presence of risks of cardiovascular pathology, depression and increased personal anxiety, higher rates of central sensitization.
For citation: Peretechikova AV, Voskresenskaya ON. Clinical manifestations and possible predictors of the formation of post-COVID syndrome in neurological practice. Meditsinskiy Sovet. 2023;17(21):168–173. (In Russ.) https://doi.org/10.21518/ms2023-427.
Conflict of interest: the authors declare no conflict of interest.
Введение
По данным Всемирной организации здравоохранения (ВОЗ), на сегодняшний день во всем мире зарегистрировано более 770 млн случаев заражения COVID-19 и 6,9 млн случаев смертей от этого заболевания. В Российской Федерации – 22,9 млн зарегистрированных случаев заболевания COVID-19 и около 400 тыс. случаев с летальным исходом1. В мае 2023 г. ВОЗ объявила о снятии статуса пандемии с новой коронавирусной инфекции (КИ), однако ее последствия остаются глобальными и всеобъемлющими, затрагивая сферу здравоохранения и экономику различных стран по всему миру.
С начала пандемии врачи, наблюдавшие пациентов, перенесших COVID-19, обнаружили, что после инфекции у пациентов появлялись симптомы, существенно нарушающие их качество жизни. Появился термин «постковидный синдром» (ПКС). Национальный институт здоровья и клинического совершенствования (The National Institute for Health and Care Excellence, NICE) предлагает использовать следующее определение ПКС: признаки и симптомы, которые развиваются во время или после инфицирования COVID-19, продолжаются более 12 нед. и не объясняются альтернативным диагнозом2. ВОЗ описывает термин «ПКС» как состояние после COVID-19, возникающее у лиц с вероятной или подтвержденной инфекцией SARS CoV-2 в анамнезе, обычно через 3 мес. от начала заболевания COVID-19, с симптомами, которые длятся не менее 2 мес. и не могут быть объяснены альтернативным диагнозом. Симптомы могут возникать впервые после первоначального выздоровления от острого эпизода COVID-19 или сохраняться после первоначального заболевания. Симптомы также могут меняться или рецидивировать с течением времени3. В настоящий момент времени присутствует множество точек зрения относительно предикторов развития ПКС. В недавно проведенных зарубежных исследованиях в качестве факторов риска формирования ПКС указывают возраст, пол, полиморбидную патологию, тяжесть течения в остром периоде заболевания [1, 2]. Во многих исследованиях зависимость ПКС от тяжести перенесенной КИ не подтверждается, а некоторые авторы обращают внимание на то, что неврологические жалобы и нарушения у пациента, перенесшего COVID-19, могут быть вызваны развитием или обострением сочетанного заболевания, которое ранее могло быть не диагностировано. К таким заболеваниям относятся первичная головная боль, скелетно-мышечные боли (СМБ) в шее и спине, нарушения сна, тревожные и депрессивные расстройства. Диагноз «ПКС» – это прежде всего диагноз исключения других заболеваний, которые могли бы объяснить самочувствие и состояние пациента, перенесшего КИ [3]. Таким образом, однозначного мнения о факторах риска развития ПКС на данный момент нет, а определение комплекса возможных предикторов ПКС имеет большой научный и практический интерес в связи с тем, что выделение групп риска по формированию ПКС может привести к повышению качества восстановительного лечения данной категории пациентов.
Цель исследования – изучить клинические проявления и вероятные предикторы формирования ПКС в неврологической практике.
Материалы и методы
В исследование включено 34 пациента, проходящих лечение в Клинике нервных болезней им. А.Я. Кожевникова по поводу основного заболевания: головные боли напряжения (ГБН), мигрень (М), СМБ боли в шее и спине, переболевшие COVID-19.
Критерии включения в исследование: 1) возраст от 18 до 65 лет включительно; 2) задокументированный факт перенесенного COVID-19; 3) подписанное добровольное согласие на включение в исследование; 4) клинические проявления ПКС, продолжающиеся более 12 нед.
Критерии исключения из исследования: 1) возраст менее 18 и старше 65 лет; 2) отказ от подписания добровольного согласия на включение в исследование; 3) отсутствие документально подтвержденного факта перенесенной КИ; 4) когнитивное снижение, препятствующее полноценному клиническому обследованию; 5) тяжелые кардиологические, гематологические, бронхолегочные, желудочно-кишечные, психические, дисметаболические заболевания в стадии декомпенсации, заболевания, диагностированные анамнестически, при клиническом и/или лабораторно-инструментальном обследовании, которые могли препятствовать участию пациентов в исследовании и оказать влияние на его результаты; 6) беременность.
Исследование было одобрено Этическим комитетом Сеченовского Университета (протокол №25-22 от 08.12.2022 г.).
Все пациенты были разделены на две группы. ОГ составил 21 пациент (средний возраст 47,95 ± 12,21 лет), из которых 17 женщин и 4 мужчины, дополнительно к проявлениям основного заболевания предъявляющие жалобы на нарушение памяти (n = 18), снижение концентрации внимания, быструю утомляемость и снижение работоспособности(n = 15), тревогу и внутреннее напряжение(n = 10), пониженный фон настроения и нежелание что-либо делать (n = 7), головную боль (n = 3), возникшие впервые во время, сразу по окончании или в течение 2 мес. после перенесенной КИ, что соответствовало критериям возможного ПКС. Двенадцать пациентов ОГ имели в анамнезе первичную головную боль (ГБ) (хроническую ГБН или М), из них девять человек отметили усиление и учащение приступов ГБ после перенесенной КИ. У восьми пациентов ОГ отмечались в анамнезе СМБ различной локализации, из них пять отметили усиление болей после перенесенной болезни. Лишь одна пациентка ОГ не имела предшествующего анамнеза по ГБ и СМБ, а симптомы в виде повышенной утомляемости и тревожности, нарушения концентрации внимания, пониженного фона настроения и боли в грудном отделе позвоночника возникли во время острого периода COVID-19 и продолжали беспокоить до настоящего времени, в связи с чем она обратилась за медицинской помощью. Пятнадцать пациентов ОГ группы отметили, что эпизодически применяемые ими раннее нестероидные противовоспалительные препараты стали менее эффективны, их состояние во время госпитализации потребовало назначения курса антидепрессантов или антиконвульсантов в связи с хронизацией болевых синдромов. В ГС было включено 13 пациентов (средний возраст 38 ± 12 лет), которые предъявляли жалобы только в рамках их основных заболеваний и не отмечали каких-либо особенностей в их течении в связи с перенесенной КИ.
У всех пациентов был внимательно изучен анамнез жизни и анамнез заболевания: симптомы во время острого периода, тяжесть течения с учетом поражения легких по данным КТ, длительность болезни. Кроме стандартного неврологического обследования, для объективизации изучаемых параметров были применены следующие опросники и шкалы: Монреальская когнитивная шкала (MOCA), тест на проверку концентрации внимания Мюнстерберга, шкала оценки уровня реактивной (РТ) и личностной тревожности (ЛТ) Спилбергера – Ханина, шкала депрессии Бека, субъективная шкала оценки астении MFI-20, шкала центральной сенситизации CSI, шкала оценки качества жизни SF 36.
В ходе статистической обработки использовались t-критерий Стьюдента для проверки равенства средних значений в двух выборках, а также точный тест Фишера в анализе категориальных данных, учитывая, что размеры выборок были достаточно малы.
Результаты
Основу клинических проявлений ПКС составили легкие или субъективные КН без изменений концентрации внимания и астенический симптомокомплекс. В ходе проведенного анализа данных в ОГ выявлен статистически достоверно более высокий средний балл по шкалам: депрессии Бека, ЛТ Спилбергера – Ханина, центральной сенситизации, субъективной оценки астении MFI-20 (субшкалы: физическая астения, психическая астения, пониженная активность). Среднее число баллов по шкале оценки когнитивных функций MOCA в ОГ составило 26,67 ± 2,03, а в группе сравнения – 28,08 ± 1,56 (p = 0,046, p < 0,05) (табл. 1).
Таблица 1. Результаты опросников и шкал, полученные в основной группе и группе сравнения
| MOCA | 26,67 ± 2,03 | 28,08 ± 1,56 | 0,046 |
| Шкала депрессии Бека | 13,57 ± 5,94 | 6,77 ± 5,34 | 0,002 |
| Шкала ЛТ Спилбергера – Ханина | 47,33 ± 6,62 | 41,23 ± 8,18 | 0,023 |
| Шкала центральной сенситизации | 40,19 ± 10,35 | 26 ± 11,45 | 0,001 |
| Шкала субъективной оценки астении, общий балл: • физическая астения, • психическая астения, • пониженная активность | 56,9 ± 10,58 12,29 ± 2,95 11,14 ± 3,28 12 ± 3,05 | 43,08 ± 15,26 8,46 ± 4,88 7,54 ± 3,62 9 ± 3,83 | 0,004 0,007 0,005 0,017 |
По шкале оценки качества жизни SF 36, тесту на проверку концентрации внимания Мюнстерберга и по шкале оценки уровня РТ Спилбергера – Ханина достоверной разницы между двумя группами пациентов не получено.
Результаты проведенного исследования свидетельствуют о развитии ПКС у пациентов более старшего возраста, со среднетяжелым и тяжелым течением острого периода КИ, с наличием в анамнезе патологии сердечно-сосудистой системы, в частности артериальной гипертензии, каких-либо гендерных отличий выявлено не было. В качестве возможного прогностического фактора была рассмотрена аносмия в остром периоде заболевания, однако достоверной связи также не было получено (табл. 2).
Таблица 2. Вероятные предикторы постковидного синдрома
| Тяжелая и среднетяжелая форма течения КИ | 13 | 1 |
| Легкая форма течения КИ | 8 | 12 |
| p = 0,003 * | ||
| Артериальная гипертензия в анамнезе | 11 | 1 |
| Отсутствие артериальной гипертензии в анамнезе | 10 | 12 |
| p = 0,01 * | ||
| Аносмия в анамнезе | 13 | 7 |
| Отсутствие аносмии | 8 | 6 |
| p = 0,728 | ||
| Мужской пол | 4 | 6 |
| Женский пол | 17 | 7 |
| p = 0,13 | ||
| Возраст < 40 | 6 | 9 |
| Возраст ≥ 40 | 15 | 4 |
| p = 0,03 * | ||
* Статистически значимые различия (p < 0,05) при сравнении данных пациентов ОГ и ГС.
Обсуждение
Как известно, COVID-19 часто сопровождается неврологическими осложнениями как в остром периоде, так и спустя месяцы после заражения [4, 5]. Обсуждаемые различные механизмы поражения центральной и периферической нервной системы COVID-19 мы представили в виде схемы (рис.).
Рисунок. Обсуждаемые механизмы поражения головного мозга при COVID-19
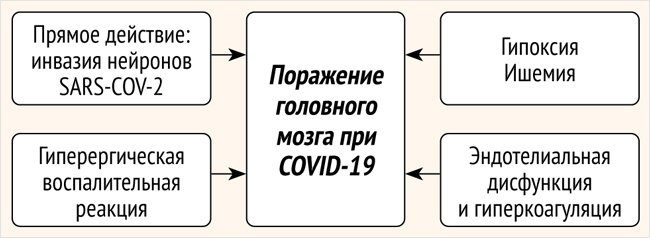
SARS-CoV-2 является нейротропным вирусом, поражающим в т. ч. головной мозг [6, 7]. J. Matschke et al. [8] провели патоморфологическое исследование обонятельных луковиц, базальных ганглиев, ствола мозга и мозжечка пациентов, умерших от COVID-19. Наиболее характерными изменениями оказались микроглиальная активация и инфильтрация структур мозга цитотоксическими Т-лимфоцитами. Также в ходе оценки наличия SARS-CoV-2 с помощью полимеразной цепной реакции и иммуногистохимии в различных областях мозга вирус был обнаружен в мозге 21 из 40 обследованных пациентов. Однако, помимо прямого поражения вирусом структур головного мозга, в литературе также обсуждается острое гипоксическиишемическое поражение. Так, в своем систематическом обзоре о нейропатологических особенностях пациентов, умерших от СOVID-19, A. Pajo et al. пришли к выводу, что изменения в таких структурах мозга, как парагиппокампальная извилина, гиппокамп, клетки Пуркинье мозжечка, клетки неокортекса, нейроны ствола головного мозга, обонятельной луковицы, неостриатума и хиазмы, являются результатом перенесенных гипоксии и ишемии [9]. Известно, что вирус имеет высокое сродство к рецепторам ангиотензинпревращающего фермента 2-го типа, которые находятся не только на мембранах клеток нервной системы, но и на эндотелии сосудов, клетках почек, кишечника, легких, кожи и миокарда, что объясняет масштабный объем поражения различных органов человека [10–12]. Поражение вирусом SARS-CoV-2 эндотелиоцитов сосудов нарушает баланс между свертывающей и противосвертывающей системой крови, что ведет к гиперкоагуляции, о чем свидетельствует значительное повышение уровня D-димера у таких пациентов [13]. Описанные механизмы повреждения нервной системы объясняют появление неврологических расстройств в острый период КИ, и совершенно непонятными остаются возможные патогенетические механизмы развития ПКС.
В результате большого систематического обзора и метаанализа 50 исследований, направленных на оценку жалоб и симптомов в рамках ПКС, были выявлены следующие 9 наиболее часто наблюдаемых симптомов: утомляемость (23%, 95% ДИ 17–30), нарушение памяти (14%, 95% ДИ 10–19), одышка (13%, 95% ДИ 11–15), депрессия (13%, 95% ДИ 3–15), тревога (11%, 95% ДИ 5–25), аносмия (12%, 95% ДИ 6–23), бессонница (11%, 95% ДИ 5–23), боль в суставах (10%, 95% ДИ 4–22) и тахикардия (6%, 95% ДИ 3–11) [14].
Метаанализ 15 исследований (47 910 пациентов в возрасте от 17 до 87 лет с периодом наблюдения 14–110 дней) показал, что наиболее частыми жалобами в рамках ПКС были: чувство усталости, головная боль, расстройства внимания, выпадение волос, одышка. КН выявлялись у 16% исследуемых, тревога – у 13%, депрессия – у 12% [15]. В структуре КН при ПКС отмечается уменьшение гибкости мышления, темпа познавательной деятельности, нарушение исполнительных функций [16–19]. В исследовании H. Zhou у 29 пациентов среднего возраста после выписки из стационара по поводу инфекции COVID-19 выявлялись по сравнению со здоровыми участниками нарушения концентрации внимания и оперативной памяти [20]. Усталость и быстрая утомляемость являются довольно частыми симптомами среди пациентов с перенесенным COVID-19. В исследовании, проведенном L. Townsend, изучалась распространенность усталости у людей, выздоровевших после острой фазы заболевания COVID-19, с использованием шкалы усталости Чалдера (CFQ-11). Из 128 участников (49,5 ± 15 лет; 54% женщин) более половины сообщили о постоянной усталости (67/128; 52,3%) в среднем через 10 нед. после появления первых симптомов COVID-19. Более того, связи между тяжестью заболевания COVID-19 (необходимость госпитализации, потребность в реанимации) и астенией после COVID-19 достоверно выявлено не было [21]. Большое количество исследований указывают на длительно сохраняющиеся высокие уровни тревоги, депрессии и нарушений сна у перенесших COVID-19 пациентов [22–24]. По данным некоторых исследований, через 2 мес. у 14–30% опрошенных отмечается тревога и у 11–27% – депрессия [25]. По данным, полученным от испанских коллег, у 1 142 пациентов, обследованных по телефону с помощью валидированных опросников (HADS и PSQI), через 7 мес. после выписки из стационара тревога была выявлена у 16,2%, депрессия – у 19,7%, бессонница – у 34,5% [26].
В недавнем российском исследовании, в которое было включено 210 пациентов, перенесших COVID-19, факторами риска развития ПКС выступили: среднетяжелое и тяжелое течение КИ в остром периоде болезни, женский пол, возраст старше 50 лет, наличие полиморбидной патологии, использование глюкокортикостероидов в острый период заболевания [27].
В ходе проведенной нами работы были получены результаты, частично подтверждающие представленные ранее данные [1–3, 25, 27]. У обследованных пациентов в качестве основных клинических проявлений ПКС выявлялись легкие или субъективные КН без изменения концентрации внимания, астенический синдром с преобладанием психической, физической астении и пониженной активности, депрессивные расстройства различной степени выраженности, высокие показатели уровня личностной тревожности без достоверной разницы по уровням реактивной тревожности. Но в отличие от некоторых исследователей мы не склонны рассматривать проявления депрессии и тревожности как следствие перенесенной КИ. Мы считаем их преморбидными особенностями личности, которые, наоборот, способствуют формированию ПКС. Мы целенаправленно взяли пациентов с теми или иными болевыми проявлениями и поступивших в стационар с декомпенсацией самочувствия, которые многие связывали с перенесенной КИ. Надо отметить, что только тщательное изучение анамнеза жизни и медицинской документации у обследованных пациентов помогло выявить все особенности имеющихся клинических проявлений. Учитывая, что практически все пациенты ОГ имели отягощенный ранее анамнез по первичной ГБ и СМБ, проявления ПКС у них заключались в легких или субъективных КН и астеническом симптомокомплексе. Безусловно, дальнейшие исследования с формированием большей выборки пациентов окончательно позволят судить обо всех имеющихся взаимосвязях симптомов ПКС. В частности, представляет интерес подробный анализ болевых синдромов сравниваемых групп до перенесенной КИ, эффективности проводимого ранее лечения и т. д.
Выводы
С учетом полученных на сегодня предварительных результатов можно констатировать, что термин «ПКС» имеет право на существование. Наряду с этим, можно утверждать, что основными его проявлениями являются КН и астенический синдром и что при интерпретации жалоб пациентов, особенно связываемых ими с перенесенной КИ, необходим тщательный анализ анамнеза жизни и медицинской документации, т. к. существующие жалобы могут быть вызваны не ПКС, а обострением предшествующих неврологических заболеваний (возможно, ранее не диагностированных), не связанных с COVID-19. С другой стороны, выявление и повсеместное признание предикторов формирования ПКС профессиональным сообществом может способствовать улучшению качества восстановительного лечения данной категории пациентов. Для выявления факторов риска ПКС необходима инициация клинических исследований, предусматривающих динамическое наблюдение за большим количеством пациентов.
1 World Health Organization. Weekly epidemiological update on COVID-19. Available at: https://www.who.int/.
2 National Institute for Health and Care Excellence (NICE). COVID-19 rapid guideline: managing the long-term effects of COVID-19. 18 Dec 2020. Available at: https://www.nice.org.uk/.
3 World Health Organization. A Clinical Case Definition of Post COVID-19 Condition by a Delphi Consensus. 6 October 2021. Available at: https://www.who.int/.
Список литературы / References
- Almasri M, Alqaisi R, Al-Shagahin M, Al-Kubaisy W, Aljarajreh A; Al-Shagahin H. Risk Factors and Characterization of Post-COVID-19 Syndrome in Jordan. Iproc. 2022;8(1):e36563. doi: 10.2196/36563.
- Crook H, Raza S, Nowell J, Young M, Edison P. Long COVID-mechanisms, risk factors, and management. BMJ. 2021;374:n1648. doi: 10.1136/bmj.n1648.
- Парфенов ВА, Кулеш АА. Острые и отдаленные неврологические нарушения у пациентов, перенесших коронавирусную инфекцию. Неврология, нейропсихиатрия, психосоматика. 2022;14(3):4–11. doi: 10.14412/2074-2711-2022-3-4-11. / Parfenov VA, Kulesh AA. Acute and long-term neurological disorders in patients with coronavirus infection. Neurology, Neuropsychiatry, Psychosomatics. 2022;14(3):4–11. (In Russ.) doi: 10.14412/2074-2711-2022-3-4-11.
- Захаров ВВ. Постковидный синдром глазами невролога. Поведенческая неврология. 2021;(2):14–22. doi: 10.46393/2712-9675_2021_2_14_22. / Zakharov VV. Post-COVID syndrome from the point of view of a neurologist. Behavioral Neurology. 2021;(2):14–22. (In Russ.) doi: 10.46393/2712-9675_2021_2_14_22.
- Lu Y, Li X, Geng D, Mei N, Wu PY, Huang CC et al. Cerebral Micro-Structural Changes in COVID-19 Patients – An MRI-based 3-month Follow-up Study. eClinicalMedicine. 2020;25:100484. doi: 10.1016/j.eclinm.2020.100484.
- Scharf RE, Anaya JM. Post-COVID Syndrome in Adults-An Overview. Viruses. 2023;15(3):675. doi: 10.3390/v15030675.
- Buonsenso D, Piazza M, Boner AL, Bellanti JA. Long COVID: A proposed hypothesis-driven model of vi.жral persistence for the pathophysiology of the syndrome. Allergy Asthma Proc. 2022;43(3):187–193. doi: 10.2500/aap.2022.43.220018.
- Matschke J, Lütgehetmann M, Hagel C, Sperhake JP, Schröder AS, Edler C et al. Neuropathology of patients with COVID-19 in Germany: a post-mortem case series. Lancet Neurol. 2020;19(11):919–929. doi: 10.1016/S1474-4422(20)30308-2.
- Pajo AT, Espiritu AI, Apor ADAO, Jamora RDG. Neuropathologic findings of patients with COVID-19: a systematic review. Neurol Sci. 2021;42(4):1255–1266. doi: 10.1007/s10072-021-05068-7.
- Преображенская ИС. COVID-ассоциированные когнитивные нарушения. Consilium Medicum. 2022;24(2):96–102. doi: 10.26442/20751753.2022.2.201512. / Preobrazhenskaya IS. COVID-associated cognitive impairments: A review. Consilium Medicum. 2022;24(2):96–102. (In Russ.) doi: 10.26442/20751753.2022.2.201512.
- Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. doi: 10.1016/S0140-6736(20)30937-5.
- Wang F, Kream RM, Stefano GB. Long-Term Respiratory and Neurological Sequelae of COVID-19. Med Sci Monit. 2020;26:e928996. doi: 10.12659/MSM.928996.
- Koralnik IJ, Tyler KL. COVID-19: A Global Threat to the Nervous System. Ann Neurol. 2020;88(1):1–11. doi: 10.1002/ana.25807.
- Chen C, Haupert SR, Zimmermann L, Shi X, Fritsche LG, Mukherjee B. Global Prevalence of Post-Coronavirus Disease 2019 (COVID-19) Condition or Long COVID: A Meta-Analysis and Systematic Review. J Infect Dis. 2022;226(9):1593–1607. doi: 10.1093/infdis/jiac136.
- Lopez-Leon S, Wegman-Ostrosky T, Perelman C, Sepulveda R, Rebolledo PA, Cuapio A, Villapol S. More than 50 long-term effects of COVID-19: a systematic review and meta-analysis. Sci Rep. 2021;11(1):16144. doi: 10.1101/2021.01.27.21250617.
- Jaywant A, Vanderlind WM, Alexopoulos GS, Fridman СB, Perlis RH, Gunning FM. Frequency and profile of objective cognitive deficits in hospitalized patients recovering from COVID-19. Neuropsychopharmacology. 2021;46(13):2235–2240. doi: 10.1038/s41386-021-00978-8.
- Crivelli L, Palmer K, Calandri I, Guekht A, Beghi E, Carroll W et al. Changes in cognitive functioning after COVID-19: A systematic review and meta-analysis. Alzheimers Dement. 2022;18(5):1047–1066. doi: 10.1002/alz.12644.
- Остроумова ТМ, Черноусов ПА, Кузнецов ИВ. Когнитивные нарушения у пациентов, перенесших COVID-19. Неврология, нейропсихиатрия, психосоматика. 2021;13(1):126–130. doi: 10.14412/2074-2711-2021-1-126-130. / Ostroumova TM, Chernousov PA, Kuznetsov IV. Cognitive impairment in COVID-19 survivors. Neurology, Neuropsychiatry, Psychosomatics. 2021;13(1):126–130. (In Russ.) doi: 10.14412/2074-2711-2021-1-126-130.
- Куташов ВА. Применение Актовегина у пациентов с когнитивными нарушениями после перенесенной коронавирусной инфекции COVID-19. Неврология, нейропсихиатрия, психосоматика. 2021;13(2):65–72. doi: 10.14412/2074-2711-2021-2-65-72. / Kutashov VA. Actovegin use in patients with cognitive impairment after coronavirus infection (COVID-19). Neurology, Neuropsychiatry, Psychosomatics. 2021;13(2):65–72. (In Russ.) doi: 10.14412/2074-2711-2021-2-65-72.
- Zhou H, Lu S, Chen J, Wei N, Wang D, Lyu H et al. The landscape of cognitive function in recovered COVID-19 patients. J Psychiatr Res. 2020;129:98–102. doi: 10.1016/j.jpsychires.2020.06.022.
- Townsend L, Dyer AH, Jones K, Dunne J, Mooney A, Gaffney F. Persistent fatigue following SARS-CoV-2 infection is common and independent of severity of initial infection. PLoS ONE. 2020;15(11):e0240784. doi: 10.1371/journal.pone.0240784.
- Табеева ГР. Тревожные и депрессивные расстройства в период эпидемии COVID-19. Поведенческая неврология. 2021;(2):24–32. doi: 10.46393/2712-9675_2021_2_24_32. / Tabeeva GR. Anxiety and depressive disorders during COVID-19. Behavioral Neurology. 2021;(2):24–32. (In Russ.) doi: 10.46393/2712-9675_2021_2_24_32.
- Kim Y, Bitna-Ha, Kim SW, Chang HH, Kwon KT, Bae S, Hwang S. Post-acute COVID-19 syndrome in patients after 12 months from COVID-19 infection in Korea. BMC Infect Dis. 2022;22(1):93. doi: 10.1186/s12879-022-07062-6.
- Петрова НН, Кудряшов АВ, Матвиевская ОВ, Мухин АА, Лаврова ВА, Чумаков ЕМ и др. Депрессивные состояния в структуре постковидного синдрома: особенности и терапия. Обозрение психиатрии и медицинской психологии имени В.М. Бехтерева. 2022;(1):16–24. doi: 10.31363/2313-7053-2022-1-16-24. / Petrova NN, Kudryashov AV, Matvievskaya OV, Mukhin AA, Lavrova VA, Chumakov EM et al. Depressive states in the structure of postcovid syndrome: features and therapy. V.M. Bekhterev Review of Psychiatry and Medical Psychology. 2022;(1):16–24. doi: 10.31363/2313-7053-2022-1-16-24.
- Мосолов СН. Длительные психические нарушения после перенесенной острой коронавирусной инфекции SARS-CoV-2. Современная терапия психических расстройств. 2021;(3):2–23. doi: 10.21265/PSYPH.2021.31.25.001. / Mosolov SN. Long-termpsychiatric sequelae of SARS-CoV-2 infection. Current Therapy of Mental Disorders. 2021;(3):2–23. (In Russ.) doi: 10.21265/PSYPH.2021.31.25.001.
- Fernández-de-Las-Peñas C, Palacios-Ceña D, Gómez-Mayordomo V, Rodríuez-Jiménez J, Palacios-Ceña M, Velasco-Arribas M. Long-term post-COVID symptoms and associated risk factors in previously hospitalized patients: A multicenter study. J Infect. 2021;83(2):237–279. doi: 10.1016/j.jinf.2021.04.036/.
- Асфандиярова НС, Филиппов ЕВ, Дашкевич ОВ, Якубовская АГ, Мосейчук КА, Журавлева НС и др. Факторы риска развития постковидного синдрома. Клиницист. 2022;16(4):19–26. doi: 10.17650/1818-8338-2022-16-4-К671. / Asfandiyarova NS, Philippo EV, Dashkevich OV, Iakubovskaia АG, Moseichuk KA, Zhuravleva NS et al. Risk factors for development of the post-COVID syndrome. The Clinician. 2022;16(4):19–26. (In Russ.) doi: 10.17650/1818-8338-2022-16-4-К671.