Журнал "Медицинский совет" №12/2020
DOI: 10.21518/2079-701X-2020-12-54-59
О.И. Сидорович1, ORCID: 0000-0003-1000-0664
А.А. Цывкина1, ORCID: 0000-0003-3523-9372
Г.Д. Абдуллаева2, ORCID: 0000-0003-0991-4346
1 Государственный научный центр «Институт иммунологии»; 115522, Россия, Москва, Каширское шоссе, д. 24
2 Медицинский центр «Медквадрат»; 115409, Россия, Москва, Каширское шоссе, д. 74, корп. 1
Атопический дерматит – мультифакторное, генетически обусловленное воспалительное заболевание кожи, возникающее вследствие нарушения эпидермального барьера на фоне предрасположенности к IgE-опосредованной гиперчувствительности, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения и требующее длительного/постоянного лечения, которое основывается на постоянном использовании эмолентов, топических ингибиторов кальциневрина, топических глюкокортикоидов и гигиеническом уходе за кожей.
В основе механизмов развития атопического дерматита в первую очередь лежит генетическая предрасположенность к аллергии, нарушение нормального развития врожденных и приобретенных факторов иммунной системы, а также влияние факторов окружающей среды и различных триггерных факторов, как аллергенных (пищевые, бытовые, эпидермальные, грибковые аллергены и т.д.), так и неаллергенных (табачный дым, поллютанты, психоэмоциональное напряжение, сопутствующие хронические и острые заболевания, преимущественно ОРВИ, и т.д.).
Установлено, что характерной чертой атопического дерматита является нарушение функции эпидермального барьера, приводящее к чрезмерной трансэпидермальной потере воды, к повышению проницаемости эпидермиса, проникновению аллергенов и микробных агентов через кожу и в конечном итоге – к сенсибилизации к аллергенам и развитию на ней специфического аллергического воспаления и реализации «атопического марша» с последовательным развитием других атопических заболеваний.
Современные терапевтические стратегии активно направлены на восстановление эпидермального барьера, профилактику сенсибилизации и развития атопического марша. В данной статье изложены особенности нарушения функции эпидермального барьера при атопическом дерматите, перечислены возможности его восстановления и предотвращения последующих обострений посредством использования местной терапии и эмолентов, а также представлены 3 клинических случая.
Для цитирования: Сидорович О.И., Цывкина А.А., Абдуллаева Г.Д. Эффективность и безопасность местной терапии атопического дерматита у детей дошкольного и школьного возраста. Медицинский совет. 2020;(12):54–59. doi: 10.21518/2079-701X-2020-12-54-59.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The efficacy and safety of local therapy of atopic dermatitis in infants and school-age children
Olga I. Sidorovich1, ORCID: 0000-0003-1000-0664
Anastasiya A. Tsyvkina1, ORCID: 0000-0003-3523-9372
Gulnoza D. Abdullaeva2, ORCID: 0000-0003-0991-4346
1 National Research Center – Institute of Immunology; 24, Kashirskoye Shosse, Moscow, 115478, Russia
2 Medkvadrat Medical Center; 74, Bldg. 1, Kashirskoye Shosse, Moscow, 115409, Russia
Atopic dermatitis is a multifactorial genetic inflammatory skin disease associated with disturbances of skin barrier function affected by predisposition to IgE-mediated hypersensitivity, which is characterized by itching, chronic recurrent course of the disease, age-related features of localization and lesion morphology, and requires the long-term and permanent treatment. Treatment is based on the continuous use of emollients, topical calcineurin inhibitors, topical glucocorticoids, and hygienic skin care.
The mechanisms of the atopic dermatitis development are primarily based on a genetic predisposition to allergies, failure of the normal development of congenital and acquired factors of the immune system, as well as the influence of environmental factors and various trigger factors, such as allergenic (food, indoor, epidermal, fungal allergens, etc.). and non-allergenic (tobacco smoke, pollutants, psycho-emotional stress, concomitant chronic and acute diseases, mainly ARVI, etc.).
It has been established that atopic dermatitis is characterized by the epidermal barrier dysfunction leading to excessive transepidermal water loss, increased permeability of the epidermis, the penetration of allergens and microbial agents via the skin and eventually to sensitization to allergens and the development of specific allergic skin inflammation and atopic march with the sequential development of other atopic diseases.
Modern therapeutic strategies are actively aimed at repairing the epidermal barrier, preventing sensitization and atopic march development. This article describes the features of the epidermal barrier dysfunction in atopic dermatitis, lists the methods of its restoration and ways to prevent subsequent exacerbations using local therapy and emollients, and presents 3 clinical cases.
For citation: Sidorovich O.I., Tsyvkina A.A., Abdullaeva G.D. The efficacy and safety of local therapy of atopic dermatitis in infants and school-age children. Meditsinskiy sovet = Medical Council. 2020;(12):54–59. (In Russ.) doi: 10.21518/2079-701X-2020-12-54-59.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Атопический дерматит (АД) – наиболее частое рецидивирующее воспалительное заболевание кожи, характеризующееся сильным зудом и рецидивирующими экзематозными поражениями, обычно начинающимися в течение первых 6 мес. жизни. Что касается других атопических заболеваний, то в последние три десятилетия АД демонстрирует постоянный рост распространенности, достигая уровней более 20% в большинстве стран с высоким уровнем доходов [1].
Заболеваемость АД среди взрослого населения составляет, по разным данным, от 2 до 10%, а по последним данным даже выше, чем считалось ранее – порядка 14% [2].
АД характеризуется хроническим течением, выраженным кожным зудом, сухостью кожи (ксерозом), а также поражением кожи различной локализации в зависимости от возраста, часто ранним дебютом заболевания и семейным анамнезом аллергических заболеваний [3].
В большинстве случаев АД ассоциирован с респираторными проявлениями аллергии: согласно существующей теории атопического марша, у детей раннего возраста первыми проявлениями аллергического заболевания являются кожные проявления и пищевая аллергия, впоследствии у таких пациентов могут развиваться аллергический ринит и бронхиальная астма. При этом стартовой сенсибилизацией у детей является транскутанная сенсибилизация к пищевым аллергенам.
Недавно было высказано предположение о потенциальной роли микробиоты кишечника как модулятора иммунной системы, в частности, досимптомные различия в составе и разнообразии кишечной микробиоты были обнаружены в первые месяцы жизни у детей, у которых развивается АД [1].
Основными экзогенными факторами, способствующими нарушению функции эпидермального барьера при АД и, как следствие, развитию ксероза, трансдермальной потере влаги, присоединению вторичной инфекции, в свою очередь, являются климатические особенности (высокие или низкие температуры, сухой воздух, поллютанты и т. д.), использование детергентов, чистящих средств, которые содержат поверхностно-активные вещества, экстрагирующие и эмульгирующие липиды на поверхности эпидермиса, так же как и внутриклеточные липиды между корнеоцитами эпидермиса [4].
Последние исследования направлены на изучение функции эпидермального барьера и его роли в патогенезе АД. Была установлена роль гена филаггрина и его мутаций в нарушении функции реализации эпидермального барьера при данном заболевании [3, 5].
Филаггрин участвует в конечной дифференцировке эпидермиса, его недостаток приводит к обезвоживаю рогового слоя, что в дальнейшем ведет к избыточной трансдермальной потере воды и, как следствие, к повышенной сухости кожи.
Нарушение функции эпидермального барьера приводит к повышению проницаемости эпидермиса, транскутанному проникновению аллергенов и микробов, что обуславивает нарушение микробиома кожи за счет чрезмерной колонизации патогенными микроорганизмами – S. aureus, грибами Malassezia spp., Candida spp., вирусом простого герпеса и др., которые способны, как и аллергены, вызывать и поддерживать персистирующее воспаление в коже больных АД [6–10].
При тяжелых формах АД мы часто наблюдаем у пациентов осложнения в виде пиодермий, вирусных и грибковых поражений кожи, осложняющих течение основного заболевания и требующих дополнительной как местной, так зачастую и системной терапии.
Целью терапии АД является достижение длительного контроля над симптомами заболевания и профилактика обострений. В большинстве случаев поэтапный подход к лечению таких больных показал хороший результат. Основными принципами поэтапного подхода являются следующие: элиминация аллергенов и триггерных факторов, восстановление функции эпидермального барьера, наружная противовоспалительная терапия с использованием топических глюкокортикостероидов, ингибиторов кальциневрина, системная терапия современными биологическими препаратами, аллерген-специфическая терапия причинно-значимыми аллергенами (клещи домашней пыли), обучение пациентов. В настоящее время имеется огромный выбор эмолентов, действие которых направлено на восстановление барьерной функции кожи, на защиту от неблагоприятных факторов внешней среды, борьбу с сухостью, устранение воспаления, предупреждение инфицирования кожи, субъективных ощущений зуда, боли и жжения.
В соответствии с международными рекомендациями по лечению АД [3], применение эмолентов показано на всех стадиях заболевания как при обострении, так и в период ремиссии.
На российском рынке представлены различные препараты для местной терапии и ухода за кожей больных АД. Одними из средств, отвечающих современным требованиям, являются средства компании АО «Акрихин», такие как крем метипреднизолона ацепонат (Комфодерм К) и эмолентная серия Сенсадерм для ухода за кожей с физиологическими липидами омега 3-6-9. Ниже представлены 3 клинических случая, где использовалась местная терапия данными препаратами.
КЛИНИЧЕСКИЙ СЛУЧАЙ №1
Пациентка М., 2017 г. рождения (3,6 полных лет), пол женский, с диагнозом «Атопический дерматит, средней степени тяжести». На момент обращения патологический процесс локализовался в локтевых сгибах (рис. 1), подколенных ямках, сгибательной и разгибательной поверхностях плеч, предплечий и лучезапястных суставов, на коже щек и был представлен выраженной эритемой и множественными мелкопапулезными элементами, выраженной сухостью кожных покровов в пораженных и непораженных участках кожи. Интенсивный зуд кожи, требующий ежедневного приема антигистаминных препаратов (цетиризин капли) и влияющий на качество сна.
Рисунок 1. Пациентка М., 2017 г. рождения (3,6 полных лет). До лечения
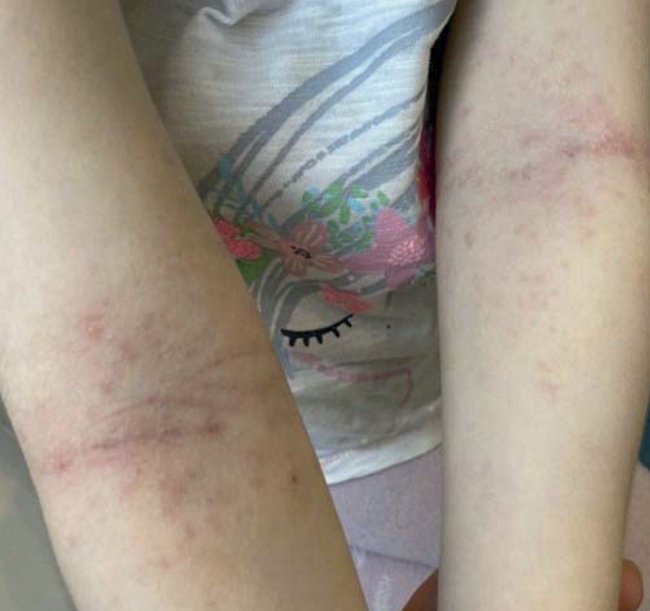
Индекс SCORAD составил 37,5 балла.
Ребенок находился на элиминационной диете с исключением молока (молочных продуктов), яиц, шоколада. В терапии использовались детские увлажняющие местные средства на основе ланолина (детский крем) и декспантенола (бепантен), косметические масла, топические ГКС (бетаметазона валерат крем), антигистаминные средства (цетиризин капли). Эффект от лечения кратковременный.
При обследовании общий IgE 20 МЕ/мл. Рhadiatop® Infant 0,29 кЕдА/л (0 класс), что с высокой степенью вероятности позволило исключить наличие пищевой аллергии.
Ребенку был назначен крем Комфодерм К, в состав которого входят метилпреднизолона ацепонат 0,1%, и в состав основы – керамиды (церамиды). Метилпреднизолона ацепонат – негалогенизированный синтетический стероид последнего поколения, в форме пролекарства с высоким профилем безопасности для лечения АД у взрослых и детей в возрасте от 4 мес. Керамиды являются основой липидной прослойки между роговыми чешуйками кожи, поэтому необходимы для пациентов с АД, у которых эта липидная прослойка несовершенна и приводит к сухости кожи, нарушению ее проницаемости и зуду. Комфодерм К крем позволяет одновременно лечить воспаление кожи и восстанавливать барьерные защитные функции кожи.
В качестве эмолента использовали Сенсадерм специальный крем для восстановления барьерной функции кожи. Триглицериды, полиненасыщенные жирные кислоты омега 3-6-9 данного эмолента укрепляют гидролипидный барьер кожи, способствуя уменьшению проницаемости кожи, уменьшению потери влаги, увлажнению кожи.
Комфодерм К наносился на пораженные участки кожи 1 раз в сутки через 15 мин после нанесения специального крема Сенсадерм. Продолжительность лечения составляла 14 дней, после чего перешли на поддерживающую интермиттирующую терапию с применением крема Комфодерм К 2 раза в неделю. Длительность терапии составила 1 мес. В дальнейшем было рекомендовано использовать крем Комфодерм К при обострении АД под воздействием триггерных факторов. Крем Сенсадерм в качестве эмолента был рекомендован для ежедневного длительного использования 2–4 раза в день в зависимости от потребности увлажнения.
Капли цетиризин рекомендовано продолжить принимать в течение 7 дней с последующей отменой.
Ребенок был осмотрен на 7-й, 14-й и 28-й день терапии.
На 7-й день на фоне рекомендованного лечения отмечена значительная положительная динамика, проявляющаяся в субъективном и объективном улучшении состояния ребенка. Значительно снизилась интенсивность зуда, что способствовало нормализации сна ребенка. При осмотре отмечено уменьшение шелушения и сухости кожи, а также количества и интенсивности высыпаний.
Индекс SCORAD составил 22,8 балла.
Через 14 дней проводимого лечения зуд кожи не беспокоил, что позволило полностью отказаться от приема антигистаминных препаратов. При осмотре кожа достаточно увлажнена, в области правого локтевого сгиба сохранялся эритематозный очаг, других патологических изменений кожи не было. Индекс SCORAD составил 4,4 балла. Далее пациент использовал крем Комфодерм К в качестве поддерживающей терапии 2 раза в неделю и ежедневно эмолент крем Сенсадерм до 4 раз в день. Рекомендован ввод новых продуктов на фоне относительной ремиссии АД при отсутствии данных за наличие пищевой аллергии.
При контрольном осмотре через 28 дней от начала лечения достигнута клиническая ремиссия (рис. 2).
Рисунок 2. Пациентка М., 2017 г. рождения (3,6 полных лет). После лечения
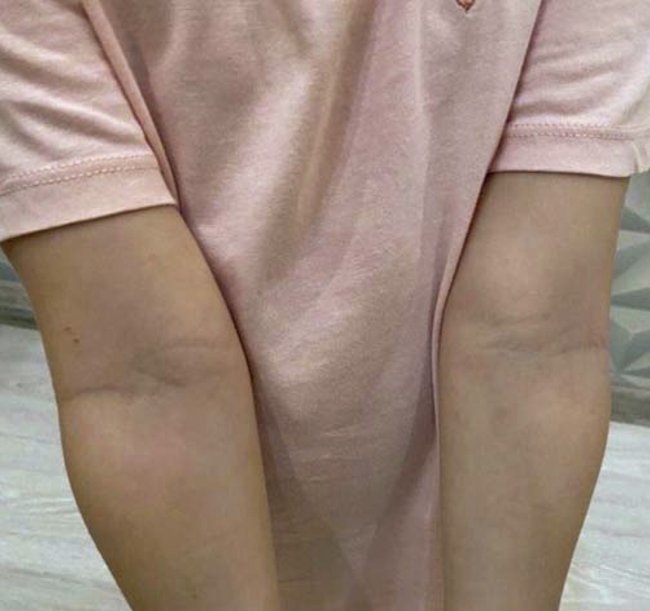
Таким образом, правильно подобранная схема лечения позволила нам быстро добиться ремиссии АД, отказаться от антигистаминных препаратов, расширить рацион питания ребенка. Сочетание препарата Комфодерм К и эмолентов Сенсадерм показало высокую эффективность лечения. Дальнейшие рекомендации включали ежедневное постоянное использование эмолентов Сенсадерм, расширение диеты ребенка под контролем врача-аллерголога, при обострении АД использовать крем Комфодерм К как в постоянной, так и в интермиттирующей схеме.
КЛИНИЧЕСКИЙ СЛУЧАЙ №2
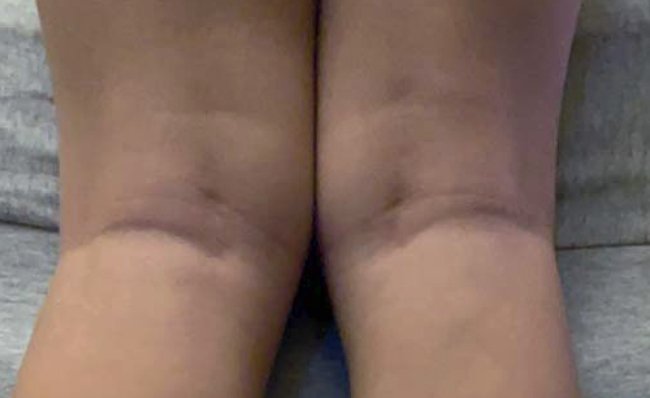
Пациент А., 2018 г. рождения (1,9 полных лет), пол мужской, с диагнозом «Атопический дерматит, средней степени тяжести». Ребенок на смешанном вскармливании, при этом и мама, и ребенок на гипоаллергенной диете. Ребенку проведены неоднократные курсы лечения ферментами, пробиотиками, противоглистными препаратами, проводилось гомеопатическое лечение без эффекта. Использование топических ГКС давало кратковременный эффект на время использования лечебных средств. Потребность в топических ГКС постоянная, использовались различные формы и препараты с разными действующими веществами. Должного ухода за кожей не осущест влялось: очищение кожи проводилось 1 раз в 3–4 дня (душ с использованием детского косметического мыла), для увлажнения кожи использовалось кокосовое масло также 1 раз в 3–4 дня, на кожу лица бепантен ежедневно. С учетом выявленной ранее сенсибилизации к казеину, яичному белку, моркови, фундуку (специфические иммуноглобулины Е иммунохемилюминесцентным методом, педиатрическая панель), пациент и его мама находились на гипоаллергенной диете с исключением этих продуктов. На момент обращения патологический процесс локализовался преимущественно в периоральной области, щеках, подколенных ямках (рис. 3) и на голенях, характеризовался умеренной эритемой и единичными мелкопапулезными элементами, выраженной сухостью кожных покровов в пораженных и непораженных участках кожи.
Индекс SCORAD составил 20,8 балла.
Рисунок 3. Пациент А., 2018 г. рождения (1,9 полных лет). До лечения

Интенсивность кожного патологического процесса и зуда была невыраженная, однако обращало на себя внимание персистирующее течение АД, практически без эпизодов ремиссии.
При оценке пищевого дневника выяснилось, что почти ежедневно и мама, и ребенок употребляли сливочное масло (на хлеб, в выпечку, в каши). Рекомендовано определение специфических иммуноглобулинов класса Е к компонентам молока иммунофлуоресцентным методом (ImmunoCAP). При обследовании доказана пищевая аллергия к белкам молока. Рекомендована строгая элиминационная диета с исключением молока и молочных продуктов. В качестве топической терапии был рекомендован крем метилпреднизолона ацепоната (Комфодерм К) 1 раз в день – 5 дней и для ухода за кожей назначен Сенсадерм специальный крем с омега 3-6-9. Сенсадерм специальный крем рекомендовано было использовать минимум 2 раза в день на всю поверхность тела, кроме волосистой части головы. Также маме объяснена необходимость ежедневного очищения кожи. При усилении сухости кожи возможно увеличение кратности нанесения эмолента до 4 раз в день и более.
Ребенок наблюдался в течение 2 мес. на фоне комплексного лечения и использования эмолента Сенсадерм специальный крем и на фоне строгой элиминационной диеты. За время наблюдения потребности в назначении антигистаминных препаратов не было. При воздействии различных триггерных факторов (продукты-гистаминолибераторы, новое постельное белье) несколько раз отмечалось минимальное обострение АД, которое купировалось дополнительным назначением короткого курса метилпреднизолона ацепоната крема (Комфодерм К) и элиминации триггерного фактора. При контрольном осмотре через 2 мес. от начала лечения достигнута клиническая ремиссия (рис. 4).
Рисунок 4. Пациент А., 2018 г. рождения (1,9 полных лет). После лечения
Дальнейшие рекомендации включали ежедневное постоянное длительное использование эмолентов: Сенсадерм эмульсия для тела, при обострении АД – решение вопроса о необходимости назначения топического ГКС крема метилпреднизолона ацепоната (крем Комфодерм К) в интермиттирующем режиме, строгое соблюдение элиминационной диеты на срок не менее 12 мес., наблюдение аллерголога.
Приведенный клинический пример иллюстрирует важность комплексной терапии АД с включением эмолентов с физиологическими липидами для ухода за кожей при условии точного определения причинно-значимого аллергена и его элиминации. Ежедневное и своевременное применение эмолентов позволяет предотвратить развитие атопического марша.
КЛИНИЧЕСКИЙ СЛУЧАЙ №3
Пациентка Е., 2004 г. рождения (16 полных лет), с диагнозом «Атопическая экзема, локализованная форма, средней степени тяжести» (рис. 5). Вышеуказанные жалобы беспокоят с 12 лет, когда дома появилась кошка, впоследствии – усиление симптоматики на фоне контакта рук с сырым картофелем, томатами, цитрусом, а также на фоне переутомления и нервного стресса. Использовала антигистаминные препараты 1-го поколения и различные смягчающие кремы (в т. ч. детский крем с чередой и т.п.).
Рисунок 5. Пациентка Е., 2004 г. рождения (16 полных лет). До лечения
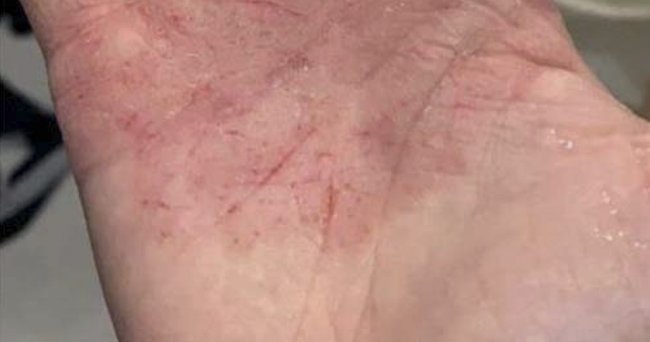
По результатам аллергообследования выявлена сенсибилизация к клещам домашней пыли – 1-й класс, эпидермису кошки – 3-й класс, собаки – 2-й класс и хомяка – 1-й класс. С родителями и пациенткой проведена беседа с целью осуществления элиминационных мероприятий (уменьшение и по возможности прекращение контакта с животным) и использования местной ГКС-терапии на очаги поражений.
На фоне гипоаллергенного быта и работы с подростковым психологом пациентка местно применяла крем метилпреднизолона ацепоната (Комфодерм К), который обладает высокой противовоспалительной и антиаллергической активностью и не оказывает заметного системного влияния. Параллельно пациентка использовала эмоленты Сенсадерм, на фоне применения которых отметила улучшение состояния кожи, уменьшение сухости и дискомфорта при последующем контакте с пищевыми продуктами (рис. 6). На очередном приеме через 2 мес. после начала терапии активно жалоб не предъявляет. Дальнейшие рекомендации включали: ежедневное постоянное длительное использование эмолентов – Сенсадерм эмульсия для тела, соблюдение гипоаллергенного быта, нормализация режима сна и снижение стрессовой нагрузки, при обострении кожного процесса – решение вопроса о необходимости назначения топического ГКС в интермиттирующей схеме.
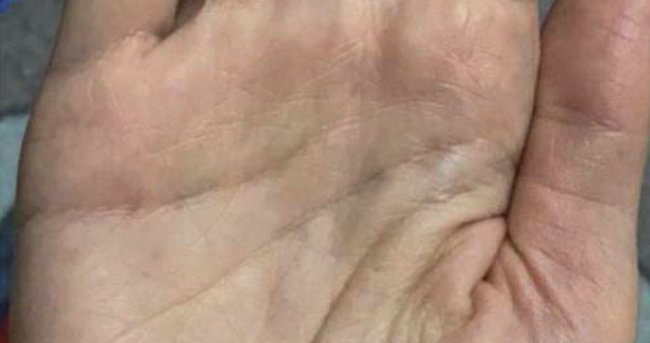
Рисунок 6. Пациентка Е., 2004 г. рождения (16 полных лет). После лечения
ЗАКЛЮЧЕНИЕ
Данные клинические случаи демонстрируют важность комплексной терапии АД. Своевременное и длительное применение эмолентов с физиологическими липидами омега 3-6-9 вкупе с исключением эндогенных и экзогенных триггеров помогают добиться стойкой ремиссии у пациентов с АД, а использование современных топических ГКС помогает быстро справиться с обострением и предотвратить присоединение вторичной инфекции.
Список литературы / References
- Chatenoud L., Bertuccio P., Turati F., Galeone C., Naldi L., Chatenoud L. et al. Markers of microbial exposure lower the incidence of atopic dermatitis. Allergy. 2020;75(1):104–115. doi: 10.1111/all.13990.
- Vinding G.R., Esmann S., Jemec G.B. Quality of life in atopic dermatitis: changes over 6 years in patients who report persistent eczema. J Dermatol. 2012;39(8):721–722. doi: 10.1111/j.1346-8138.2012.01512.x.
- Хаитов Р.М., Ильина Н.И. Аллергология и клиническая иммунология: клинические рекомендации. М.: ГЭОТАР-Медиа; 2019. 352 с. / Khaitov R.M., Ilina N.I. Allergology and clinical immunology: clinical guidelines. Moscow: GEOTAR-Media; 2019. 352 p. (In Russ.)
- Draelos Z.D. Clinical situations conducive to proactive skin health and anti-aging improvement. J Investig Dermatol Symp Proc. 2008;13(1):25–27. doi: 10.1038/jidsymp.2008.9.
- Brown S.J., McLean W.H. One remarkable molecule: filaggrin. J Invest Dermatol. 2012;132(3):751–762. doi: 10.1038/jid.2011.393.
- Kobayashi T., Glatz M., Horiuchi K., Kawasaki H., Akiyama H., Kaplan D.H. et al. Dysbiosis and Staphylococcus aureus colonization drives inflammation in atopic dermatitis. Immunity. 2015;42(4):756–766. doi: 10.1016/j.immuni.2015.03.014.
- Flores G.E., Seite S., Henley J.B., Martin R., Zelenkova H., Aguilar L., Fierer N. Microbiome of affected and unaffected skin of patients with atopic dermatitis before and after emollient treatment. J Drugs Dermatol. 2014;13(11):1365–1372. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Williams M.R., Gallo R.L. The role of the skin microbiome in atopic dermatitis. Curr Allergy Asthma Rep. 2015;15(11):65. doi: 10.1007/s11882-015-0567-4.
- Kennedy E.A., Connolly J., Hourihane J.O., Fallon P.G., McLean W.H.I., Murray D. et al. Skin microbiome before development of atopic dermatitis: Early colonization with commensal staphylococci at 2 months is associated with a lower risk of atopic dermatitis at 1 year. J Allergy Clin Immunol. 2017;139(1):166–172. doi: 10.1016/j.jaci.2016.07.029.
- Kim J., Kim B.E., Ahn K., Leung D.Y.M. Interactions Between Atopic Dermatitis and Staphylococcus aureus Infection: Clinical Implications. Allergy Asthma Immunol Res. 2019;11(5):593–603. doi: 10.4168/aair.2019.11.5.593.
