Журнал "Медицинский совет" №7/2023
DOI: 10.21518/ms2023-125
С.В. Левин1,2, А.С. Лиленко1, Е.А. Левина1
В.Е. Кузовков1, М. Шукурян3, А.Е. Пашкова4, В.А. Воронов2
1 Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи; 190013, Россия, Санкт-Петербург, ул. Бронницкая, д. 9
2 Северо-Западный государственный медицинский университет имени И.И. Мечникова; 191015, Россия, Санкт-Петербург, ул. Кирочная, д. 41
3 Ереванский государственный медицинский университет имени Мхитара Гераци; 0025, Армения, Ереван, ул. Корьюна, д. 2
4 Российский научный центр имени акад. Б.В. Петровского; 119991, Россия, Москва, Абрикосовский пер., д. 2
Введение. Кохлеарная имплантация очень эффективна из-за известной тонотопической организации улитки. Эти данные используются при распределении сигналов по каналам электрода кохлеарного импланта. Чем точнее и естественнее будет раздражение волокон слухового нерва, тем лучше будет восприятие речи, звуков и разборчивость речи.
Цель. Сравнить клиническую и анатомическую настройку процессора кохлеарного импланта.
Материалы и методы. В исследование включено 63 пациента в возрасте от 2 до 60 лет с использованием системы кохлеарной имплантации, импланты со стандартной длиной электродной решетки (31,5 мм). Всем участникам была проведена компьютерная томография (КТ) височных костей с шагом 0,6 мм и менее. Для обработки данных КТ использовалось программное обеспечение Otoplan, Sliser 3D. Рассчитывались геометрические размеры улитки, длина улиткового канала, угловое положение и тонотопическая частота каждого электрода, строилась 3D-реконструкция улитки и электрода.
Результаты и обсуждение. Коррекцию частотных фильтров электродов и анатомическую настройку процессора проводили по данным, полученным в программе Otoplan. Было проведено сравнение между клинической и анатомической настройкой. После перераспределения частотных фильтров пациенты отмечали более естественное звучание, улучшение разборчивости речи. Таким образом, при анатомической настройке достигается точное соответствие между центральной частотой каждого электродного канала и тонотопической частотой зоны улитки, индивидуально определяемой по данным компьютерной томографии.
Выводы. Появился новый инструмент, позволяющий значительно улучшить качество и обеспечить индивидуальный подход к настройке процессоров после кохлеарной имплантации.
Для цитирования: Левин С.В., Лиленко А.С., Левина Е.А., Кузовков В.Е., Шукурян М.А., Пашкова А.Е., Воронов В.А. Тонотопическая настройка слухового процессора кохлеарного импланта при нормальной анатомии улитки. Медицинский совет. 2023;17(7):124–130. https://doi.org/10.21518/ms2023-125.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Tonotopic fitting of the sound processor cochlear implant in normal cochlea anatomy
Sergey V. Levin1,2, Andrey S. Lilenko1, Elena A. Levina1
Vladislav E. Kuzovkov1, Mikayel Shukuryan3, Aleksandra Е. Pashkova4, Victor A. Voronov2
1 Saint Petersburg Research Institute of Ear, Throat, Nose and Speech; 9, Bronnitskaya St., St Petersburg, 190013, Russia
2 North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya St., St Petersburg, 191015, Russia
3 Yerevan State Medical University after Mkhitar Heratsi; 2, Koryun St., Yerevan, 0025, Armenia
4 Petrovsky National Research Centre of Surgery; 2, Abricosovskii Lane, Moscow, 119991, Russia
Introduction. Cochlear implantation is very effective due to the known tonotopic organization of the cochlea. These data are used in the distribution of signals along the channels of the cochlear implant electrode. The more accurate and natural the stimulation of the auditory nerve fibers, the better the perception of speech, sounds and speech intelligibility.
The aim of the study was to compare the clinical and anatomical settings of the cochlear implant processor.
Materials and methods. The study included 63 patients aged 2 to 60 years using cochlear implantation system, implants with a standard long electrode array (31.5 mm). All participants underwent computed tomography (CT) of the temporal bones with a step of 0.6 mm or less. CT data were processed using Otoplan and Sliser 3D software. The geometric dimensions of the cochlea, the length of the cochlear canal, the angular position and tonotopic frequency of each electrode were calculated, and a 3D reconstruction of the cochlea and electrode was built.
Results. The correction of the frequency filters of the electrodes and the anatomical adjustment of the processor were performed according to the data obtained in the Otoplan program. A comparison was made between the clinical and anatomical setting. After the redistribution of frequency filters, patients noted a more natural sound, improved speech intelligibility. Thus, with anatomical adjustment, an exact correspondence is achieved between the central frequency of each electrode channel and the tonotopic frequency of the cochlear zone, individually determined by computed tomography.
Conclusions. A new tool has appeared that allows you to significantly improve the quality and provide an individual approach to setting up processors after cochlear implantation.
For citation: Levin S.V., Lilenko A.S., Levina E.A., Kuzovkov V.E., Shukuryan M., Pashkova A.Е., Voronov V.A. Tonotopic fitting of the sound processor cochlear implant in normal cochlea anatomy. Meditsinskiy Sovet. 2023;17(7):124–130. (In Russ.) https://doi.org/10.21518/ms2023-125.
Conflict of interest: the authors declare no conflict of interest.
Введение
Кохлеарная имплантация (КИ) применяется при лечении сенсоневральной тугоухости высокой степени и глухоте. При выполнении операции электрод кохлеарного импланта вводится в улитку височной кости для стимуляции слухового нерва. Как показало множество исследований, форма и размеры улитки могут значительно отличаться. По этой причине тип и длина электродной решетки кохлеарного импланта подбирается хирургом индивидуально с использованием данных компьютерной томографии или вычисления длины улиткового канала (ДУК) по данным рентгенографии непосредственно перед операцией [1, 2]. В настоящее время появились различные технологии, позволяющие достаточно точно вычислить длину улиткового канала. Предоперационное планирование с измерением ДУК помогает выбрать правильную длину электрода и тактику хирургического вмешательства [3, 4]. Для измерения могут применяться различные методы. M. Hardy использовал прямой метод для измерения длины улитки на гистологических срезах с помощью микрометра [5]. Непрямой метод реконструировал двухмерную модель с помощью серии гистологических срезов [6, 7]. В связи с появлением персональных компьютеров появилась возможность строить компьютерную 3D-реконструкцию. Была применена компьютерная 3D-модель с использованием гистологических срезов A. Takagi и I. Sando [8]. С 1998 г. КТ стала использоваться для предоперационной диагностики, выявления патологии внутреннего уха, в том числе планирования кохлеарной имплантации. Длина улиткового канала рассчитывалась по размерам улитки (апикальный диаметр и константа спирали) с помощью уравнения Архимеда [9]. В 2012 г. B. Escudé et al. разработали формулу для расчета длины улиткового канала [10]. В дальнейшем было разработано линейное уравнение для измерения средней длины электрода [11]. В настоящее время самым удобным и точным методом является анализ компьютерной томографии с использованием метода G. Alexiades et al. и программным обеспечением Otoplan для планшетов [11, 12]. Этот метод достаточно простой и позволяет определить геометрические размеры улитки и вычислить ДУК.
Программное обеспечение Otoplan позволяет по данным КТ точно рассчитать ДУК. С помощью данного программного обеспечения возможно определить тип и длину электрода, наиболее подходящую для пациента, определить возможные осложнения операции, выделить на 3D-модели основные хирургические ориентиры и анатомические особенности. Провести послеоперационный анализ электрода кохлеарного импланта. Определить на 3D-модели в автоматическом режиме контакты электродной решетки, их местоположение в пространстве. Рассчитать частотное (тонотопическое) положение (глубина введения) контактов электродной решетки в градусах и герцах относительно нервных тканей спирального ганглия и Кортиева органа.
Во время первого подключения системы кохлеарной имплантации используется частотное распределение электродов, приближенное к тонотопической организации улитки. Этот принцип обеспечивает эффективность кохлеарной имплантации. Обычно при клинической настройке используется стандартное частотное распределение, выбираемое по умолчанию в зависимости от типа электрода и стратегии кодирования. По данным исследований, ДУК достаточно сильно варьирует в популяции и может различаться на 30–40% между самой короткой и самой длинной улиткой [5, 10–14]. Такая вариативность при стандартном частотном распределении приводит к несоответствию между частотой электрода и местом в улитке – характерной частотой нейронов, которые он стимулирует. Это несоответствие, особенно у пациентов с постлингвальной глухотой, создает искажения восприятия звуков, передаваемых при помощи КИ и характеристиками звука, которые они ожидают услышать на основе своей слуховой памяти [15–18]. Распределение частот на уровне базилярной мембраны подчиняется логарифмическому закону, известному как функция Гринвуда. Зная ДУК, возможно сопоставить тонотопическое положение волосковых клеток в Кортиевом органе (КО) с частотами, стимулируемыми каждым электродом кохлеарного импланта путем изменения значений частотных фильтров электродов. Для этого необходим наиболее точный расчет данных ДУК [17–19].
Целью данного исследования являлось сравнение клинической и анатомической настройки речевого процессора, включающей тонотопическое картирование электродов кохлеарного импланта с индивидуальным перераспределением частот в улитке в зависимости от расположения электрода. Анатомическая настройка процессора кохлеарного импланта выполнялась с использованием данных компьютерной томографии височных костей при помощи программного обеспечения Otoplan.
Материалы и методы
Объектом исследования стали пациенты с хронической двусторонней сенсоневральной тугоухостью 4-й степени или глухотой, перенесшие КИ. Было включено 63 пациента в возрасте от 2 до 60 лет. Все пациенты являлись пользователями системы КИ: импланты со стандартной длиной электродной решетки (31,5 мм). Всем участникам была проведена КТ височных костей с шагом 0,6 мм и менее. Пациенты были распределены на 2 группы. 1-я группа от 2 до 60 лет. В нее были включены все пациенты. В этой группе проводился анализ анатомических особенностей улитки и положения электрода. Во 2-ю группу были включены постлингвальные пациенты от 14 до 60 лет. Пациентам 2-й группы проводилась тональная аудиометрия, речевая аудиометрия до и после частотного распределения электродов. Критериями исключения являлись: аномалии развития внутреннего уха, менингит в анамнезе. Введение электродной решетки через кохлеостому. Для обработки данных КТ использовалось программное обеспечение Otoplan версии 1.4.0, Sliser 3D версии 5.0.3. Коррекцию частотных фильтров электродов и анатомическую настройку процессора проводили по данным, полученным в программе Otoplan. Рассчитывались геометрические размеры улитки, ДУК, угловое положение и тонотопическая картина каждого электрода, строилась 3D-реконструкция улитки и электрода.
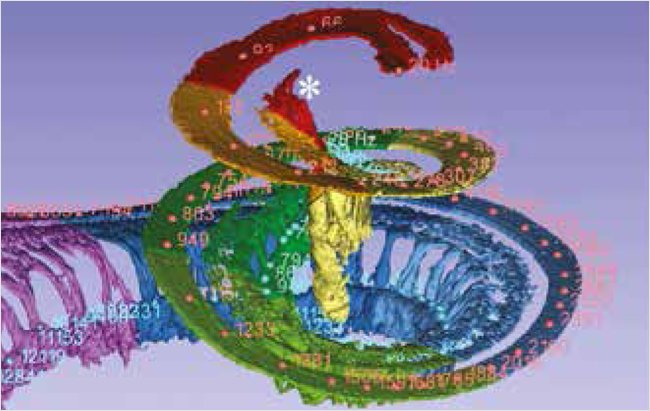
Для настройки процессоров, перераспределения частот фильтров по данным тонотопического исследования использовалась программа Maestro версии 9.0.4, в которой во время анатомической настройки перераспределялись центральные частоты электродов. Для вычисления длины канала улитки (Cochlear Duct Length) и частотного положения каждого электрода используются формулы, разработанные с применением данных анатомии полученной на синхротроне с высокой точностью 3D-реконструкции до 0,009 мм. Использовались данные исследования, в котором дендриты слухового нерва были индивидуально прослежены от базилярной мембраны до спирального ганглия для каждой частоты в режиме 3D-реконструкции улитки, что позволило провести трехмерный анализ тонотопики спирального ганглия. Также были получены угловые частоты для BM и SG и их соответствие тонотопической частоте (рис. 1) [20].
Рисунок 1. Данные тонотопической организации улитки, полученные с применением синхротрона
ДУК для каждой частоты (А) и общая длина (Б) вычислялись по формулам [11]:
А: CDLoc(q) = [rBTL(q) * [1,18 * (Aoc) + 2,69 * (Boc) – √ 0,72 * Aoc * Boc]] + 2,5
Б: CDLoc(q) = [1,71 * [1 * 1,18 * (Aoc) + 2,69 * (Boc) – √ 0,72 * Aoc * Boc] + 0,18] + 2,5
В программе Maestro формула перераспределения частотного диапазона работает таким образом, что частоты будут максимально согласованы в диапазоне 950–3000 Гц. Эти зоны наиболее важны для разборчивости речи. Электроды с частотами ниже 950 Гц кодируют тонкую структуру, поэтому для них выбрано частотное кодирование, а не согласование топики как более важное для разборчивости речи. В диапазоне ниже 950 Гц и выше 3000 Гц используется остаточное логарифмическое распределение частоты между электродами. На рис. 2, 3 показано перераспределение частоты в зависимости от местоположения электродной решетки.
Рисунок 2. Анатомическое распределение частот электродной решетки в программе Maestro
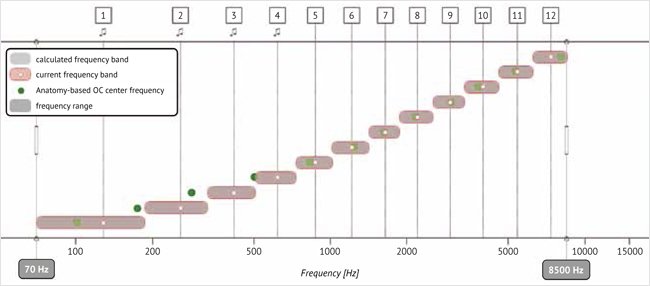
| Lower frequency [Hz] | 70 | 187 | 330 | 508 | 731 | 1016 | 1418 | 1870 | 2532 | 3373 | 4590 | 6246 |
| Center frequency [Hz] | 128 | 258 | 419 | 620 | 874 | 1217 | 1644 | 2201 | 2952 | 3982 | 5418 | 7373 |
| Upper frequency [Hz] | 187 | 330 | 508 | 731 | 1016 | 1418 | 1870 | 2532 | 3373 | 4590 | 6246 | 8500 |
| Bandwidth [Hz] | 117 | 143 | 178 | 223 | 285 | 402 | 452 | 662 | 841 | 1217 | 1656 | 2254 |
Примечание. Зеленая точка – анатомическое положение центральной частоты канала. Белая точка – реальное положение центральной частоты канала.
Рисунок 3. Частотные фильтры до частотного перераспределения, после частотного перераспределения
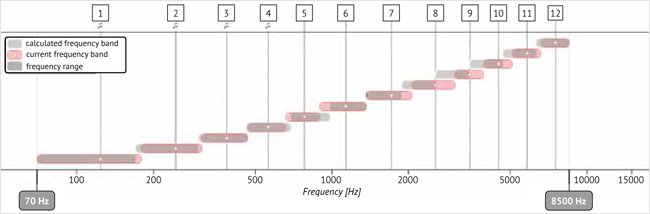
| Lower frequency [Hz] | 70 | 179 | 309 | 467 | 660 | 899 | 1371 | 2058 | 3034 | 3925 | 5078 | 6570 |
| Center frequency [Hz] | 124 | 244 | 388 | 564 | 780 | 1135 | 1714 | 2546 | 3480 | 4502 | 5824 | 7535 |
| Upper frequency [Hz] | 179 | 309 | 467 | 660 | 899 | 1371 | 2058 | 3034 | 3925 | 5078 | 6570 | 8500 |
| Bandwidth [Hz] | 109 | 130 | 158 | 193 | 239 | 472 | 687 | 976 | 891 | 1153 | 1492 | 1930 |
Примечание. Частотные фильтры до частотного перераспределения – серый прямоугольник, после частотного перераспределения – прямоугольник в тонкой рамке.
Полученные карты оценивались испытуемыми до и через 1 час после анатомической настройки процессора. Проводились анкетирование, тональная пороговая аудиометрия, речевая аудиометрия. Статистический анализ проводился с применением программного обеспечения Статистика 10, Excel. Исследование было одобрено этическим комитетом, от всех пациентов было получено информированное согласие.
Результаты и обсуждение
Нами были проанализированы результаты расположения электродной решетки в улитке височной кости. Из данного анализа были исключены пациенты с аномалией внутреннего уха, неполным введением электрода, после перенесенного менингита. Анализировалось топическое расположение электродов стандартной длины введения 31,5 мм, как наиболее часто используемых.
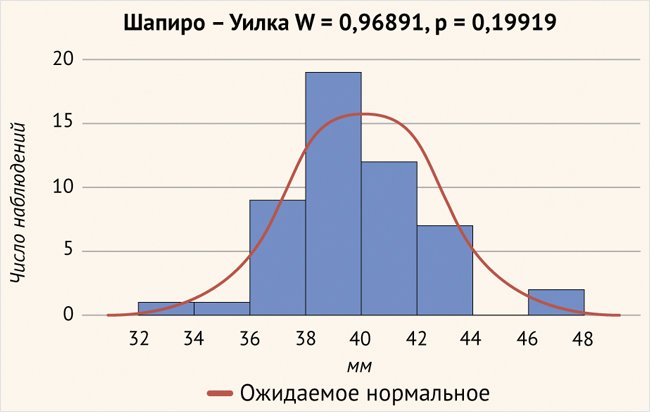
Нами были получены следующие данные: средняя ДУК, рассчитанная в программе Otoplan, составила 39,83 ± 2,59 мм (33,4–46,3 мм; рис. 4).
Рисунок 4. Длина улиткового канала (р > 0,05)
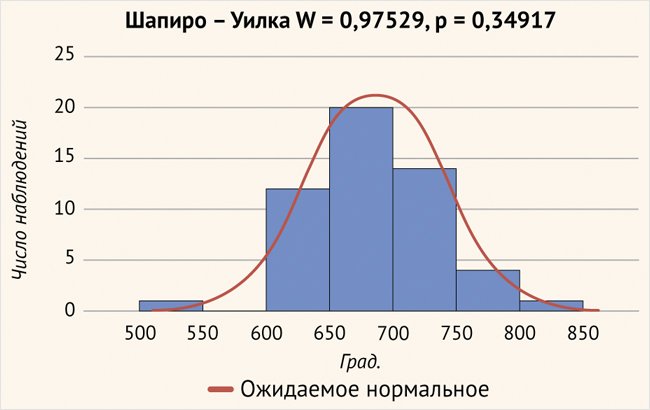
Средняя глубина введения 1 электрода составила 685,03 ± 50,34 град., минимальное введение – 542,6 град., максимальное введение было вычислено на глубине 848,1 град. (рис. 5).
Рисунок 5. Глубина введения электродной решетки в улитку (р > 0,05)
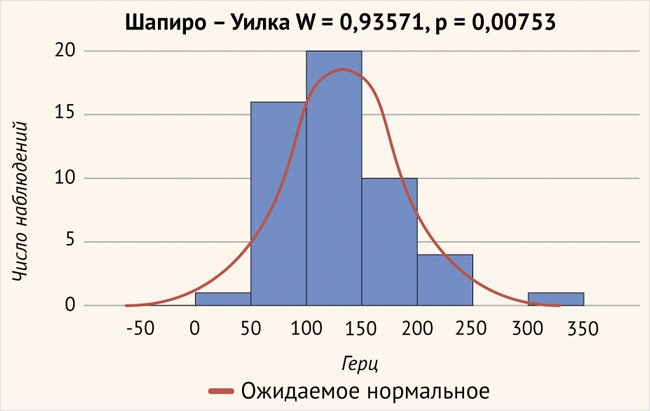
При определении тонотопической частоты нервных волокон в зоне расположения первого (апикального) электрода были получены следующие данные:
- среднее значение – 127,2 ± 55,7 Гц;
- минимальные значения – 7,4 Гц;
- максимальные – 342,1 Гц (рис. 6).
Рисунок 6. Расположение первого (апикального) электрода в улитке (р > 0,05)
Частота нервных волокон рассчитывалась по формуле, применяемой в Otoplan, с учетом латерального расположения электродной решетки. Это положение электрода обеспечивает стимуляцию дендритов слухового нерва, подходящих к Кортиеву органу и обеспечивающих наиболее детальное восприятие электрической стимуляции.
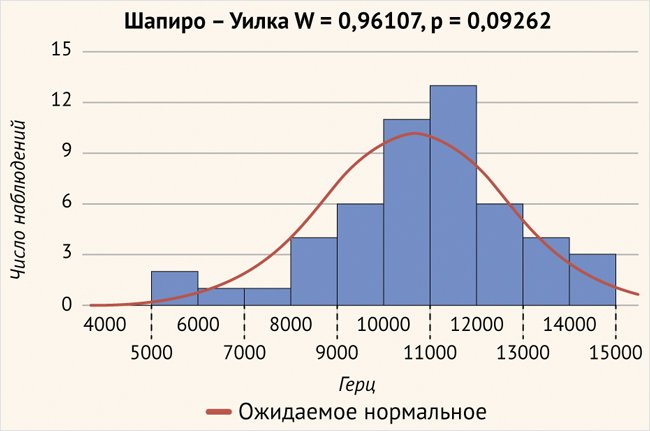
По данным исследования, расположение 12-го (базального) электрода сильно вариативно. Средние значения составили 10793,21 ± 2044,45 Гц и находились в пределах от 5219,3 Гц – 111,3 град. от круглого окна до 14748,6 Гц – 4,7 град. от круглого окна (рис. 7).
Рисунок 7. Расположение 12-го (базального) электрода в улитке (р > 0,05)
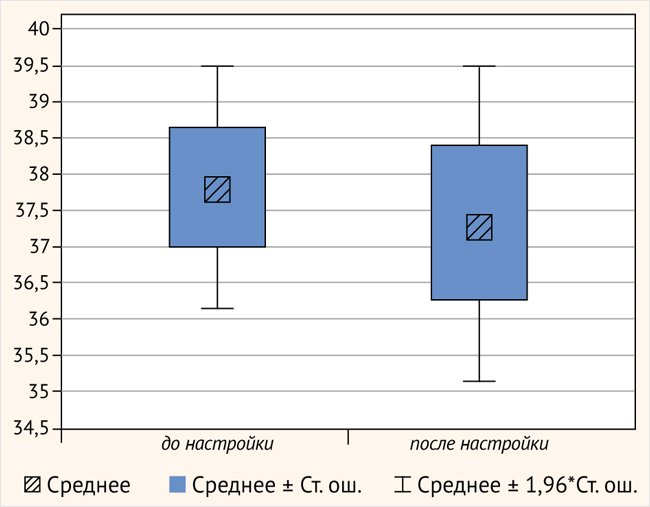
Аудиологические результаты. Аудиометрия и разборчивость речи определялись в группе постлингвальных испытуемых в возрасте от 14 до 59 лет, имеющих опыт ношения КИ. В эту группу вошли 13 человек. Всем испытуемым была выполнена аудиометрия, средние значения порогов (ПТА) составили 37,8 ± 3,07 и 37,3 ± 3,99 (t = 0,77, p = 0,45) после перераспределения частоты. Не было обнаружено статистической разницы до и после проведения аудиометрии (рис. 8).
Рисунок 8. Пороги тональной аудиометрии до и после анатомической настройки
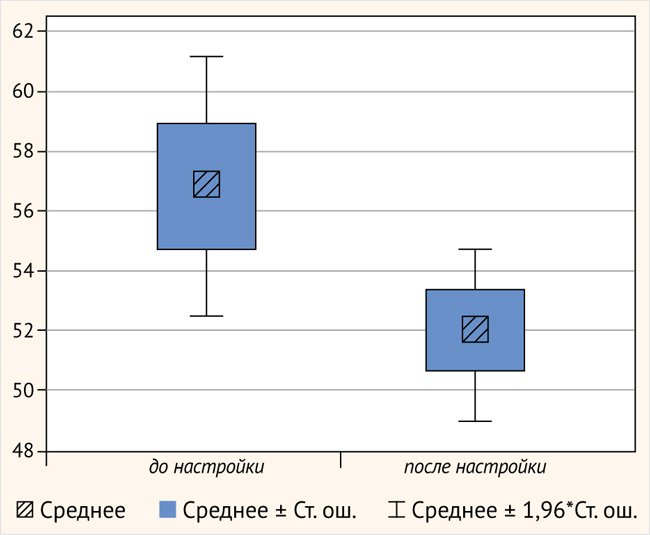
Также всем испытуемым в данной группе было проведено тестирование разборчивости речи. Средние значения порогов составили 56,9 ± 7,78 и 51,9 ± 5,5 (t = 2,66, p = 0,02) после перераспределения частоты. Тестирование разборчивости речи показало статистически значимую разницу разборчивости до и после перераспределения частот (рис. 9).
Рисунок 9. Разборчивость речи до и после анатомической настройки
После анатомической настройки 7 человек отметили субъективное улучшение звука в КИ. Не заметили субъективных различий 4 человека и 2 испытуемых отметили ухудшение качества звука (неприятно непривычное звучание), которое на следующий день прошло.
Выводы
Появился новый инструмент, позволяющий оптимизировать предоперационную диагностику при проведении кохлеарной имплантации, выбор электрода и планирование операции КИ. Также этот метод применим в послеоперационной реабилитации в том числе для анатомической настройки процессора КИ. Специальное программное обеспечение позволяет с высокой точностью проводить диагностику состояния внутреннего уха с использованием компьютерной томографии. Эти технологии позволяют значительно улучшить качество реабилитации и обеспечить индивидуальный подход к настройке процессоров после кохлеарной имплантации. При анатомической настройке достигается точное соответствие между центральной частотой каждого электродного канала и частотами нервных тканей расположенных в зоне электродной решетки.
Список литературы / References
- Кузовков В.Е., Сугарова С.Б., Лиленко А.С., Преображенская Ю.С., Каляпин Д.Д. Хирургический этап кохлеарной имплантации у детей с врожденной синдромальной глухотой. Folia Otorhinolaryngologiae et Pathologiae Respiratoriae. 2020;26(4):30–37. Режим доступа: https://www.elibrary.ru/. / Kuzovkov V., Sugarova S., Lilenko A., Preobrazhenskaya Y., Kaliapin D. Cochlear implantation surgical stage in children with congenital syndromic deafness. Folia Otorhinolaryngologiae et Pathologiae Respiratoriae 2020;26(4):30–37. (In Russ.) Available at: https://www.elibrary.ru/.
- Милешина Н.А., Федосеев В.И., Володькина В.В. Особенности ведения пациентов после кохлеарной имплантации с последствиями травм височно-теменной области. Folia Otorhinolaryngologiae et Pathologiae Respiratoriae. 2021;27(3):77–84. doi: 10.33848/foliorl23103825-2021-27-3-77-84. / Mileshina N.A., Fedoseev V.I., Volodkina V.V. Peculiarities of management of patients after cochlear implantation with the consequences of injuries of the temporo-parietal region. Folia Otorhinolaryngologiae et Pathologiae Respiratoriae. 2021;27(3):77–84. (In Russ.) doi: 10.33848/foliorl23103825-2021-27-3-77-84.
- Левин С.В., Кузовков В.Е., Левина Е.А., Шапорова А.В., Сугарова С.Б. Настройка процессоров кохлеарного импланта с учетом индивидуальной анатомии улитки. В: Янов Ю.К., Рязанцев С.В. (ред.). Материалы XX съезда оториноларингологов России. Москва, 6–9 сентября 2021 г. СПб.: Полифорум Групп; 2021. С. 222–223. Режим доступа: http://otolar-centre.ru/. / Levin S.V., Kuzovkov V.E., Levina E.A., Shaporova A.V., Sugarova S.B. Cochlear implant fitting according to the individual anatomical peculiarities. In: Yanov Yu.K., Ryazantsev S.V. (eds.). Materials XX congress otorhinolaryngologists Russia. Moscow, September 6–9, 2021. St Petersburg: Poliforum Grupp; 2021, pp. 222–223. (In Russ.) Available at: http://otolar-centre.ru/.
- Кузовков В.Е., Чернушевич И.И., Сугарова С.Б., Лиленко А.С., Каляпин Д.Д., Луппов Д.С. Алгоритм диагностического обследования и хирургического этапа кохлеарной имплантации у пациентов с различной этиологией врожденной глухоты. Российская оториноларингология. 2022;21(2):45–50. doi: 10.18692/1810-4800-2022-2-45-50. / Kuzovkov V.E., Chernushevich I.I., Sugarova S.B., Lilenko A.S., Kalyapin D.D., Luppov D.S. Algorithm of diagnostics and surgery stage of cochlear implantation in patients with various congenital deafness etiology. Rossiiskaya Otorinolaringologiya. 2022;21(2):45–50. (In Russ.) doi: 10.18692/1810-4800-2022-2-45-50.
- Hardy M. The length of the organ of corti in man. Am J Anat. 1938;62:291–311. doi: 10.1002/aja.1000620204.
- Guild S. A graphic reconstruction method for the study of the organ of corti. Anat Rec. 1921;22:140–157. doi: 10.1002/ar.1090220205.
- Schuknecht H. Techniques for study of cochlear function and pathology in experimental animals: development of the anatomical frequency scale for the Cat. Arch Otolaryngol. 1953;58(4):377–397. doi: 10.1001/archotol.1953.00710040399001.
- Takagi A., Sando I. Computer-aided three-dimensional reconstruction: a method of measuring temporal bone structures including the length of the cochlea. Ann Otol Rhinol Laryngol. 1989;98(7 Pt 1):515–522. doi: 10.1177/000348948909800705.
- Ketten D., Skinner M., Wang G., Vannier M., Gates G., Neely J. In vivo measures of cochlear length and insertion depth of nucleus cochlear implant electrode arrays. Ann Oto Rhinol Laryngol. 1998;175:1–16. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Escudé B., James C., Deguine O., Cochard N., Eter E., Fraysse B. The size of the cochlea and predictions of insertion depth angles for cochlear implant electrodes. Audiol Neurootol Suppl. 2006;(1):27–33. doi: 10.1159/000095611.
- Alexiades G., Dhanasingh A., Jolly C. Method to estimate the complete and two-turn cochlear duct length. Otol Neurotol. 2015;36(5):904–907. doi: 10.1097/MAO.0000000000000620.
- Canfarotta M., Dillon M., Buss E., Pillsbury H., Brown K., O’Connell B. Validating a new tablet-based tool in the determination of cochlear implant angular insertion depth. Otol Neurotol. 2019;40(8):1006–1010. doi: 10.1097/MAO.0000000000002296.
- Кац Л.К., Митрофанова Т.В. Некоторые аспекты морфометрии внутреннего уха человека. Forcipe. 2022;5(3):33–44. Режим доступа: https://ojs3.gpmu.org/. / Kats L.K., Mitrofanova T.V. Some aspects of morphometry of the human inner ear. Forcipe. 2022;5(3):33–44. (In Russ.) Available at: https://ojs3.gpmu.org/.
- Asadi H., Mohamed S., Lim C.P., Nahavandi S., Nalivaiko E. Semicircular canal modeling in human perception. Rev Neurosci. 2017;28(5):537–549. doi: 10.1515/revneuro-2016-0058.
- Würfel W., Lanfermann H., Lenarz T., Majdani O. Cochlear length determination using cone beam computed tomography in a clinical setting. Hear Res. 2014;(316):65–72. doi: 10.1016/j.heares.2014.07.013.
- Verbist B.M., Ferrarini L., Briaire J.J., Zarowski A., Admiraal-Behloul F., Olofsen H. et al. Anatomic considerations of cochlear morphology and its implications for insertion trauma in cochlear implant surgery. Otol Neurotol. 2009;30(4):471–477. doi: 10.1097/MAO.0b013e3181a32c0d.
- Levin S.V., Kuzovkov V.E., Levina E.A., Pudov N.V. Rehabilitation of patients with a cochlear implant using artificial intelligence algorithms. Journal of Hearing Science. 2022;12(1):183–184. Available at: https://elibrary.ru/.
- Svirsky M.A., Talavage T.M., Sinha S., Neuburger H., Azadpour M. Gradual adaptation to auditory frequency mismatch. Hear Res. 2015;322:163–170. doi: 10.1016/j.heares.2014.10.008.
- Янов Ю.К., Левин С.В., Вахрушев С.Г., Наркевич А.Н., Кузовков В.Е., Россиев Д.А. и др. Реабилитация глухих детей после кохлеарной имплантации с применением интеллектуальной нейросетевой системы. Медицинский академический журнал. 2016;16(1):90–96. doi: 10.17816/MAJ16190-96. / Yanov Y.K., Levin S.V., Vaсhrushev S.G., Narkevich A.N., Kuzovkov V.E., Rossiev D.A. et al. Rehabilitation of deaf children after cochlear implantation using an intelligent neural net system. Medical Academic Journal. 2016;16(1):90–96. (In Russ.) doi: 10.17816/MAJ16190-96.
- Li H., Helpard L., Ekeroot J., Rohani S.A., Zhu N., Rask-Andersen H., Ladak H.M., Agrawal S. Three-dimensional tonotopic mapping of the human cochlea based on synchrotron radiation phase-contrast imaging. Sci Rep. 2021;11:4437. Available at: https://www.nature.com/.