Журнал "Атеротромбоз" №2/2020
DOI: 10.21518/2307-1109-2020-2-161-168
Ю.В. Ларчикова, А.Д. Эрлих
И.Н. Сметанина, Н.Ю. Желтов
Городская клиническая больница №29 им. Н.Э. Баумана; 111020, Россия, Москва, Госпитальная площадь, д. 2
Парадоксальная тромбоэмболия из-за наличия открытого овального окна (ООО) – явление довольно редкое, тем более когда в результате эмболии развивается острый инфаркт миокарда (ИМ). Представленный клинический случай парадоксальной эмболии интересен по нескольким причинам: во-первых, первичным заболеванием у пациента стал тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА), во-вторых, по-видимому, именно из-за ТЭЛА и последующей перегрузки правых отделов сердца скрытое ООО стало явным, в-третьих, причиной парадоксальной эмболии стали, по-видимому, фрагменты большого тромба, застрявшего в ООО, в-четвертых, сложившаяся клиническая ситуация была неоднозначной в отношении принятия медицинских решений, в первую очередь касающихся антитромботической терапии.
Для цитирования: Ларчикова Ю.В., Эрлих А.Д., Сметанина И.Н., Желтов Н.Ю. Клинический случай парадоксальной эмболии, вызвавшей острый инфаркт миокарда после тромбоза глубоких вен. Атеротромбоз. 2020;(2):161-168. doi: 10.21518/2307-1109-2020-2-161-168.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Clinical case of a paradoxical embolism that caused an acute myocardial infarction after deep vein thrombosis
Yuliya V. Larchikova, Aleksey D. Ehrlikh
Irina N. Smetanina, Nikita Yu. Zheltov
Bauman City Clinical Hospital No. 29; 2, Gospitalnaya Square, Moscow, 111020, Russia
Paradoxical thromboembolism due to the presence of an patent foramen ovale (PFO) is a rather rare phenomenon, especially when an embolism results in acute myocardial infarction (MI). The presented clinical case of the paradoxical embolism is interesting for several reasons: firstly, the patient’s primary disease was deep vein thrombosis (DVT) and pulmonary artery thromboembolism (PATE); secondly, apparently, it was due to PATE and the subsequent overload of the right side of the heart that the latent embolism became apparent; thirdly, the paradoxical embolism was apparently caused by the fragments of a large thrombus stuck in PFO, fourthly, the current clinical situation was ambiguous with respect to medical decisions, primarily concerning antithrombotic therapy.
For citation: Larchikova Yu.V., Ehrlikh A.D., Smetanina I.N., Zheltov N.Yu. Clinical case of a paradoxical embolism that caused an acute myocardial infarction after deep vein thrombosis. Aterotromboz = Atherothrombosis. 2020;(2):161-168. (In Russ.) doi: 10.21518/2307-1109-2020-2-161-168.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Случаи парадоксальной тромбоэмболии в клинической практике довольно редки, и чаще всего парадоксальная эмболия через открытое овальное окно (ООО) влечет за собой развитие инсульта [1]. Но представленный нами клинический случай интересен не только тем, что парадоксальная эмболия привела к развитию острого инфаркта миокарда (ИМ), но также и тем, что она произошла после обычной тромбоэмболии легочной артерии (ТЭЛА), источником которой стал тромбоз глубоких вен (ТГВ), а также то, что клиническая ситуация заставила последовательно принимать разные, порой неоднозначные решения, касающиеся как общей тактики ведения пациента, так и отдельно его антитромботического лечения.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент Ч., мужчина 62 лет, был госпитализирован в приемное отделение нашей больницы с рабочим диагнозом «состояние после обморока». Утром, в три часа, до госпитализации в покое внезапно появилась сильная слабость и было два следующих друг за другом коротких синкопальных состояний, каждое из которых длилось около 10 с. Известно, что ранее у пациента не было никаких известных хронических заболеваний, что никаких препаратов он регулярно не принимает. При поступлении в стационар пациент жаловался на сохраняющуюся небольшую слабость. При первичном осмотре отмечалась небольшая бледность кожи, не было цианоза, отеков или несимметричности ног. Пациент с признаками ожирения (масса тела 130 кг, индекс массы тела 38 кг/м2), с нормальной температурой тела, нормальным артериальным давлением (125/80 мм рт. ст., примерно одинаковым на обеих руках), с тахикардией 120 уд/мин, но без дефицита пульса, без аускультативно определяемых хрипов в легких, шумов или SIII в сердце, с показателем SO2 93%. На исходной ЭКГ, зарегистрированной при поступлении (рис. 1А), обнаружена полная блокада правой ножки пучка Гиса с признаками SI-QIII. Несмотря на то что эти изменения ЭКГ могут считаться неспецифичными, при поступлении в стационар возникло подозрение на то, что причиной ухудшения самочувствия явилась ТЭЛА. Согласно современным клиническим руководствам у пациента без нарушения гемодинамики была оценена клиническая вероятность ТЭЛА, которая по шкалам Geneva и Wells была расценена как промежуточная. Сразу после этого был выявлен значительно повышенный уровень D-димера – 27700 нг/мл и начато лечение эноксапарином – 1,3 мл п/к.
В первые сутки госпитализации были выполнены УЗДГ вен ног (выявлен необтурирующий тромбоз вен правой голени и общей бедренной вены с флотацией верхушки тромба 1,0 см), эхокардиография (ЭхоКГ) (выявлено снижение сократимости правого желудочка, легочная гипертензия – систолическое давление в легочной артерии 60 мм рт. ст., относительное увеличение размеров правого желудочка – ПЖ = ЛЖ, с сохранной фракцией выброса левого желудочка [ФВЛЖ] и отсутствием нарушений локальной сократимости ЛЖ), компьютерная томография легочной артерии (КТЛА) (дефекты контрастирования правой и левой легочных артерий с распространением на все долевые и сегментарные ветви). Не было значительных нарушений в показателях крови. Клиренс креатинина по Кокрофту – Гоулту – 140 мл/мин.
Таким образом, у пациента была подтверждена ТЭЛА с источником в виде ТГВ. Для определения тактики лечения был оценен риск по шкале PESI, который составил 92 балла (PESI III), и определен уровень тропонина I высокочувствительным методом (0,12 нг/мл при норме до 0,023 нг/мл). С учетом выявления у пациента признаков промежуточно-высокого риска он был госпитализирован в отделение кардиореанимации для мониторного наблюдения. Было продолжено лечение эноксапарином 1,3 мл п/к 2 раза в день.
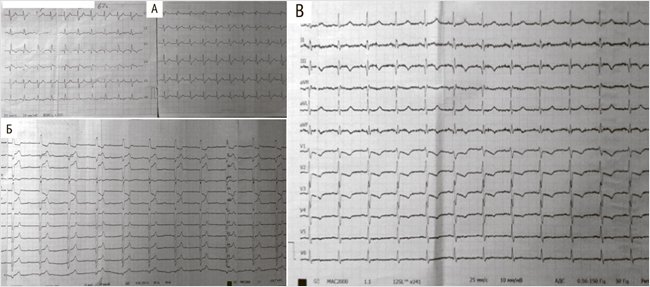
По прошествии 2 сут. состояние пациента оставалось стабильным, и было решено перевести пациента в палату и перейти на лечение одним из не-витамин-К-связанных оральных антикоагулянтов (НОАК). Однако через 50 ч от госпитализации пациент пожаловался на сильную боль за грудиной, слабость, а на ЭКГ появились подъемы сегмента ST > 1 мм в II, III, aVF и реципрокные депрессии ST, а также полная АВ-блокада (рис. 1Б), т.е. появились признаки острого нижнего инфаркта (ИМ) миокарда с подъемами ST.
Рисунок 1. Электрокардиограмма при поступлении в стационар (А), после развития острого ИМ (Б), после выполнения ЧКВ (В)
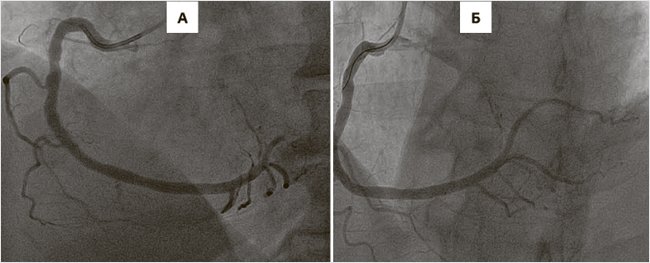
Были даны нагрузочные дозы ацетилсалициловой кислоты (АСК) – 250 мг, тикагрелора – 180 мг и проведена экстренная коронарография (КАГ), во время которой был выявлен 70%-ный стеноз в среднем сегменте передней нисходящей артерии, а также окклюзия проксимальной трети задне-базальной ветви правой коронарной артерии (рис. 2А). Было выполнено чрескожное коронарное вмешательство (ЧКВ) – баллонная дилатация и стентирование одним стентом, выделяющим лекарство (сиролимус) (рис. 2Б). Динамика уровня тропонина – повышение до 4,2 нг/мл, появление новых зон локального гипокинеза ЛЖ в заднем и нижнем сегментах формально подтвердили наличие острого ИМ. АВ-блокада разрешилась спонтанно во время проведения ЧКВ. Было продолжено лечение АСК 100 мг/сут, тикагрелором 180 мг/сут, терапевтической дозой эноксапарина, аторвастатином 80 мг/сут.
Рисунок 2. Результаты коронарографии: до ЧКВ (А) и после ЧКВ (Б)
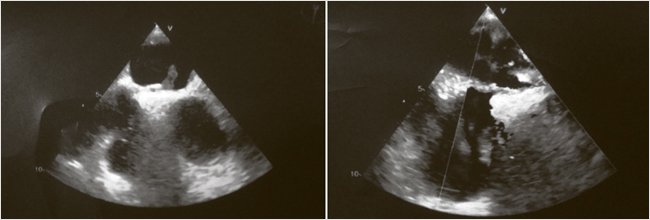
Было предположено, что генез острого ИМ мог быть связан с парадоксальной эмболией, и было решено выполнить чреспищеводную эхокардиографию (ЧПЭхоКГ). На 3-и сут. острого ИМ при ЧПЭхоКГ в полости правого предсердия выявлено подвижное лентовидное гиперэхогенное образование (с высокой вероятностью тромб) 4,0 х 7,0 см, соединенное с образованием, заполняющим овальную ямку 1,2 х 0,3 см и проникающим через овальное окно в полость левого предсердия, где визуализируется его подвижная часть 1,8 х 0,5 см (рис. 3). То есть ООО с выявленным тромбом стали косвенным подтверждением парадоксальной эмболии как причины острого ИМ. В эти же сутки на эзофагогастроскопии (ЭГДС) у пациента была выявлена язва луковицы 12-перстной кишки 0,4 см, покрытая фибрином (Forrest III), эрозивный гастрит и эрозивный бульбит.
Рисунок 3. Эхокардиографические признаки тромба в ООО, в правом и левом предсердиях
Было продолжено лечение эноксапарином в терапевтической дозе еще на 7 дней, после чего вместо него было продолжено лечение апиксабаном 5 мг 2 раза/сут. (без дозы 20 мг/сут, т. к. от начала выявления и лечения тромбоза уже прошло более 7 дней), была отменена АСК, а вместо тикагрелора (менее изученного в сочетании с НОАК при остром ИМ и ЧКВ) был назначен клопидогрел начиная с нагрузочной дозы 300 мг. Кроме того, пациент получал аторвастатин 80 мг/сут, эналаприл 10 мг/сут, метопролола тартрат 100 мг/сут, омепразол 40 мг (с перспективой замены на пантопразол).
На 10-е сут. от развития острого ИМ была выполнена повторная ЧПЭхоКГ, при которой не было выявлено тромбов правого и левого предсердий, а через ООО лоцировался минимальный кровоток. Также была выполнена повторная УЗДГ вен ног, на которой сохранялся тромбоз до верхней трети бедренной вены без признаков флотации.
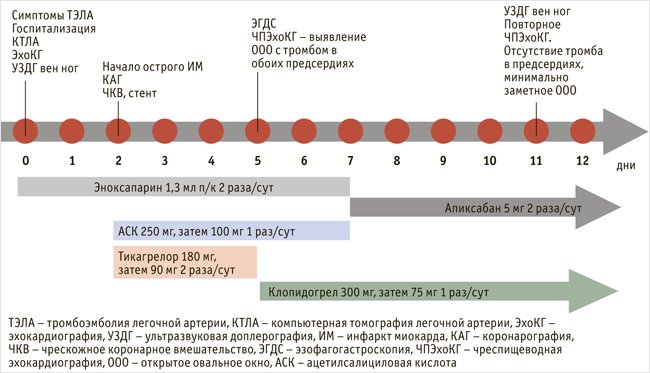
Пациент был выписан на амбулаторное лечение на 12-е сут. от госпитализации с рекомендациями принимать клопидогрел 75 мг/сут в течение 12 мес., апискабан 10 мг/сут не менее 12 мес. (с обсуждением возможности и необходимости продления антикоагулянтного лечения). Общая схема обследования и лечения пациента представлена на рис. 4.
Рисунок 4. Общая схема обследования и лечения пациента
ОБСУЖДЕНИЕ
Представленный здесь клинический пример кажется нам интересным как минимум по двум причинам: во-первых, здесь представлен довольно редкий случай т. н. парадоксальной эмболии, а во-вторых, у пациента наличие ТЭЛА сочеталось с острым ИМ (или, точнее, осложнилось острым ИМ), что несколько затруднило выбор его антитромботического лечения.
В отношении парадоксальной эмболии можно выделить следующие клинические проблемы: а) выяснить на раннем этапе острого ИМ, развившегося после ТГВ/ТЭЛА, является ли он проявлением парадоксальной эмболии; б) если острый ИМ был проявлением эмболии, то надо ли было выполнять коронарное стентирование; в) как правильно надо было поступить с тромбом в ООО: тромболизис, хирургическое лечение, медикаментозное лечение; в) какой должна быть оптимальная медикаментозная терапия.
В отношении сочетания острого ИМ и ТЭЛА также были важные клинические проблемы, которые в основном заключались в выборе наиболее эффективного и безопасного сочетания антикоагулянта и антиагреганта.
Эмболия или тромбоз?
Этот вопрос, как кажется, наиболее интересен в представленном клиническом случае, т. к. ни сам пациент, ни его врачи до выявления тромба в ООО не знали о наличии этого дефекта, а данные трансторакальной эхокардиографии наличие ООО не выявили. Поэтому, с одной стороны, развитие острого ИМ с подъемами ST вскоре после выявления ТГВ/ТЭЛА должно было заставить врачей заподозрить ООО (что и случилось), а с другой – нельзя было полностью исключить, что развитие острого ИМ стало следствием некоей «тромботической активности», которая изначально привела к появлению ТГВ/ТЭЛА [2]. Косвенно на возможность развития у пациента тромботической окклюзии указывают такие обстоятельства, как сочетание его факторов риска сердечно-сосудистых заболеваний (возраст, мужской пол, артериальная гипертония и проч.), а также то, что при КАГ окклюзированная ветвь ПКА хотя и являлась инфаркт-связанной артерией, была не единственным пораженным участком коронарного русла.
При этом сумма клинических данных и суждения здравого смысла говорят, скорее, о том, что острый ИМ был следствием эмболии. Согласно имеющимся литературным данным, острый ИМ, развившийся вследствие наличия ООО, встречается гораздо реже, чем острое нарушение мозгового кровообращения. Об этом также говорится в опубликованной в 2018 г. позиции европейских экспертов по ведению пациентов с ООО [1]. Эксперты отмечают, что ООО встречается примерно в 25% в общей популяции и чаще всего выявляется случайно у пациентов с необъяснимой эмболией по большому кругу кровообращения. С учетом превалирования случаев эмболического инсульта, согласно этому документу, алгоритм диагностики ООО включает в себя использование контрастной транскраниальной доплерографии, которая может быть выполнена в случае негативного или сомнительного результата ЭхоКГ. Но при том, что данные о диагностике ООО не позволяют установить наличие «золотого стандарта», выполнение ЧПЭхоКГ, по мнению экспертов, является обязательным для подтверждения наличия ООО, заподозренного любым способом.
В этом отношении проведенная в представленном клиническом случае диагностика кажется авторам оптимальной, позволившей с большой вероятностью установить эмболический генез острого ИМ. О том, что такая диагностика должна быть проведена, упоминают авторы различных опубликованных клинических случаев [3–6]. При этом важно отметить, что, вероятно, именно дисфункция, перегрузка и дилатация правых отделов сердца вследствие ТЭЛА стали вероятной причиной того, что имеющееся у нашего пациента скрытое ООО (а оно не было различимо при трансторакальной ЭхоКГ ни до, ни после ЧПЭхоКГ) превратилось в явное, предоставив больше возможностей для эмболии.
Нужно ли было стентировать инфарктсвязанную артерию?
К сожалению, теоретическая возможность тромботического ИМ у пациента с факторами риска и стенозами нескольких коронарных артерий, а также то, что окклюзирована была довольно мелкая ветвь, не дали возможность полностью во время проведения КАГ ответить на вопрос, что именно стало причиной острого ИМ: тромбоз или эмболия. Поэтому в сложившейся ситуации было решено выполнить установку стента в пораженную артерию. И кажется, что это решение было правильным, особенно с учетом того, что развитие коронарной окклюзии сопровождалось развитием полной АВ-блокады, а значит, рецидив (вероятность которого без стентирования была бы выше) мог также привести к неблагоприятным последствиям. С другой стороны, из соображений меньшего риска кровотечений во время выполнения КАГ очень заманчивой казалась перспектива отказаться от установки стента. В этом случае удалось бы избежать (или сократить до минимума) сочетания антикоагулянта с одним или двумя антиагрегантами. Но в момент КАГ наличие ООО было только заподозрено, а риск рецидива возможного коронарного тромбоза был вполне реальным. Поэтому, кажется, решение выполнить стентирование инфаркт-связанной артерии тоже было правильным.
Что делать с тромбом в полости сердца?
Наличие тромбов в полости правого предсердия довольно часто встречается у пациентов с ТЭЛА. По данным Шведского регистра, они встречались примерно у 10% у пациентов с ТЭЛА. При этом у 36% пациентов с выявленным тромбом в правом предсердии находились признаки ТЭЛА [7]. Как уже упоминалось выше, существует несколько подходов к лечению тромбоза предсердий: механическое удаление и медикаментозное лечение (тромболизис или антикоагулянт) [8]. При этом нет ясного однозначного суждения о том, какой же из методов лечения лучше. В довольно старом наблюдательном исследовании (1966–2000 гг.), собравшем 177 случаев лечения тромбов предсердий [9], была показана относительная безопасность тромболизиса по сравнению с механическим удалением тромба или антикоагулянтами. Однако совершенно очевидно, что вероятные осложнения тромболизиса на фоне терапевтической антикоагуляции (особенно риск внутричерепного кровотечения или фрагментации тромба с массивной распространенной эмболией) в случае с нашим пациентом делали применение тромболииса потенциально опасным. Механическое удаление тромба в нашем случае также не рассматривалось, во-первых, ввиду отсутствия необходимых инструментов, а во-вторых, из-за сомнительных доказательств очевидной пользы от такого воздействия на тромбы относительно небольших размеров. Именно поэтому было выбрано продолжение антикоагулянтного лечения. По данным литературы, адекватная антикоагуляция с НМГ или НОАК способствовала исчезновению тромбов в более половине случаев [10–12].
Какой должна быть оптимальная антитромботическая терапия?
Обсуждение этой части можно разделить на разные этапы болезни пациента. Изначально лечение пациента с ТЭЛА и признаками умеренно-высокого риска проводилось строго в рамках опубликованных недавно клинических руководств 2019 г. по лечению пациентов с ТЭЛА [13].
В дальнейшем после развития острого ИМ врачи были вынуждены действовать вне установленных правил, т. к. нет ни одного значимого исследования, где было бы изучено антитромботическое лечение после коронарного стентирования у пациентов с острым ИМ и ТГВ/ ТЭЛА. Поэтому пришлось экстраполировать на наш случай имеющиеся результаты клинических исследований c НОАК у пациентов с неклапанной фибрилляцией предсердий, подвергнутых ЧКВ. Это PIONEER-AF PCI с ривароксабаном [14], RE-DUAL PCI с дабигатраном [15] и AUGUSTUS с апиксабаном [16]. В любом случае наш выбор должен был быть ограничен одним из НОАК, каждый из которых как минимум безопаснее варфарина, особенно в сочетании с антиагрегантом. Так как еще до развития острого ИМ пациент получил ривароксабан, казалось логичным это лечение продолжать после ЧКВ. Однако в исследовании PIONEER-AF PCI не было пациентов, получающих полную антикоагулянтную дозу ривароксабана (20 мг/сут), которая показана при ТЭЛА. Именно поэтому после очень короткого периода тройной антитромботической терапии после ЧКВ (аспирин + клопидогрел + эноксапарин) было решено продолжить лечение апиксабаном 5 мг 2 раза в день с клопидогрелом. Такое лечение позволило соблюсти подходы, использованные в исследовании AUGUSTUS, а также не отойти от правил лечения ТЭЛА (стандартная доза апиксабана была назначена без первоначально высокой – 10 мг 2 раза в день, т. к. с момента начала антикоагулянтного лечения уже прошло более 7 дней).
Планируемая длительность сочетания клопидогрела и апиксабана 12 мес. В дальнейшем будет принято решение о продлении комбинированного лечения свыше 12 мес. с возможным переходом на один апиксабан.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай является редким и клинически интересным сочетанием развития острого ИМ у пациента с острым ТГВ/ ТЭЛА. В лечении этого пациента, как и в любом случае сопутствующих тромботических состояний, возникло множество сложностей и проблем, решение которых не прописано в существующих клинических рекомендациях и требующих индивидуальных решений с учетом поиска лучшего соотношения эффективности и безопасности.
Список литературы / References
- Pristipino C., Sievert H., D’Ascenzo F., Louis Mas J., Meier B., Scacciatella P. et al. European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. Eur Heart J. 2019;40(38):3182–3195. doi: 10.1093/eurheartj/ehy649.
- Alias S., Lang I.M. Coagulation and the vessel wall in pulmonary embolism. Pulm Circ. 2013;3(4):728–738. doi: 10.1086/674768.
- Guo S., Roberts I., Missri J. Paradoxical embolism, deep vein thrombosis, pulmonary embolism in a patient with patent foramen ovale: a case report. J Med Case Reports. 2007;1:104. doi: 10.1186/1752-1947-1-104.
- Anyfantakis D., Karona P., Kastanaki P., Kourakos A., Kastanakis M. Multiorgan paradoxical embolism in an elderly female with a patent foramen ovale: a case report. Med Pharm Rep. 2019;92(1):83–86. doi: 10.15386/cjmed-1031.
- Abusnina W., Megri M., Edris B., El-Hamdani M. Arterial embolism in a patient with pulmonary embolism and patent foramen ovale. Proc (Bayl Univ Med Cent). 2019;32(2):256–258. doi: 10.1080/08998280.2019.1576460.
- Falcetta G., Scioti G., Barzaghi C., Bortolotti U. Pulmonary and paradoxical coronary embolism with a patent foramen ovale. Asian Cardiovasc Thorac Ann. 2018;26(5):413–415. doi: 10.1177/0218492318777394.
- Ogren M., Bergqvist D., Eriksson H., Lindblad B., Sternby N.H. Prevalence and risk of pulmonary embolism in patients with intracardiac thrombosis: a population-based study of 23 796 consecutive autopsies. Eur Heart J. 2005;26(11):1108–1114. doi: 10.1093/eurheartj/ehi130.
- Shah C.P., Thakur R.K., Ip J.H., Xie B., Guiraudon G.M. Management of mobile right atrial thrombi: a therapeutic dilemma. J Card Surg. 1996;11(6):428–431. doi: 10.1111/j.1540-8191.1996.tb00077.x.
- Rose P.S., Punjabi N.M., Pearse D.B. Treatment of right heart thromboemboli. Chest. 2002;121(3):806–814. doi: 10.1378/chest.121.3.806.
- Niku A., Shiota T., Siegel R.J., Rader F. Prevalence and Resolution of Left Atrial Thrombus in Patients With Nonvalvular Atrial Fibrillation and Flutter With Oral Anticoagulation. Am J Cardiol. 2019;123(1):63−68. doi: 10.1016/j.amjcard.2018.09.027.
- Lip G.Y., Hammerstingl C., Marin F., Cappato R., Meng I.L., Kirsch B. et al. Left atrial thrombus resolution in atrial fibrillation or flutter: Results a prospective study with rivaroxaban (X-TRA) and a retrospective observational registry providing baseline data (CLOT-AF). Am Heart J. 2016;178:126–134. doi: 10.1016/j.ahj.2016.05.007.
- Ezekowitz M.D., Pollack C.V. Jr., Halperin J.L., England R.D., VanPelt Nguyen S., Spahr J. et al. Apixaban compared to heparin/vitamin K antagonist in patients with atrial fibrillation scheduled for cardioversion: the EMANATE trial. Eur Heart J. 2018;39(32):2959–2971. doi: 10.1093/eurheartj/ehy148.
- Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.J., Harjola V.P. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543–603. doi: 10.1093/eurheartj/ehz405.
- Gibson C.M., Mehran R., Bode C., Halperin J., Verheugt F.W., Wildgoose P. et al. Prevention
of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. N Engl J Med. 2016;375(25):2423–2434. doi: 10.1056/NEJMoa1611594. - Cannon C.P., Bhatt D.L., Oldgren J., Lip G.Y.H., Ellis S.G., Kimura T. et al. Dual Antithrombotic Therapy with Dabigatran after PCI in Atrial Fibrillation. N Engl J Med. 2017;377(16):1513–1524. doi: 10.1056/NEJMoa1708454.
- Lopes R.D., Heizer G., Aronson R., Vora A.N., Massaro T., Mehran R. et al. Antithrombotic Therapy after Acute Coronary Syndrome or PCI in Atrial Fibrillation. N Engl J Med. 2019;380(16):1509–1524. doi: 10.1056/NEJMoa1817083.