Журнал "Медицинский совет" №13, 2019г.
DOI: https://doi.org/10.21518/2079-701X-2019-13-178-182

1Московский государственный медико-стоматологический университет имени А.И. Евдокимова; 2Центр репродукции «Санта-Мария»
Резюме
В статье рассмотрены показания к применению железа карбоксимальтозата, особенности его строения, эффективность и безопасность использования при различных гинекологических заболеваниях, доказанные на основании метаанализа рандомизированных клинических исследований.
Для цитирования: Тихомиров А.Л., Сарсания С.И. Лейомиома матки и ЖДА. Вариант предоперационной подготовки. Медицинский совет. 2019;(13):178-182. doi: 10.21518/2079-701X-2019-13-178-182.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов
Uterine leiomyoma and IDA. Variant of preoperative preparation

1A.I.Yevdokimov Moscow State University of Medicine and Dentistry; 2«Santa-Maria» Reproduction Center
Abstract
The article considers the features of Fe deficite anemia in patients with uterine fibroid. Their own studies of preoperative management of such patients using the drug of bivalent iron and selective protein modulator in progesterone receptors are presented.
For citation: Tikhomirov A.L., Sarsaniya S.I. Uterine leiomyoma and IDA. Variant of preoperative preparation. Meditsinskiy sovet = Medical Council. 2019;(13):178-182. (In Russ.) doi: 10.21518/2079-701X-2019-13-178-182.
Conflict of interest: The authors declare no conflict of interest.
Железодефицитное состояние, или недостаточность железа, определяется как дефицит общего железа, обусловленный несоответствием между его поступлением в организм и расходом (потери или возросшее потребление), приводящим к отрицательному балансу [1].
Железо – это микроэлемент, который попадает в организм только алиментарным путем. Недостаточное поступление железа в организм возможно либо при низком его содержании в пищевом рационе, либо при общем ограничении принимаемой пищи. При сбалансированном питании в желудочно-кишечный тракт (ЖКТ) ежедневно с пищей поступает около 20–30 мг железа, из которого только 1–2 мг попадает в плазму крови. Место всасывания железа –тонкий кишечник. В пище железо находится в трехвалентном виде. Снижение всасывания железа – достаточно распространенная причина возникновения его дефицита, оно возможно при различных заболеваниях ЖКТ, таких как гастриты и энтериты, а также при резекции желудка и кишечника. Кроме того, всасывание двухвалентного железа, в отличие от трехвалентного, может снижаться при взаимодействии этого микроэлемента с определенными лекарственными средствами и пищевыми ингредиентами. Недостаточное поступление железа в организм в результате определенного пищевого поведения и сниженного всасывания его в ЖКТ – это те причины развития железодефицитного состояния, которые не имеют гендерных различий. Остальные причины дефицита железа, а именно повышение потребности в нем при различных физиологических состояниях и хронической кровопотере, встречаются чаще у женщин, чем у мужчин [2].
Анемия – одно из наиболее часто встречаемых состояний у пациенток с гинекологическими заболеваниями.
По мнению ряда авторов, практически все гинекологические заболевания сопровождаются развитием реакции системного воспалительного ответа, что приводит к выработке гепсидина, гормона, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа) и подавляет всасывание железа желудочно-кишечном тракте (ЖКТ) и тем самым способствует развитию анемии [3,4]. Повышение уровня гепсидина, отмечающееся при воспалении, считают основной причиной анемии хронических заболеваний.
Стадия ЖДС | Механизм ЖДС | Ферритин | Сывороточное железо | ОЖСС | Морфология эритроцитов | Нb и эритроциты |
Прелатентная | Дефицит резервного железа в депо | Снижен | Норма | Норма | Норма | Норма |
Латентная | Дефицит транспортного и тканевого железа | Снижен | Снижено | Повышена | Гипохромия | Норма |
Анизоцитоз | ||||||
Микроцитоз | ||||||
Манифестная | ЖДА | Снижен | Снижено | Повышена | Гипохромия | Снижены |
Анизоцитоз | ||||||
Микроцитоз |
Также ранее показано, что для значительного большинства женщин, подлежащих хирургическому лечению, характерно состояние т. н. скрытой анемии ввиду олигоцитемической нормо- или гиповолемии, степень выраженности которой зависит от клинического течения заболевания и выраженности сопутствующей патологической менструальной кровопотери [4,5].
Так, например, данное осложнение встречается у 50–80% больных, направленных на плановую операцию по поводу миомы матки, что рассматривается как фактор риска развития осложнений в периоперационном периоде.
Постгеморрагическая анемия и гормональные нарушения, которые имеются у гинекологических больных, приводят к развитию тех или иных отклонений в иммунной системе, нарушений в системе гемостаза, проявляющегося в субклинической форме ДВС-синдрома, что и может способствовать развитию послеоперационных осложнений. В связи этим большое значение должно уделяться вопросам подготовки к оперативному лечению пациенток. Наиболее частой причиной анемии у больных гинекологического стационара является дефицит железа. Это одно из самых частых патологических состояний, встречающихся в клинической практике.
Независимо от причины железодефицитной анемии основной метод ее лечения - устранение абсолютного или функционального дефицита железа. С этой целью применяют препараты железа, которые можно назначать перорально или внутривенно.
Наиболее простой и эффективный метод коррекции железодефицита - длительное назначение пероральных препаратов железа, к преимуществам которого можно отнести удобство применения и доступность, включая низкую стоимость. Так как при энтеральном приеме препаратов железа запасы железа восстанавливаются медленно, а терапевтический эффект появляется постепенно. Таким образом, не следует ожидать быстрого прироста гемоглобина, его медленное повышение не свидетельствует об отсутствии эффекта. К недостаткам перорального приема можно отнести низкую всасываемость, частые побочные эффекты со стороны ЖКТ (диарея, тошнота, рвота, запор). Хуже всего переносятся препараты двухвалентного железа. Необходимость длительного приема неизбежно приводит к низкой приверженности к терапии. Кроме того, энтеральный прием подходит не для всех пациентов (например, с воспалительными заболеваниями кишечника, болезнью Крона) [6].
Некоторые препараты железа можно вводить внутримышечно, однако внутримышечные инъекции болезненные, вызывают изменение цвета кожи и ассоциировались с развитием саркомы ягодичной мышцы.
Использование для лечения железодефицитной анемии внутривенных препаратов железа имеет как свои преимущества, так и недостатки. К плюсам можно отнести: быстрый ответ на терапию, быстрое и эффективное пополнение запасов железа, хорошую переносимость со стороны ЖКТ, высокую приверженность к терапии. Недостатки во многом определяются формулой препарата. Главные опасения — это развитие возможных осложнений (реакции гиперчувствительности, оксидативный стресс). Непосредственные, опасные для жизни анафилактические реакции составляют самый серьезный риск.
В настоящее время к доступным внутривенным препаратам железа относятся:
- декстраны железа;
- глюконат железа;
- сахарат железа;
- карбоксимальтозат железа[7].
Целью разработки препарата железа нового поколения - карбоксимальтозата - являлось получение лекарства, обладающего метаболической активностью с заданными характеристиками, низкой реактогенностью в крови и клетках, низкой токсичностью и отсутствием способности к индукции окислительного стресса. Структура, сходная с ферритином, обеспечивает быстрое поступление в физиологические депо железа (ретикулоэндотелиальная система в печени). Доклинические данные по железа карбоксимальтозатупоказали, что препарат не вызывает перекрестной реакции антител к декстрану, не оказывает мутагенного и кластогенного действия и не повреждает хромосомы. Так же было продемонстрировано, что в дозах, превышающих уровни передозировки у человека в 1,2–12 раз, он не токсичен для матери и для плода в пре- и постнатальном периоде и никак не влияет на фертильность или эмбриональное развитие.
Карбоксимальтозат железа представляет собой высокомолекулярный комплекс железа с углеводом, по структуре сходным с ферритином. Медленное и физиологичное высвобождение железа из стабильного комплекса позволяет избежать токсических эффектов высоких его концентраций и развития оксидативного стресса. В опытах на крысах, которым вводили глюконат железа, наблюдали статистически значимое (p<0,01) усиление оксидативного стресса и увеличение концентрации провоспалительных маркеров в печени, сердце и почках по сравнению с животными, получавшими железа карбоксимальтозат или железа сахарат [8]. Кроме того, железа карбоксимальтозат не влиял на концентрацию в плазме молекул межклеточной адгезии (ICAM), молекул адгезии сосудистого эндотелия или провоспалительных маркеров у пациентов с хронической болезнью почек [9].
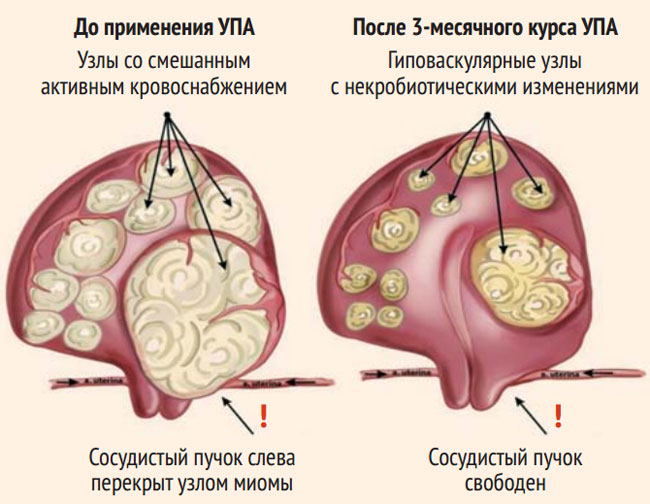
Рисунок. Узлы ЛМ до и после курсов УПА
Figure. UL nodes before and after UPA courses
Основное преимущество железа карбоксимальтозата перед другими препаратами железа заключается в том, что высокую дозу железа (максимальная рекомендуемая однократная доза составляет 1000 мг в Российской Федерации и ЕС [10] и 750 мг в США [11]) можно ввести за короткий промежуток времени (15 мин). Максимальные рекомендуемые однократные дозы большинства других препаратов железа для внутривенного введения ниже таковой железа карбоксимальтозата, поэтому для восполнения запасов железа необходимо многократное их введение, в то время как при применении железа карбоксимальтозата для этого обычно достаточно 1-2 инфузий. Например, максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Указанные особенности железа карбоксимальтозата не только делают терапию более удобной для пациента и медицинского персонала, но и позволяют сократить затраты на лечение [9].
Таким образом, одна-две инфузии железа карбоксимальтозатапозволяют в большинстве случаев восполнить дефицит железа и добиться быстрого увеличения уровня гемоглобина, что особенно важно при наличии тяжелой анемии или при подготовке больной к оперативному вмешательству. По данным мета-анализа 14 рандомизированных клинических исследований примерно у 4300 больных железодефицитной анемией различного происхождения [12], внутривенное введение карбоксимальтозата железа привело к более значительному увеличению средних уровней гемоглобина, ферритина и степени насыщения трансферрина по сравнению с пероральными препаратами железа и позволяло чаще достичь предусмотренного протоколом увеличения уровня гемоглобина и целевого уровня гемоглобина, а также сопровождалось достоверным снижением частоты желудочно-кишечных расстройств, в том числе запора, тошноты, рвоты и диареи.
Эффективность и безопасность железа карбоксимальтозата установлены в многочисленных рандомизированных и неконтролируемых клинических исследованиях, которые проводились у пациентов с железодефицитной анемией различного происхождения. Особого внимания заслуживают исследования данного препарата в условиях акушерско-гинекологической клиники. Так как именно пациентки гинекологического профиля зачастую сталкиваются с проблемой железодефицитного состояния а, как было отмечено выше, наличие железодефецитной анемии, ассоциированной с гинекологической патологией, является фактором риска развития осложнений у этой группы пациентов.
Зачастую коррекция уровня гемоглобина необходима пациенткам, нуждающимся в хирургическом лечении гинекологических заболеваний. Причиной ЖДА у данной группы пациенток чаще всего бывают обильные менструации и ациклические кровотечения, вызванные гинекологической патологией. В связи с этим отдельного внимания заслуживают исследования железа карбоксимальтозатав группах пациенток гинекологического профиля.
Так, в исследовании, проведенном с участием 90 женщин, в возрасте старше 30 лет, с подтвержденным диагнозом меноррагии и диагностированной анемией. В ходе исследования было показано, что инфузии железа карбоксимальтозата, в течение трех недель, на фоне медикаментозного контроля меноррагии, привели к значительному повышению уровня гемоглобина, вплоть до целевых значений, что позволило провести окончательное хирургическое лечение, без дополнительных рисков для пациенток. В ходе терапии анемического синдрома не было отмечено побочных реакций, нежелательных явлений и серьезных осложнений, что дает возможность говорить о безопасности данного препарата и возможности его использования в качестве альтернативы для переливания крови [13].
Исследование, проведенное в отделении акушерства и гинекологии одной из клиник Индии, с участием двухсот пациенток, показало, что инфузии карбоксимальтозата железа при анемии у пациенток, нуждающихся в хирургической коррекции гинекологической патологии, безопаснее и ассоциированы с меньшим риском возникновения нежелательных реакций на препарат, чем прием сахарата железа. Кроме того, запасы железа в группе пациенток, получавших карбоксимальтозат железа восстанавливались гораздо быстрее, чем в группе, получавшей сахарат железа, в качестве антианемической терапии. Данное исследование показало преимущества железа карбоксимальтозата перед другими группами препаратов.
Известно, что наибольшую группу больных гинекологического стационара представляют пациентки с миомой матки. Операции по поводу миомы матки составляют 80% плановых хирургических вмешательств [4]. Одним из решающих факторов положительного исхода оперативного лечения гинекологических больных является необходимость адекватной подготовки больных миомой матки и ЖДА.
Целью исследования, проведенного в центре «Анемия – стоп!» НЦ АГиП им. акад. В.И. Кулакова стала оценка эффективности и безопасности внутривенного применения карбоксимальтозата железа у больных с железодефицитной анемией и миомой матки перед оперативным лечением. Группу исследования составили 35 женщин с ЖДА и миомой матки, сопровождающейся мено- и менометроррагиями. Возраст пациенток колебался от 24 до 56 лет. Длительность заболевания колебалась от 4 до 12 лет. Критериями включения в группу явились: уровень гемоглобина ниже 95 г/л; сывороточный ферритин < 30 мкг/л; коэффициент насыщения трансферрина железом < 16%; сывороточное железо < 12,5 мкмоль/л. Критериями исключения из исследования служили заболевания крови. При обследовании использовались клинические и лабораторные методы. Стоит отметить, что все пациентки исследуемой группы неоднократно и длительно получали курсы терапии различными пероральными препаратами железа, фолиевой кислоты, витамин В12 с невыраженным или кратковременным эффектом. Анализ содержания ферритина у женщин с ЖДА показал, что на фоне проводимой терапии у всех обследованных наблюдается достоверный прирост уже через 14 дней от начала лечения, но наибольшего прироста уровень ферритина достигает через 3 нед. проводимой терапии. На фоне проводимой терапии все пациентки отмечали значительное улучшение общего состояния. При внутривенном введении препарата железа в данной группе женщин не отмечено побочных или аллергических реакций. При достижении уровня гемоглобина более 90 г/л пациентки были направлены на хирургическое лечение [4].
Таким образом, применение карбоксимальтозата железа в виде внутривенных инфузий в комплексной терапии ЖДА у больных миомой матки и мено- и менометроррагиями следует рассматривать как один из методов кровесбережения, который способствует достаточно быстрому повышению гематологических показателей: гемоглобина, гематокрита, эритроцитов – и феррокинетических показателей крови: сывороточного железа и ферритина без переливания донорских эритроцит-содержащих компонентов.
Заключение
У большинства женщин с железодефицитной анемией легкой степени лечение следует начинать с перорального приема препаратов железа, тем не менее, в клинической практике нередко возникает необходимость во внутривенном их введении. Кроме того, пероральные препараты железа оказывают медленное действие, неэффективны при синдроме нарушенного всасывания и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта, которые снижают приверженность к лечению. Внутривенное введение препаратов железа обосновано в тех случаях, когда необходимо быстро добиться эффекта (например, при более тяжелой анемии, особенно у пациентов с сердечно-сосудистыми заболеваниями), плохой переносимости препаратов для приема внутрь или их неэффективности (синдром мальабсорбции, хроническая потеря железа, превышающая скорость его восполнения, и др.).
Карбоксимальтозат железа – это внутривенный препарат железа, представляющий собой высокомолекулярный и стабильный железоуглеводный комплекс. Основное преимущество железа карбоксимальтозата перед другими внутривенными препаратами железа – возможность введения большой дозы железа за короткий срок, что позволяет быстро восполнить абсолютный или функциональный дефицит железа и сократить необходимое число инфузий. В отличие от железа декстрана, железа карбоксимальтозат очень редко вызывает реакции гиперчувствительности.
Эффективность и безопасность карбоксимальтозата железа в акушерской и гинекологической практике, в том числе у беременных женщин, установлены в рандомизированных клинических исследованиях и подтверждаются результатами неконтролируемых исследованиях [9, 14].
Литература / References
- Тихомиров А.Л. Современное медикаментозное лечение миомы матки - возможность избежать гистерэктомии и ее негативных последствий. Медицинский алфавит. 2017;2(10):17-22. Режим доступа: https://elibrary.ru/item.asp?id=29426469.
- Коноводова Е.Н., Докуева Р.С.-Э., Якунина Н.А. Железодефицитные состояния в акушерскогинекологической практике. РМЖ. 2011;19(20):1228-1231. Режим доступа: https://www.rmj.ru/articles/ginekologiya/Ghelezodeficitnye_sostoyaniya_v_akusherskoginekologicheskoy_praktike.
- Тихомиров А.Л., Сарсания С.И., Ночевкин Е.В. Железодефицитные состояния в акушерстве и гинекологии. Грани проблемы. Современное лечение. РМЖ. Мать и дитя. 2011;19(1):22-23. Режим доступа: https://www.rmj.ru/articles/akusherstvo/Ghelezodeficitnye_sostoyaniya_v_akusherstve_i_ginekologiiGrani_problemy_Sovremennoe_lechenie.
- Татарчук Т.Ф., Косей Н.В., Редько Н.А. Антианемическая терапия - важное звено в лечении лейомиомы матки. Аналитический обзор. Репродуктивная эндокринология. 2013;(14):7-16. Режим доступа: http://reproduct-endo.com/article/view/29875/26678.
- Громова О.А., Торшин И.Ю., Хаджидис А.К. Клинические и молекулярные аспекты эффективного и безопасного лечения анемии. Методическое пособие. М., 2010; 49 c. Режим доступа: https://medi.ru/docplus/g300115.pdf.
- Громова О.А., Рахтеенко А.В., Громова М.А. Железодефицитная анемия. Гематология. 2016:213-229. Режим доступа: https://istina.msu.ru/publications/article/92555717.
- Donnez J., Hudecek R., Donnez O., Matule D., Arhendt H.J., Zatik J., Kasilovskiene Z., Dumitrascu M.C., Fernandez H., Barlow D.H., Bouchard P., Fauser B.C., Bestel E., Terrill P., Osterloh I., Loumaye E. Efficacy and safety of repeated use of ulipristal acetate in uterine fibroids. Fertil Steril. 2015;103(2):519-27.e3. https://doi.org/10.1016/j.fertnstert.2014.10.038.
- Уварова Е.В. Матричный комплекс железа сульфата в комбинированной гемостатической и восстановительной терапии при аномальных маточных кровотечениях у подростков. Эффективная фармакотерапия. Акушерство и гинекология. 2013;(28):22-31. Режим доступа: http://umedp.ru/upload/iblock/4ef/4ef3d63381ff037cf7790f65b0181f4a.pdf.
- Тихомиров А.Л., Казенашева В.В., Зайратьянц О.В., Манухин И.Б. Первые клинико-морфологические результаты лечения больных миомой матки с использованием улипристала ацетата. Гинекология. 2014;16(2):29-33. Режим доступа: https://elibrary.ru/item.asp?id=21691532.
- Тихомиров А.Л., Казенашев В.В., Манухин И.Б. Курсовое лечение миомы матки улипристала ацетатом. Проблемы репродукции. 2014;(5):6365. Режим доступа: https://www.mediasphera.ru/issues/problemy-reproduktsii/2014/5/031025-72172014513.
- Адамян Л.В., Зайратьянц О.В., Тихомиров А.Л., Манухин И.Б., Опаленов К.В., Казенашев В.В., Алиева Т.Д. Антипролиферативное и проапоптическое действие селективного модулятора рецепторов прогестерона улипристала на лейомиому матки in vivo. Проблемы репродукции. 2014;(3):41-44. Режим доступа: https://www.mediasphera.ru/issues/problemy-reproduktsii/2014/3/031025-72172014310.
- Тихомиров А.Л., Кочарян А.А. Возможности снижения объема интраоперационной кровопотери при органосохраняющем хирургическом лечении миомы матки. РМЖ. 2007;15(3):157-159. Режим доступа: https://www.rmj.ru/articles/ginekologiya/Vozmoghnosti_snigheniya_obyema_intraoperacionnoy_krovopoteri_pri_organosohranyayuschem_hirurgicheskom_lechenii_miomy_matki.
- Коноводова Е.Н., Докуева Р.С.-Э., Якунина Н.А. Железодефицитные состояния в акушерскогинекологической практике. РМЖ. 2011;(20):1228-1231. Режим доступа: https://www.rmj.ru/articles/ginekologiya/Ghelezodeficitnye_sostoyaniya_v_akusherskoginekologicheskoy_praktike.
- Серов В.Н., Дубровина Н.В., Балушкина А.А. Железодефицитная анемия в гинекологической практике: основные принципы лечения. РМЖ. 2011;19(1):1-5. Режим доступа: https://www.rmj.ru/articles/akusherstvo/Ghelezodeficitnaya_anemiya_v_ginekologicheskoy_praktike_osnovnye_principy_lecheniya.
- Лебедев В.А., Пашков В.М. Принципы терапии железодефицитной анемии у гинекологических больных. Трудный пациент. 2013;(11):3338. Режим доступа: http://t-pacient.ru/articles/8075.
- Новикова С.В., Логутова Л.С., Бочарова И.И. Оптимизация ведения беременных с высоким инфекционным риском. РМЖ. 2015;(1):6-9. Режим доступа: https://www.rmj.ru/articles/ginekologiya/Optimizaciya_vedeniya_beremennyh_s_vysokim_infekcionnym_ris.