Содержание
- Анатомия и патофизиология дакриоцистита
- Обструкция слёзно-носового протока
- Лечение дакриоцистита и непроходимости носослёзных путей
- Хирургические вмешательства при дакриоцистите и непроходимости носослёзного канала
- Дакриоцистоцеле
- Список литературы
Дакриоцистит – устаревший термин. В настоящее время применяются «непроходимость носослёзного протока», «непроходимость слёзных путей» или «непроходимость слёзоотводящих путей».
Врожденная непроходимость носослёзного протока (дакриостеноз) встречается примерно у 6% новорожденных и является наиболее частой причиной постоянного слёзотечения и выделений из глаз у младенцев и детей младшего возраста. Большинство случаев разрешаются спонтанно. Врожденное дакриоцистоцеле (или киста носослёзного протока) встречается реже, но сопряжено с потенциально серьезными осложнениями и требует своевременного обращения к офтальмологу.
Анатомия и патофизиология дакриоцистита
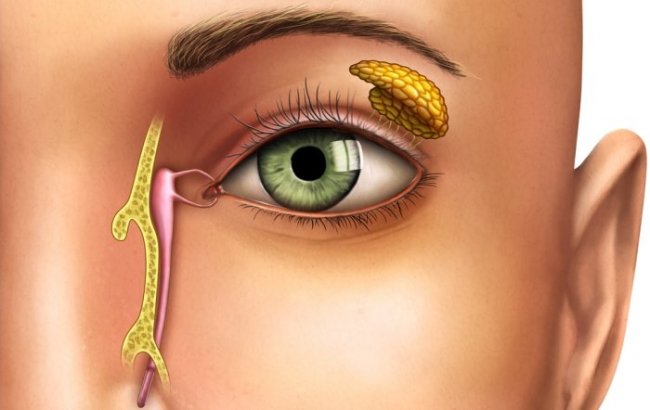
Нормальная слёзопродукция и отток – слёзы вырабатываются основной и добавочной слёзными железами. Они впадают медиально в точки верхних и нижних век, впадают через канальцы в слёзный мешок и через носослёзный проток в нос. Проток имеет проксимальный клапан (клапан Розенмюллера) и дистальный клапан (клапан Хаснера), которые являются обычными местами обструкции.
При эмбриональном развитии носослёзный аппарат появляется на 3-5-й неделе и постепенно образует тяж эпителия, идущий от век к носу. Канализация пуповины начинается в точке века на третьем месяце внутриутробной жизни и распространяется дистально к носу. Канализация обычно завершается к рождению.
Распространенные места непроходимости – непроходимость в разных местах носослёзной системы вызывает разные проявления:
Врожденная обструкция. Наиболее частой причиной врожденной обструкции является неполная канализация на дистальном конце (т. е. ближе всего к носу), оставляющая неперфорированную мембрану на клапане Хаснера; однако обструкция может возникать и в других местах.
Врожденное дакриоцистоцеле (также известное как дакриоцеле, амниотоцеле или киста носослёзного протока) возникает, когда проксимальная и дистальная части слёзно-носовой системы обтурированы. Как и при простой врожденной обструкции, дистальная обструкция обычно находится на уровне мембраны Хаснера. Проксимальная обструкция обычно возникает в общем канальце или в клапане Розенмюллера. Проксимальная обструкция представляет собой односторонний клапан, который позволяет слёзам проникать, но не рефлюксировать из канальцев слёзоотводящей системы. Это приводит к растяжению слёзного мешка и протока, что выглядит как синеватая выпуклость ниже медиального угла глазной щели.
Обструкция слёзно-носового протока
Эпидемиология. Врожденная непроходимость носослёзного протока встречается примерно у 6% новорожденных, обычно как изолированная находка, и является наиболее частой причиной постоянного слёзотечения и выделений из глаз у младенцев и детей младшего возраста. В одном исследовании у 20% здоровых младенцев в какой-то момент в течение первого года жизни были обнаружены признаки дефекта слёзооттока.
Естественное течение. Приблизительно у 80–90% детей с врожденной обструкцией носослёзного канала самопроизвольно разрешается к возрасту от 6 до 10 месяцев.
Среди детей с персистирующими симптомами в возрасте от 9 до 10 месяцев примерно у половины наступает разрешение в течение следующих шести месяцев. Обструкции, сохраняющиеся после 12 месяцев, вряд ли разрешатся спонтанно.
В крупном ретроспективном исследовании почти 2000 младенцев с врожденной обструкцией примерно у 85% было спонтанное разрешение, а 15% прошли курс лечения. Скорость спонтанного разрешения уменьшалась с возрастом и стабилизировалась после девятимесячного возраста:
- 47 % дел разрешаются к трехмесячному возрасту.
- 66 % разрешились к шестимесячному возрасту.
- 76 % разрешились к девятимесячному возрасту.
- 78 % излечились к 12-месячному возрасту.
Спонтанное разрешение возникало раньше у пациентов с односторонней обструкцией по сравнению с двусторонней и у младенцев мужского пола по сравнению с девочками.
Клинические признаки. Младенцы с врожденной обструкцией имеют в анамнезе хроническое или прерывистое слёзоотделение и инородные частицы на ресницах («имеющие значение»).
Родители могут отмечать обильное слёзотечение, когда ребенок находится в среде, стимулирующей повышенное слёзоотделение (например, ветер или холод), или когда отток слёз уменьшается из-за отека слизистой оболочки носа во время инфекции верхних дыхательных путей. Такая «стрессовая эпифора» может возникать достаточно часто, чтобы стать надоедливой.
При физикальном осмотре обычно отмечается увеличение размера слёзного мениска, а на ресницах могут быть остатки. Пальпация слёзного мешка может вызвать рефлюкс слёз и/или слизистые выделения в глаз через точки. Конъюнктивальная эритема нетипична, хотя раздражение из-за слёзоточивости и хронического натирания глаз может вызвать легкое покраснение нижнего века.
Оценка и диагностика. Диагноз обычно ставится только на основании анамнеза и физического осмотра. Если симптомы носят непостоянный характер и на момент осмотра отсутствуют признаки аномального слёзоотделения или образования материи, для подтверждения диагноза можно провести тест на исчезновение красителя (описанный ниже).
Оценить симптомы – при обследовании младенца с аномальным слёзотечением клиницист должен оценить наличие других симптомов или признаков, которые могут вызвать подозрение в более серьезном заболевании глаз.
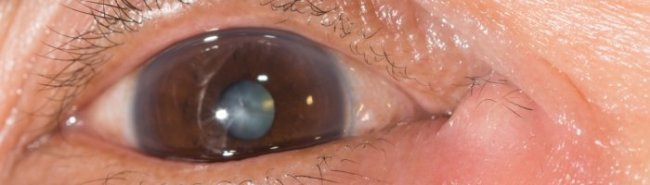
Гнойные выделения, эритема или припухлость, которые могут свидетельствовать об инфекции (например, офтальмия новорожденных или острый дакриоцистит.
Синеватый отек кожи над слёзным мешком, что свидетельствует о дакриоцистоцеле.
Светобоязнь, помутнение роговицы и/или большие или асимметричные диаметры роговицы, указывающие на глаукому.
Тест на исчезновение красителя. Если диагноз неясен, можно провести тест на исчезновение красителя, чтобы подтвердить диагноз. Тест выполняется следующим образом:
- Закапайте в глаз каплю местного анестетика (или используйте флуоресцентную каплю, содержащую местный анестетик).
- Поместите каплю окрашенного флюоресцеином физиологического раствора в нижний слепой мешок каждого глаза пациента.
- Вытрите лишние слёзы с век.
- Наблюдайте за пациентом в течение пяти минут. Глаза тереть нельзя; слёзы, которые стекают по щекам, не следует вытирать.
- Через пять минут осмотрите глаза.
Весь флуоресцеин должен стекать в нос в течение пяти минут, если слёзоотводящая система не закупорена. Тест считается нормальным, если большая часть красителя исчезает в течение пяти минут, и отклонением от нормы, если большое количество красителя сохраняется или стекает по нижнему веку и вниз по щеке.
Дифференциальный диагноз. Причины аномального слёзоотделения у младенцев и детей приведены в таблице и более подробно обсуждаются отдельно.
Отсутствие следующих признаков и симптомов отличает врожденную непроходимость носослёзного канала от других причин стойкого слёзотечения:
- Покраснение и/или дискомфорт в глазах. Покраснение и дискомфорт в глазах являются характерными признаками конъюнктивита (вызванного инфекционным, аллергическим или раздражающим действием), увеита, ссадины роговицы или инородного тела. У пациентов с обструкцией носослёзного канала покраснение глаз незначительное или отсутствует.
- Фотофобия обычно возникает при эрозиях роговицы, увеите и детской глаукоме.
- Признаки инфекции. У новорожденных гнойные выделения из глаз вызывают подозрение на офтальмию новорожденных, которая обычно вызывается инфекцией Neisseria gonorrhoeae или Chlamydia trachomatis (или обоими микроорганизмами одновременно). В то время как у младенцев с обструкцией носослёзных путей иногда могут быть гнойные выделения из глаз из-за избыточного бактериального роста в застойном слёзном бассейне, наличие обильных гнойных выделений у новорожденного в течение первых двух-трех недель после рождения должно побудить к обследованию на офтальмию новорожденных, особенно если есть другие признаки. инфекции (например, покраснение и отек век).
Большинству младенцев с врожденной непроходимостью носослёзных путей может быть поставлен диагноз и назначено лечение врачом первичной медико-санитарной помощи. Направление к офтальмологу оправдано при наличии любого из следующего:
- Неясный диагноз, особенно если есть подозрение на инфантильную глаукому (на подозрение указывает аномальное слёзотечение, связанное со светобоязнью, блефароспазмом, помутнением роговицы и/или большим или асимметричным диаметром роговицы).
- Симптомы обструкции носослёзных путей, сохраняющиеся после шести-семи месяцев.
- Признаки и симптомы острого дакриоцистита (эритема, отек, повышение температуры, болезненность слёзного мешка и/или гнойные выделения).
- Признаки анизометропии или амблиопии, выявляемые при одновременном тесте красного рефлекса Брукнера. В одном исследовании у 10% детей с односторонней врожденной обструкцией НЛД была обнаружена анизометропия (с амблиопией или без нее).
- Клинические данные, указывающие на дакриоцистоцеле (синюшный отек кожи над слёзным мешком и смещение медиального сухожилия глаза кверху).
Лечение дакриоцистита и непроходимости носослёзных путей
Массаж слёзного мешка. Наружный пальцевый массаж слёзного мешка является терапией первой линии при непроходимости носослёзных путей. Считается, что массаж устраняет обструкцию за счет увеличения гидростатического давления, достаточного для принудительного открытия закупоренной дистальной мембраны. Термин «массаж» может неадекватно передавать величину требуемого давления, и некоторые практикующие врачи используют термин «сдавление слёзного мешка», чтобы более эффективно объяснить, из чего состоит маневр.
Массаж слёзного мешка выполняется путем оказания умеренного давления на слёзный мешок в направлении вниз в течение двух-трех секунд. Лица, осуществляющие уход, проинструктированы выполнять этот маневр два-три раза в день, пока симптомы не исчезнут. Полезно продемонстрировать технику массажа слёзного мешка как на ребенке, так и на опекунах (чтобы опекуны понимали, какое давление нужно применять). Лица, осуществляющие уход, должны быть проинструктированы о необходимости подстригать ногти и мыть руки до и после массажа слёзного мешка.
Лечение избыточного бактериального роста. Слизисто-гнойные выделения из глаз обычно возникают у детей грудного возраста с обструкцией НЛД и при отсутствии других признаков инфекции предполагают избыточный бактериальный рост в застойном слёзном бассейне слёзного мешка (т. е. хронический дакриоцистит). Чаще всего выделяют Streptococcus pneumoniae, Haemophilus influenzae, Pseudomonas aeruginosa и Streptococcus viridans.
Слизисто-гнойные выделения без других признаков инфекции свидетельствуют о избыточном бактериальном росте, который лечится местными антибиотиками. Обычно используются местные антибиотики только тогда, когда выделения обильные и присутствуют в течение дня. Кроме того, если планируется операция на слёзных путях и у младенцев имеется слизисто-гнойное отделяемое, перед процедурой следует провести местную антибактериальную терапию.
Обычно используемые агенты включают тобрамицина сульфат 0,3% или моксифлоксацин 0,5%, по одной капле до четырех раз в день. Другие подходящие средства включают местный гентамицин, эритромицин, сульфацетамид и другие фторхинолоны (например, ципрофлоксацин, офлоксацин или норфлоксацин). Во избежание химического раздражения продолжительность лечения должна быть короткой (от трех до пяти дней).
Гнойные выделения из глаз в сочетании с другими признаками инфекции, такими как эритема и/или отек, свидетельствуют об остром дакриоцистите, который требует системной антибактериальной терапии. Это редкое осложнение изолированной врожденной обструкции НЛД. Чаще встречается при дакриоцистоцеле. Управление обсуждается ниже.
Стойкая непроходимость носослёзного протока в возрасте старше 6–7 мес. Младенцы с симптомами обструкции носослёзного протока, которые не исчезли к возрасту от шести до семи месяцев, должны быть направлены к офтальмологу для дальнейшего обследования и лечения. Оценка должна включать всестороннее обследование глаз, в том числе циклоплегическую рефракцию для поиска анизометропии, которая может встречаться примерно у 10% пациентов с врожденной обструкцией.
Зондирование слёзоотводящих путей является хирургической операцией первой линии у детей раннего возраста с симптомами врожденной обструкции НЛД, которые сохраняются после шестимесячного возраста. Процедура выполняется офтальмологом в кабинете или в операционной, в зависимости от возраста и размера ребенка (детям в возрасте ≥12 месяцев или весом ≥9 кг обычно требуется общая анестезия), а также опыта и предпочтений офтальмолога. В амбулаторных условиях процедура зондирования обычно занимает всего две-три минуты, если анатомия ребенка нормальная.
Оптимальные сроки вмешательства у младенцев с врожденной непроходимостью являются предметом споров. Многие офтальмологи проводят раннее зондирование в кабинете, если симптомы не исчезли к возрасту от 6 до 10 месяцев. Однако разумной альтернативой является ожидание, пока ребенку не исполнится 12 месяцев, поскольку у многих пациентов к этому возрасту наступает спонтанное выздоровление. Обструкции носослёзных путей, сохраняющиеся после 12 месяцев, вряд ли разрешатся спонтанно. Предпочтения родителей играют важную роль в принятии решения о проведении раннего зондирования или отсрочке хирургического вмешательства.
Преимущества раннего зондирования (то есть в возрасте от 6 до 10 месяцев) по сравнению с откладыванием процедуры до достижения ребенком возраста ≥12 месяцев заключаются в следующем:
- Процедуру обычно можно проводить в кабинете без общей анестезии.
- Приводит к более раннему исчезновению симптомов. Таким образом, раннее зондирование может быть особенно полезным для младенцев с очень неприятными симптомами.
- Риск рубцевания слёзных протоков может быть ниже.
- Риск заражения может быть ниже (хотя он достаточно низок даже без вмешательства).
Преимущества отсрочки хирургического вмешательства (т.е. ожидания до достижения ребенком возраста ≥12 месяцев) заключаются в следующем:
- Дает больше времени для спонтанного разрешения и, таким образом, позволяет избежать необходимости вмешательства у некоторых младенцев.
- Позволяет офтальмологу выполнить более точную процедуру. Это связано с тем, что большинству детей в этом возрасте требуется общая анестезия для операции на слёзном канале. Необходимость общей анестезии позволяет офтальмологу выполнять более сложную хирургическую процедуру (например, баллонную дакриопластику и/или интубацию носослёзных путей, а не просто процедуру зондирования. Как баллонная дакриопластика, так и интубация носослёзных путей, как правило, имеют более высокий уровень успеха, чем простое зондирование, но они не могут быть выполнены в амбулаторных условиях без общей анестезии.
- Эффективность зондирования для лечения врожденной обструкции подтверждается двумя небольшими рандомизированными исследованиями, сериями случаев и клиническим опытом. Зондирование успешно устраняет обструкцию носослёзных путей примерно в 75–90% случаев.
Исследования противоречивы в отношении взаимосвязи между возрастом, в котором проводится зондирование, и вероятностью успеха. В крупном многоцентровом проспективном исследовании не наблюдалось связи между возрастом и частотой успеха у детей младше 3 лет. Вероятность успеха была немного ниже, когда процедура проводилась в условиях офиса, а не в хирургическом учреждении (72% против 80%). В другом крупном ретроспективном исследовании успех был более вероятен у пациентов, у которых первоначальное зондирование проводилось в возрасте <15 месяцев, чем у пациентов более старшего возраста.
Результаты раннего и отсроченного зондирования оценивались в многоцентровом рандомизированном контролируемом исследовании 163 детей с врожденной обструкцией НЛД с неустраненными симптомами в возрасте от 6 до 10 месяцев. Пациенты были случайным образом распределены для немедленного зондирования в офисе (n = 82) или шести месяцев консервативного лечения (n = 81) с последующей операцией (под общей анестезией) для тех, у кого сохранялись симптомы. Среди пациентов в группе отсроченной операции у 66 % симптомы разрешились без хирургического вмешательства, а 27 % подверглись хирургическому вмешательству (четверым из них была проведена ранняя операция из-за ухудшения симптомов, запроса родителей или развития целлюлита в течение периода наблюдения). Среди пациентов в группе раннего зондирования 9% нуждались в повторной операции под общей анестезией из-за стойкой обструкции НЛД после первоначальной процедуры. В возрасте 18 месяцев больше пациентов в группе раннего зондирования имели полное исчезновение симптомов по сравнению с группой отсроченного вмешательства (92 % против 82 %; абсолютная разница 10 %, 95% ДИ от -1 до 21%). В группе раннего зондирования симптомы наблюдались на три месяца меньше (95% ДИ 1,8–4 месяца меньше).
Исследования экономической эффективности пришли к разным выводам об относительной стоимости двух подходов, при этом некоторые оценивали более низкие затраты для пациентов, получавших раннее зондирование в клинике, в то время как другие оценки давали сопоставимые затраты для обоих подходов.
Неэффективность лечения. Первоначальное зондирование носослёзных путей безуспешно в 10–25% случаев. Варианты дальнейшего ведения этих младенцев включают:
Повтор процедуры зондирования. Если первая процедура зондирования была несложной, а возраст младенца <12 месяцев или <9 кг, можно попытаться повторить зондирование в клинике. Сообщаемые показатели успеха повторного зондирования колеблются от 50 до 60 %.
Альтернативные процедуры. Процедуры, которые используются в качестве лечения второй линии после неудачного зондирования, включают интубацию носослёзных путей и баллонную дилатацию. Эти процедуры также могут быть использованы для первичного лечения пациентов, у которых первая процедура проводится под общей анестезией, а также для пациентов с высокой вероятностью неэффективности лечения при зондировании (тех, у кого есть тесные обструкции или анатомические аномалии, такие как краниосиностоз или другие черепно-лицевые аномалии). Обе процедуры требуют общей анестезии.
Дакриоцисториностомия и конъюнктиводакриоцисториностомия являются более сложными процедурами, которые предназначены для пациентов с аномалиями анатомии, такими как костная обструкция или точечная/каналикулярная аплазия, и/или для пациентов с симптомами, не поддающимися более стандартным методам лечения.
Хирургические вмешательства при дакриоцистите и непроходимости носослёзного канала
Зондирование слёзных протоков является хирургической операцией первой линии у детей раннего возраста с симптомами врожденной их обструкции. Процедуру можно проводить в кабинете или в операционной. Детям ≥12 месяцев обычно требуется общая анестезия.
Процедура выполняется путем введения небольшого тупого зонда или ирригационной канюли в точку и продвижения ее через слёзоотводящую систему до упора в закупорку. Затем зонд аккуратно проталкивают через препятствие в нос. Для обеспечения проходимости можно провести ирригацию окрашенным флуоресцеином физиологическим раствором. Зондирование успешно устраняет обструкцию примерно в 75–90% случаев.
Интубация носослёзного протока включает в себя зондирование и размещение внутри него силиконового стента. Стенты обычно удаляются в клинике через два-шесть месяцев. Интубация обычно используется для пациентов, у которых начальное зондирование не дало результатов. Он также используется для первичного лечения младенцев и детей, у которых первая процедура проводится под общей анестезией. Зарегистрированные показатели успеха этой процедуры составляют от 90 до 96 % при использовании в качестве основного лечения и 84 %а при выполнении после неудачного зондирования. Неизвестно, приводит ли раннее удаление стента к более низким показателям успеха.
Баллонная дакриоцистопластика. Баллонная дилатация может использоваться для повышения вероятности успешного лечения. Зарегистрированные показатели успеха этой процедуры составляют 82% при использовании для первичного лечения и 77% при выполнении после неудачного зондирования.
Дакриоцисториностомия предназначена для пациентов с костной обструкцией и/или пациентов с симптомами, не поддающимися более стандартным методам лечения. Процедура заключается в создании окна между слёзным мешком и полостью носа. Эта процедура сохраняет активный дренажный механизм.
Конъюнктиводакриоцисториностомия предназначена для пациентов со значительными анатомическими аномалиями проксимальнее слёзного мешка (например, точечной или канальцевой аплазией), которые не могут быть устранены с помощью процедур, описанных выше. При этой процедуре между карункулом и полостью носа помещается стеклянная трубка из пирекса. Эта процедура основана исключительно на гравитации для дренажа.
Дакриоцистоцеле
Клинические признаки. Дакриоцистоцеле обычно отмечают при рождении или вскоре после него. Синюшный отек кожи над слёзным мешком и смещение медиального сухожилия глаза кверху являются типичными находками. Диагноз ставится клинически, и дальнейшее обследование, как правило, не требуется, хотя нейровизуализация может подтвердить диагноз.
Осложнения. Детей с дакриоцистоцеле следует срочно направить к офтальмологу. Им может потребоваться раннее вмешательство из-за двух потенциальных осложнений: инфекции и затрудненного дыхания из-за заложенности носа.
Инфекция. Если не лечить, дакриоцистоцеле может воспалиться. Острый дакриоцистит требует немедленного лечения системными антибиотиками, чтобы предотвратить развитие вторичного пресептального или орбитального целлюлита, сепсиса, менингита или абсцесса головного мозга.
Риск острого дакриоцистита значительно выше у детей с дакриоцистоцеле по сравнению с детьми с простой обструкцией носослёзного протока из-за большей степени стаза слёзного пула. Клинические признаки включают эритему, отек, болезненность, гнойные выделения и лихорадку. Слабые ранние симптомы инфекции включают легкую эритему над слёзным мешком, плохой аппетит или измененное поведение.
Затрудненное дыхание. Растяжение слизистой оболочки носослёзного протока из-за захвата слёз может привести к образованию слизистых оболочек, которые распространяются в нос и вызывают обструкцию. Поскольку младенцы являются обязательными носовыми дыханиями, заложенность носа из-за мукоцеле может вызвать респираторный дистресс.
Лечение. Дети с дакриоцистоцеле должны быть немедленно осмотрены офтальмологом.
Декомпрессия дакриоцистоцеле в своды обычно может быть достигнута с помощью пальцевого массажа и/или зондирования общего канальца в амбулаторных условиях. Некоторые офтальмологи могут наблюдать в течение короткого периода времени, чтобы найти спонтанное разрешение. Зондирование носослёзного протока, если требуется, выполняется так же, как у детей более старшего возраста с обструкцией.
Кроме того, при наличии интраназального мукоцеле (диагностируемого при осмотре полости носа с помощью налобного фонаря и назального зеркала) его необходимо вскрыть, чтобы предотвратить рецидив обструкции. Интраназальный компонент можно открыть в кабинете, но более сложные случаи лучше лечить в операционной под общей анестезией, иногда с помощью назального эндоскопа. Необходима марсупиализация.
Лечение острого дакриоцистита. Острый дакриоцистит требует немедленного лечения системными антибиотиками для предотвращения развития вторичных осложнений (например, пресептального или орбитального целлюлита, сепсиса, менингита или абсцесса головного мозга).
Младенцы и дети с острым дакриоциститом должны лечиться в консультации с офтальмологом. Если необходимо выполнить зондирование носослёзного протока, перед операцией следует ввести системные антибиотики. Культуры крови и культуры материала, полученные во время дренирования, должны быть отправлены на посев для определения окончательной антимикробной терапии. Наиболее распространенные возбудители включают альфа-гемолитические стрептококки, эпидермальный стафилококк и золотистый стафилококк.
Эмпирическая системная антибактериальная терапия должна быть назначена пациентам с подозрением на острый дакриоцистит до получения результатов посева. Выбор антибиотика зависит от тяжести инфекции. При тяжелых инфекциях эмпирическая терапия обычно состоит из внутривенного введения ванкомицина плюс цефалоспорин расширенного спектра для обеспечения широкого охвата. Легкие инфекции можно лечить пероральным клиндамицином.
Эмпирическая антимикробная терапия должна быть изменена по мере необходимости, когда доступны результаты посева. Продолжительность антимикробной терапии варьирует в зависимости от клинического ответа, но обычно составляет от 7 до 10 дней.
Список литературы / References
- Baskin DE, Reddy AK, Chu YI, Coats DK. The timing of antibiotic administration in the management of infant dacryocystitis // J AAPOS 2008; 12:456.
- Campolattaro BN, Lueder GT, Tychsen L. Spectrum of pediatric dacryocystitis: medical and surgical management of 54 cases // J Pediatr Ophthalmol Strabismus 1997; 34:143.
- Duval M, Alsabah BH, Carpineta L, Daniel SJ. Respiratory distress secondary to bilateral nasolacrimal duct mucoceles in a newborn // Otolaryngol Head Neck Surg 2007; 137:353.
- Edmond JC, Keech RV. Congenital nasolacrimal sac mucocele associated with respiratory distress // J Pediatr Ophthalmol Strabismus 1991; 28:287.
- el-Mansoury J, Calhoun JH, Nelson LB, Harley RD. Results of late probing for congenital nasolacrimal duct obstruction // Ophthalmology 1986; 93:1052.
- Engel JM, Hichie-Schmidt C, Khammar A, et al. Monocanalicular silastic intubation for the initial correction of congenital nasolacrimal duct obstruction // J AAPOS 2007; 11:183.
- Frick KD, Hariharan L, Repka MX, et al. Cost-effectiveness of 2 approaches to managing nasolacrimal duct obstruction in infants: the importance of the spontaneous resolution rate // Arch Ophthalmol 2011; 129:603.
- Katowitz JA, Welsh MG. Timing of initial probing and irrigation in congenital nasolacrimal duct obstruction // Ophthalmology 1987; 94:698.
- Kuchar A, Lukas J, Steinkogler FJ. Bacteriology and antibiotic therapy in congenital nasolacrimal duct obstruction // Acta Ophthalmol Scand 2000; 78:694.
- Kushner BJ. Congenital nasolacrimal system obstruction // Arch Ophthalmol 1982; 100:597.
- Leonard DS, O'Keefe M, Rowley H, Hughes JP. Neonatal respiratory distress secondary to bilateral intranasal dacryocystocoeles // Int J Pediatr Otorhinolaryngol 2008; 72:1873.
- MacEwen CJ, Young JD. Epiphora during the first year of life // Eye (Lond) 1991; 5 ( Pt 5):596.
- Maini R, MacEwen CJ, Young JD. The natural history of epiphora in childhood // Eye (Lond) 1998; 12 ( Pt 4):669.
- Miller AM, Chandler DL, Repka MX, et al. Office probing for treatment of nasolacrimal duct obstruction in infants // J AAPOS 2014; 18:26.
- Morrison DG, Binenbaum G, Chang MY, et al. Office- or Facility-Based Probing for Congenital Nasolacrimal Duct Obstruction: A Report by the American Academy of Ophthalmology // Ophthalmology 2021; 128:920.
- Olitsky SE. Update on congenital nasolacrimal duct obstruction // Int Ophthalmol Clin 2014; 54:1.
- Örge FH, Boente CS. The lacrimal system // Pediatr Clin North Am 2014; 61:529.
- Paysse EA, Coats DK, Bernstein JM, et al. Management and complications of congenital dacryocele with concurrent intranasal mucocele // J AAPOS 2000; 4:46.
- Pediatric Eye Disease Investigator Group, Repka MX, Chandler DL, et al. Primary treatment of nasolacrimal duct obstruction with probing in children younger than 4 years // Ophthalmology 2008; 115:577.
- Pediatric Eye Disease Investigator Group, Repka MX, Chandler DL, et al. Repeat probing for treatment of persistent nasolacrimal duct obstruction // J AAPOS 2009; 13:306.
- Pediatric Eye Disease Investigator Group, Repka MX, Melia BM, et al. Primary treatment of nasolacrimal duct obstruction with nasolacrimal duct intubation in children younger than 4 years of age // J AAPOS 2008; 12:445.
- Pediatric Eye Disease Investigator Group, Repka MX, Melia BM, et al. Primary treatment of nasolacrimal duct obstruction with balloon catheter dilation in children younger than 4 years of age // J AAPOS 2008; 12:451.
- Pediatric Eye Disease Investigator Group. A randomized trial comparing the cost-effectiveness of 2 approaches for treating unilateral nasolacrimal duct obstruction // Arch Ophthalmol 2012; 130:1525.
- Pediatric Eye Disease Investigator Group. Resolution of congenital nasolacrimal duct obstruction with nonsurgical management // Arch Ophthalmol 2012; 130:730.
- Petersen RA, Robb RM. The natural course of congenital obstruction of the nasolacrimal duct // J Pediatr Ophthalmol Strabismus 1978; 15:246.
- Piotrowski JT, Diehl NN, Mohney BG. Neonatal dacryostenosis as a risk factor for anisometropia // Arch Ophthalmol 2010; 128:1166.
- Qian Y, Traboulsi EI. Lacrimal sac compression, not massage // J Pediatr Ophthalmol Strabismus 2009; 46:252.
- Repka MX, Chandler DL, Holmes JM, et al. Balloon catheter dilation and nasolacrimal duct intubation for treatment of nasolacrimal duct obstruction after failed probing // Arch Ophthalmol 2009; 127:633.
- Robb RM. Probing and irrigation for congenital nasolacrimal duct obstruction // Arch Ophthalmol 1986; 104:378.
- Sathiamoorthi S, Frank RD, Mohney BG. Spontaneous Resolution and Timing of Intervention in Congenital Nasolacrimal Duct Obstruction // JAMA Ophthalmol 2018; 136:1281.
- Schnall BM, Christian CJ. Conservative treatment of congenital dacryocele // J Pediatr Ophthalmol Strabismus 1996; 33:219.
- Schnall BM. Pediatric nasolacrimal duct obstruction // Curr Opin Ophthalmol 2013; 24:421.
- Wong RK, VanderVeen DK. Presentation and management of congenital dacryocystocele // Pediatrics 2008; 122:e1108.
- Yee SW, Seibert RW, Bower CM, Glasier CM. Congenital nasolacrimal duct mucocele: a cause of respiratory distress // Int J Pediatr Otorhinolaryngol 1994; 29:151.