Кардиоваскулярная автономная нейропатия – фактор риска прогрессирования осложнений сахарного диабета - «Гастроэнтерология»
Журнал "Медицинский совет" №9/2023
DOI:
10.21518/ms2023-161
В.В. Салухов¹, https://orcid.org/0000-0003-1851-0941
Т.А. Зеленина¹, https://orcid.org/0000-0001-6208-0972
Д.Д. Исмаилов¹, https://orcid.org/0000-0002-8756-4970
А.Б. Земляной², https://orcid.org/0000-0002-5438-0075
¹ Военно-медицинская академия имени С.М. Кирова; 194044, Россия, Санкт-Петербург, ул. Академика Лебедева, д. 6
² Российский биотехнологический университет (РОСБИОТЕХ); 125080, Россия, Москва, Волоколамское шоссе, д. 11
Введение. Сахарный диабет (СД) – наиболее распространенная и инвалидизирующая эндокринная патология. Одним из грозных осложнений СД является синдром диабетической стопы (СДС), являющийся возникающим нарушением нетравматических ампутаций конечностей. Несмотря на высокую заболеваемость, выживаемость больных СДС с незаживающими язвами и после операций на стопах не превышает 50% в течение 5 лет и сравнима с выживаемостью пациентов с колоректальным раком.
Цель. Определить особенности появления и оценить влияние прогрессирования сердечно-сосудистой нейропатии (КАН) на развитие других осложнений сахарного диабета у больных с синдромом диабетической остановки в течение двух лет после оперативного лечения.
Материалы и методы. В исследование включено 94 больных СДС после хирургического лечения с тяжелыми послеоперационными ранами с периодом наблюдения два года. Оценка диабетической сенсомоторной нейропатии проводится на основании клинико-неврологического обследования, КАН по результатам шкалы кардиоваскулярных исследований. Прогрессирование КАН за 2 года наблюдения диагностировали по установленным значениям количества баллов по всем тестам на 1 балл и более. Неудовлетворительно полученным лечением СДС выявлено заживление послеоперационных ран более чем за 24 нед., а также случаи госпитализаций и остановок операций на операциях и прекращении остановок Шарко за 2 года наблюдения.
Результаты. Исходно средняя продолжительность СД повышенной 10,7 лет, HbA1c 8,3%, ХсЛПНП 3,3 ммоль/л, ТГ 1,8 ммоль/л. Ампутации в пределах стопы сработали в 51,1% случаев, вскрытие (дренирование) гнойного очага – в 48,9% случаев. КАН выявлена у подавляющего большинства больных (94,7%), в 57,4% выявлена в подтвержденной/выраженной форме. Прогрессирование КАН гепатита у 22,3% пациентов, преимущественно с исходно-функциональной (начальной) стадией. Агрессивное течение КАН увеличивает риск (отношение шансов ОШ) прогрессирования сенсомоторной нейропатии в 14,6 раза, диабетической нефропатии в 22,4 раза, неудовлетворительного результата лечения СДС в 40 раз.
Выводы. Больные с СДС после оперативного лечения относятся к группе риска риска не только наличия подтвержденной/выраженной КАН, но и ее прогрессирования в течение первых двух лет. Агрессивное развитие ассоциировано с неудовлетворительным развитием СДС, так и прогрессированием других микрососудистых осложнений СД.
Для цитирования: Салухов В.В., Зеленина Т.А., Исмаилов Д.Д., Земляной А.Б. Кардиоваскулярная автономная нейропатия – фактор риска прогрессирования осложнений сахарного диабета. Медицинский Совет. 2023;17(9):58-66. https://doi.org/10.21518/ms2023-161
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Cardiac autonomic neuropathy as risk factor of diabetic complications progression
Vladimir V. Salukhov¹, https://orcid.org/0000-0003-1851-0941
Tatiana A. Zelenina¹, https://orcid.org/0000-0001-6208-0972
Daniil D. Ismailov¹, https://orcid.org/0000-0002-8756-4970
Aleksandr B. Zemlianoi², https://orcid.org/0000-0002-5438-0075
¹ Military Medical Academy named after S.M. Kirov; 6, Akademik Lebedev St., St Petersburg, 194044, Russia
² Russian Biotechnology University (ROSBIOTECH); 11, Volokolamskoye Shosse, Moscow, 125080, Russia
Introduction. Diabetes mellitus (DM) is the most common and incapacitating endocrine disorder. Diabetic foot syndrome (DFS) is one of the most serious complications of DM, which is the main cause of nontraumatic lower-extremity amputations. Despite the efforts of the entire medical community, the survival rate of DFS patients with non-healing ulcers and after foot surgery does not exceed 50% over 5 years and is comparable to the survival rates of patients with colorectal cancer.
Aim. It has been demonstrated that postsurgical diabetic foot wounds tend to
chronization of inflammatory process. The diabetic autonomic neuropathy can be
involved in diabetic foot damages. We hypothesized that progression of cardiovascular
autonomic neuropathy (CAN) leads to aggressive microvascular complications of
diabetes and delay the postsurgical wound healing in diabetic foot patients
during 2 years of observation.
Materials and methods. We examined 94 outpatients with postsurgical diabetic
foot wounds and observation period of two years. The clinical neurological
examination and standard cardiovascular autonomic reflex tests with
identification of severe/advanced abnormalities were performed at baseline and
after 2 years. The progression of CAN was diagnosed in cases of an increase in
the amount of cardiovascular autonomic reflex tests by 1 score and more. The
unsatisfactory result of wound treatment was detected in patients with wound
healing delay and new cases of surgery debridement, foot amputations and
Charcot foot during 2 years of observation.
Results. The mean duration of diabetes was 10.7 year, HbA1c 8.3%, LDL-Chol 3.3
mmol/l, TG 1.8 mmol/l. The 51.1% patients had been amputated in the level of
foot, 48.9% patients had surgery debridement. All patients had CAN,
confirmed/severe forms in 57.4% cases. The progression of CAN was found in
22.3% patients, the most of them with functional stage at baseline. The
aggressive course of CAN increased the risk of progression of diabetic
sensomotor neuropathy (OR = 14.6; 95% CI 3.0–70.5; p = 0.0006), nephropathy (OR
= 22.4; 95% CI 3.4–147.4; p = 0.0009) and unsatisfactory result of wound
treatment (OR = 40; 95% CI 6.0–268.5; p = 0.0001).
Conclusions. The patients with diabetic foot surgery wounds has
high risk of confirmed/severe CAN and its progression during 2 years. The
aggressive course of CAN associates with unsatisfactory result of wound
treatment and progression of microvascular diabetic complications.
Для цитирования: Salukhov V.V., Zelenina T.A., Ismailov D.D., Zemlianoi A.B. Cardiac autonomic neuropathy as risk factor of diabetic complications progression. Meditsinskiy sovet = Medical Council. 2023;17(9):58-66. (In Russ.) https://doi.org/10.21518/ms2023-161
Conflict of interest: the authors declare no conflict of interest.
Введение
Сахарный диабет (СД) является
распространенной и инвалидизирующей эндокринной патологией [1]. Прирост
заболеваемости превышает 50% за 5 лет, к 2045 г. число больных СД во всем мире
достигнет 783 млн человек [2]. Наиболее грозным осложнением СД остается синдром
диабетической стопы (СДС), являющийся основной причиной нетравматических
ампутаций нижних конечностей [3, 4]. Несмотря на усилия всего медицинского
сообщества, выживаемость больных с СДС с незаживающими язвами и после операций
на стопах не превышает 50% за 5 лет и сравнима с выживаемостью пациентов с
колоректальным раком [5]. Основной причиной смерти больных с СДС остается
сердечно-сосудистая патология. Другое осложнение, кардиоваскулярная автономная
нейропатия (КАН), является независимым фактором риска сердечно-сосудистых
заболеваний и сердечно-сосудистой смертности у больных СД [6, 7]. КАН заключается
в нарушении иннервации не только сердца, но и центральных и периферических
сосудов. Повреждение иннервации периферических сосудов (нейроциркуляторной
регуляции) лежит в основе патогенеза развития и прогрессирования всех
микрососудистых осложнений СД [8, 9]. Случаи агрессивного течения КАН (прогрессирующего
течения) увеличивают риск сердечно-сосудистой смертности больных СД. Однако
данные о влиянии прогрессирования КАН с течением времени на другие
микрососудистые осложнения СД, особенно среди разных групп больных и больных с СДС,
немногочисленны и противоречивы [10–12].
Цель
исследования:
определить особенности течения и оценить влияние прогрессирования КАН на
развитие других осложнений СД у больных с СДС и послеоперационными ранами на
протяжении 2 лет наблюдения.
Для достижения поставленной цели выполнено
обсервационное (наблюдательное) проспективное исследование с периодом
наблюдения 2 года.
Материалы и методы
Критерии включения пациентов в исследование:
1)
возраст от 35 до 75 лет;
2) CД2;
3) нейропатическая форма СДС;
4) перенесенные оперативные вмешательства по
поводу СДС;
5) открытые послеоперационные раны на стопах.
Критерии исключения из
исследования:
1) недиабетическая нейропатия;
2) заболевания артерий нижних конечностей
(лодыжечно-плечевой индекс (ЛПИ) < 0,9);
3) плохо контролируемый СД (HbA1c ≥ 10%);
4) острые осложнения СД (кетоацидоз, гипер-/гипогликемическая
кома, лактат-ацидоз);
5) хронические осложнения СД тяжелых стадий
(диабетическая ретинопатия, требующая лазерокоагуляции сетчатки, диабетическая
нефропатия с расчетной скоростью клубочковой фильтрации (рСКФ) ≤ 30 мл/мин/1,73
м2);
6) фибрилляция предсердий или наличие
искусственного водителя сердечного ритма;
7) хроническая сердечная недостаточность III–IV ФК;
8) ХОБЛ, а также другие хронические
заболевания в стадии декомпенсации.
Обследование пациентов
Все
пациенты получали оперативное лечение гнойно-некротических осложнений СДС
(вскрытие, дренирование гнойного очага либо ампутации в пределах стопы) в
условиях городского стационара гнойной хирургии СПб ГБУЗ ГБ №14. После выписки
из стационара с открытыми послеоперационными ранами больные проходили амбулаторное
обследование и лечение на базе Военно-медицинской академии им. С.М. Кирова. Работа
одобрена локальным этическим комитетом ГБОУ ВПО СЗГМУ им. И.И. Мечникова
Минздрава России 03.04.2013 г., все пациенты до включения в исследование
подписали информированное согласие.
Из
медицинской документации в работу взята информация о начале развития и длительности
СД, хронических осложнениях, проведенных оперативных вмешательствах на стопах. Антропометрическое,
лабораторное и инструментальное обследование проводилось исходно на момент включения
в исследование с открытыми послеоперационными ранами, а также через 2 года
наблюдения. Учитывались результаты лечения послеоперационных ран (сроки
заживления), а также случаи повторных госпитализаций и операций на протяжении 2
лет наблюдения.
Из
лабораторного обследования в работу вошли данные HbA1c, липидного спектра сыворотки
крови, креатинина и рСКФ.
Исследование кардиальной
автономной иннервации
Для
оценки наличия и выраженности КАН были выполнены 5 стандартных
кардиоваскулярных тестов (КВТ). Парасимпатическую иннервацию исследовали с
помощью теста Вальсальвы и теста с глубоким дыханием. Симпатическую иннервацию
оценивали по изменению артериального давления во время проб с динамометром,
пассивным ортостазом, определяли также холодовую вазоконстрикцию методом
фотоплетизмографии. Результатам каждого из тестов присвоены 0 баллов в случае
нормальных, 0,5 балла в случае пограничных и 1 балл при патологически
измененных значениях (табл. 1).
Таблица 1. Значения кардиоваскулярных тестов и система
присвоения баллов
Кардиоваскулярные тесты | Нормальные значения (0 баллов) | Пограничные значения (0,5 балла) | Патологические значения (1 балл) |
Тест Вальсальвы, усл. ед. | ⩾1,41 | 1,40–1,20 | ⩽1,19 |
Тест с глубоким дыханием, в минуту | ⩾15 | 14–11 | ⩽10 |
Проба с динамометром, мм рт. ст. | ⩾15 | 14–11 | ⩽10 |
Холодовая вазоконстрикция,% | ⩾36 | 35–25 | ⩽24 |
Проба с пассивным ортостазом, мм рт. ст. | ⩽10 | 19–11 | ⩾20 |
Методика
диагностики наличия и выраженности КАН при помощи балльной оценки КВТ
отработана многими исследователями [13, 14]. Согласно последним рекомендациям
экспертов ранняя стадия КАН (КАН 1) верифицируется при наличии ⩾ 1 балла, подтвержденная
форма КАН (КАН 2) – в случаях ⩾ 2
баллов, а тяжелая КАН (КАН 3) – при выявленной симптоматической и/или
бессимптомной ортостатической гипотензии [14].
Исследование
диабетической сенсомоторной нейропатии
Для
оценки наличия и выраженности диабетической сенсомоторной нейропатии (ДСМН)
проводился клинико-неврологический осмотр с заполнением балльной шкалы
нейропатического дисфункционального счета (НДС). Согласно этой шкале, ДСМН верифицируется
при наличии 4 баллов и выше, что коррелирует с результатами электронейромиографии,
являющейся референтной методикой исследования поражений сенсомоторных волокон [15].
Статистическая обработка
данных
Достаточное
количество наблюдений установлено по формулам доказательной медицины с
применением таблиц определения размера выборки для достижения 80%-ной мощности
(α = 0,05, двусторонняя). Тип распределения значений переменных оценивался
путем построения гистограмм распределения, расчета критерия Колмогорова – Смирнова.
Все данные представлены как средняя ± ошибка средней для количественных
переменных с нормальным распределением, как средняя ± 95%-ный доверительный
интервал (ДИ) для переменных с распределением, отличным от нормального, и в
процентах для качественных биполярных переменных. Различие между количественными
признаками в зависимых выборках с нормальным распределением рассчитывалось с
помощью t-критерия Стьюдента, с распределением отличным от нормального
использовался критерий Вилкоксона. Для сравнения качественных переменных между
группами использовался χ² с поправкой Йетса (для малых групп), критерий Фишера.
Отношения
шансов (ОШ) прогрессирования микрососудистых осложнений СД и
неудовлетворительного лечения СДС в зависимости от характера развития КАН определяли
с помощью логистического регрессионного анализа. Для выявления пороговых
значений количественных величин применялся метод классификационных деревьев. Значение
р < 0,05 считалось статистически значимым во всех случаях. Использовался пакет
программ STATISTICA v.13. (Statsoft, USA).
Результаты
Исходная характеристика
больных с СДС
Всего
в исследование включено 94 больных с СДС (38,3% мужчин и 61,7% женщин),
выписанных на амбулаторное лечение после хирургических операций. Исходные
характеристики пациентов представлены в табл. 2.
Таблица 2. Исходные характеристики больных синдромом
диабетической стопы (n = 94)
Параметр | Значение | |
возраст | 57,0 ± 0,93 | |
Пол (м/ж) | 38,3/61,7% | |
Длительность СД2, годы | 10,7 ± 0,92 | |
Возраст на начало СД2 < 40 лет, n (%) | 27 (28,7%) | |
Малые ампутации в анамнезе, n (%) | 20 (21,3%) | |
Перенесенное оперативное лечение | вскрытие, n (%) | 46 (48,9%) |
ампутация, n (%) | 48 (51,1%) | |
Диабетическая ретинопатия (есть/нет, %) | 36,2/63,8% | |
ИБС, n (%) | 52 (55,3%) | |
ГБ, n (%) | 83 (88,3%) | |
Инсулинотерапия, n (%) | 23 (24,5%) | |
Статины, n (%) | 50 (53,2%) | |
НДС, балл | 10,5 ± 0,50 | |
КВТ, балл | 2,1 (95% ДИ 1,8–2,3) | |
КАН 2–3, n (%) | 54 (57,4%) | |
ИМТ, кг/м² | 29,4 ± 0,51 | |
HbA1c, % | 8,3 ± 0,20 | |
обХс, ммоль/л | 5,2 ± 0,13 | |
Хс ЛПНП, ммоль/л | 3,3 ± 0,11 | |
Хс ЛПВП, ммоль/л | 1,2 ± 0,05 | |
ТГ, ммоль/л | 1,8 ± 0,10 | |
рСКФ, мл/мин | 94,5 ± 3,37 | |
Примечание. СД2
– сахарный диабет 2-го типа, ИБС – ишемическая болезнь сердца, ГБ –
гипертоническая болезнь, НДС – шкала нейропатического дисфункционального счета,
КВТ – кардиоваскулярные тесты, КАН – кардиоваскулярная автономная нейропатия,
ИМТ – индекс массы тела, HbA1c – гликированный гемоглобин, обХс –
общий холестерин, Хс ЛПНП – холестерин липопротеидов низкой плотности, Хс ЛПВП
– холестерин липопротеидов высокой плотности, ТГ – триглицериды, рСКФ –
расчетная скорость клубочковой фильтрации.
Как
видно из табл. 2, всем пациентам
выполнены операции, в т. ч. ампутации в пределах стопы в 51,1% случаев (48/94),
после чего больные выписаны на амбулаторное лечение. Вместе с тем более 20% больных
(21,3%; 20/94) имели неоднократные оперативные вмешательства на стопах (малые
ампутации) в анамнезе. Средняя продолжительность СД2 составила 10,7 лет, на
момент постановки диагноза «СД» 28,7% (27/94) больных было моложе 40 лет. Инсулинотерапию
либо комбинированную терапию инсулином и пероральными сахароснижающими
препаратами получали 24,5% (23/94) человек.
У
всех больных исходно имели место микрососудистые осложнения СД. Так, все
пациенты страдали ДСМН преимущественно умеренной степени выраженности (10,5 ± 0,50
балла по шкале НДС), подтвержденная (выраженная) КАН (КАН 2–3) диагностирована
у 57,4% (54/94) больных. Кроме того, диабетическая ретинопатия выявлена в 36,2%
(34/94) случаев, снижение рСКФ менее 60 мл/мин отмечено у 9,6% (9/94) больных.
Макрососудистые осложнения (ИБС) имели место у 55,3% (52/94) пациентов.
Распределение
пациентов по степени выраженности КАН представлено на рис. 1.
Рисунок
1. Распространенность кардиоваскулярной автономной нейропатии среди больных
синдромом диабетической стопы после хирургического лечения
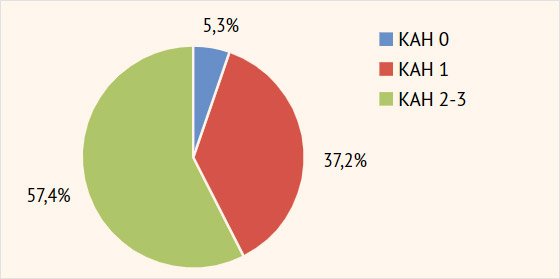
КАН
0 — кардиоваскулярной автономной нейропатии нет; КАН 1 — ранняя стадия; КАН 2 —
подтвержденная стадия; КАН 3 — тяжелая форма, случаи клинической и/или
бессимптомной ортостатической гипотензии
Из
рис. 1 видно, что только у 5,3% (5/94)
пациентов с СДС не была выявлена КАН. В большинстве случаев (57,4%; 54/94)
пациенты страдали подтвержденной или даже тяжелой формой КАН (КАН 2–3).
Следует
отметить, что метаболические параметры СД больных на момент включения в
исследование не соответствовали целевым значениям. Так, средний уровень HbA1c
составил 8,3%, общего холестерина 5,2 ммоль/л, холестерина ЛПНП 3,3 ммоль/л, ТГ
1,8 ммоль/л.
Характеристика пациентов
через 2 года после начала исследования
Все
больные с СДС получали амбулаторное лечение согласно принятым международным и
отечественным стандартам вплоть до заживления раневого дефекта стоп вторичным
натяжением. При наличии рецидива гнойно-некротического процесса больные
госпитализировались в хирургический стационар для повторных операций. Все
случаи повторных операций, а также развития стопы Шарко учитывались на
протяжении двух лет наблюдения.
Среднее
время заживления послеоперационных ран составило 14,3 (95%; ДИ 10,8–17,7) нед.
У 26,6% (25/94) больных раны не зажили и понадобилось повторное оперативное
лечение (вскрытие, ревизия ран, иссечение некротизированных тканей, ампутации в
пределах стопы).
Неудовлетворительными
результатами лечения СДС считались:
1) случаи затяжного заживления послеоперационных
ран (более 24 нед.),
2) рецидив гнойно-некротического процесса с повторными
оперативными вмешательствами, в т. ч. ампутациями на уровне стоп,
3) диагностика стопы Шарко на протяжении двух
лет после включения в исследование.
Таким
образом, результаты лечения СДС на протяжении двух лет оказались
неудовлетворительными у 39,4% (37/94) пациентов. Распределение больных по состоявшимся
результатам лечения СДС представлено на рис. 2.
Рисунок 2. Распределение больных по состоявшимся
результатам лечения синдрома диабетической стопы на протяжении двух лет
наблюдения (n = 94)
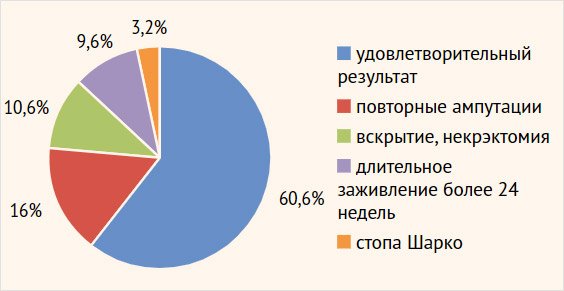
Как представлено на рис. 2, повторные операции (ампутации на уровне стопы, некрэктомии)
понадобились 26,6% пациентов (25/94), в т. ч. по причине незаживших
послеоперационных ран (13 пациентов). Еще у 9 больных (9,6%; 9/94)
послеоперационные раны зажили на протяжении более 24 нед., что интерпретировано
как хронизация воспалительного процесса, а результат лечения расценен как неудовлетворительный.
Стопа Шарко развилась у 6 больных в течение двух лет наблюдения, в т. ч. у трех
пациентов (3,2%; 3/94) с хорошим предыдущим результатом консервативной терапии.
Изменения основных лабораторных
показателей, данных лабораторных и инструментальных исследований больных с СДС
через 2 года представлены в табл. 3.
Таблица 3. Изменение характеристик
пациентов с синдромом диабетической стопы через два года (n = 94)
Параметр | Исходно | Через 2 года | р-значение | |
ИМТ, кг/м² | 29,5 ± 0,51 | 30,6 ± 0,6 | 0,0000 | |
Диабетическая ретинопатия, n (%) | 34 (36,2%) | 34 (36,2%) | ||
НДС, баллы | 10,5 ± 0,50 | 11,9 ± 0,6 | 0,0005 | |
КВТ, баллы | 2,1 (95% ДИ 1,8–2,3) | 1,9 (95% ДИ 1,6–2,2) | 0,7791 | |
рCКФ, мл/мин | 94,5 ± 3,37 | 91,9 ± 4,6 | 0,2716 | |
HbA1c, % | 8,3 ± 0,20 | 8,0 ± 0,22 | 0,0655 | |
обХс, ммоль/л | 5,2 ± 0,13 | 5,3 ± 0,19 | 0,8219 | |
ХсЛПНП, ммоль/л | 3,4 ± 0,11 | 3,2 ± 0,17 | 0,2717 | |
ХсЛПВП, ммоль/л | 1,2 ± 0,05 | 1,3 ± 0,05 | 0,9407 | |
ТГ, ммоль/л | 1,8 ± 0,10 | 1,9 ± 0,13 | 0,0595 | |
Неудовлетворительные результаты лечения СДС, n (%) | 37 (39,4%) | |||
Прогрессирование ДН, n (%) | 28 (29,8%) | |||
Прогрессирование КАН, n (%) | 21 (22,3%) | |||
Примечание. СДС
– синдром диабетической стопы, ДН – диабетическая нефропатия, НДС – шкала нейропатического
дисфункционального счета, КВТ – кардиоваскулярные тесты, КАН –
кардиоваскулярная автономная нейропатия, ИМТ – индекс массы тела, HbA1c – гликированный гемоглобин, обХс –
общий холестерин, Хс ЛПНП – холестерин липопротеидов низкой плотности, Хс ЛПВП
– холестерин липопротеидов высокой плотности, ТГ – триглицериды, рСКФ –
расчетная скорость клубочковой фильтрации.
Через 2 года наблюдения не зарегистрировано
значимых изменений основных метаболических показателей, а также рСКФ и баллов
КВТ у пациентов с СДС. Не выявлены также новые случаи диабетической
ретинопатии. Однако отмечено достоверное прогрессирование ДСМН по баллам шкалы
НДС (рис. 3).
Рисунок 3. Изменение выраженности
диабетической сенсомоторной нейропатии у больных синдромом диабетической стопы
через два года наблюдения
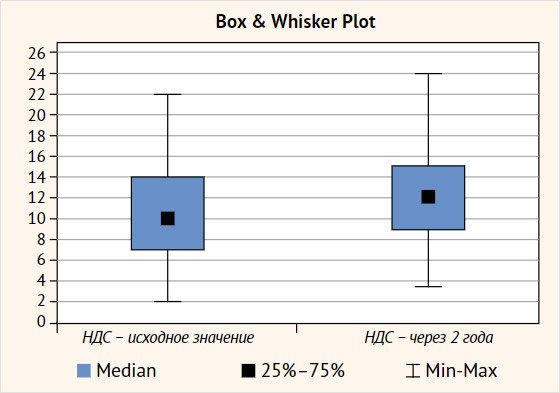
При анализе результатов оказалось, что у
части пациентов с СДС имело место прогрессирование не только ДСМН, но и других
микрососудистых осложнений СД, хотя существенных различий в средних значениях
инструментальных и лабораторных показателей не выявлено. Так, снижение pСКФ более чем на 20 мл/мин через 2
года исследования, расцененное как прогрессирование диабетической нефропатии,
зарегистрировано у 29,8% (28/94) больных, а ухудшение значений КВТ более чем на
1 балл – в 22,3% (21/94) случаев (табл. 3).
Снижение значений КВТ более чем на 1 балл интерпретировано
как прогрессирование КАН. Такое агрессивное течение КАН наблюдалось преимущественно
у больных с исходно ранней (функциональной) стадией осложнения (рис. 4).
Рисунок 4. Прогрессирование
кардиоваскулярной автономной нейропатии у больных с синдромом диабетической
стопы через два года исследования
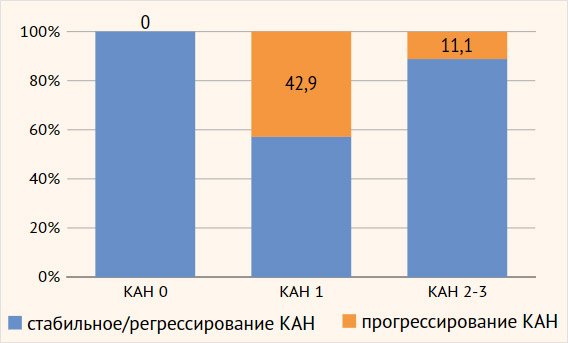
нейропатии нет; КАН 1 — ранняя стадия; КАН 2 — подтвержденная стадия; КАН 3 — тяжелая
форма, случаи клинической и/или бессимптомной ортостатической гипотензии
Таким образом, у более чем 40% больных с СДС
с исходно функциональной стадией КАН (42,9%; 15/35) заболевание развивалось
агрессивно и за 2 года наблюдения перешло в подтвержденную или даже тяжелую
форму, тогда как у пациентов с подтвержденной/тяжелой формой КАН (КАН 2–3)
подобное развитие встречалось только в 11,1% случаев (6/54).
Прогрессирование
осложнений СД2 на протяжении двух лет наблюдения
Следующим этапом исследования был
сравнительный анализ основных изучаемых параметров среди пациентов со
стабильным течением КАН (или даже регрессом) и у больных с прогрессированием
КАН. Выделены факторы, ассоциированные с агрессивным развитием КАН у больных с СДС.
Среди этих факторов оказались:
- возраст
начала СД2 моложе 40 лет, - неудовлетворительный
результат лечения СДС на протяжении 2 лет, - cнижение
рСКФ более чем на 20 мл/мин на протяжении 2 лет исследования, - прогрессирование
ДСМН более чем на 2 балла по шкале НДС.
Так, возраст начала СД2 моложе 40 лет
увеличивал риск (отношение шансов – ОШ) в дальнейшем агрессивного течения КАН у
больных с СДС более чем в 5 раз (5,1; 95% ДИ 1,3–20,8; p =
0,0190). Следует отметить, что ни динамика антропометрических параметров, ни изменения
метаболических показателей не влияли на развитие КАН в исследуемой группе
пациентов на протяжении 2 лет наблюдения.
С помощью статистического метода
логарифмической регрессии также определены отношения шансов (ОШ) прогрессирования
других осложнений СД в зависимости от характера течения КАН (табл. 4).
Таблица 4. Отношение шансов прогрессирования
осложнений сахарного диабета у больных с агрессивным течением кардиоваскулярной
автономной нейропатии на протяжении двух лет наблюдения
Параметр | ОШ | 95% ДИ | р-значение |
неудовлетворительные результаты лечения СДС | 40 | 6,0–268,5 | 0,0001 |
снижение рСКФ > 20 мл/мин | 22,4 | 3,4–147,4 | 0,0009 |
увеличение баллов шкалы НДС > 2 | 14,6 | 3,0–70,5 | 0,0006 |
Примечание. ОШ
– отношение шансов, ДИ – доверительный интервал, СД – сахарный диабет, рСКФ –
расчетная скорость клубочковой фильтрации, НДС – нейропатический
дисфункциональный счет, СДС – синдром диабетической стопы.
Из представленной таблицы видно, что риск
неудовлетворительного результата лечения СДС увеличивался в 40 раз в случаях
прогрессирования КАН на протяжении 2 лет наблюдения. Риск прогрессирования
других микрососудистых осложнений СД (ДСМН и диабетической нефропатии) также
увеличивался в 22,4 и 14,6 раза соответственно.
Обсуждение
Известно, что риск развития сердечно-сосудистых
заболеваний и смерти в 5–7 раз выше у больных СД2, чем у лиц без СД [16, 17].
Среди прочих факторов риска сердечно-сосудистой патологии КАН —
распространенное, однако часто игнорируемое осложнение СД — ассоциирована с
ранней инвалидизацией и смертностью пациентов [7, 18]. Клинические проявления
КАН, такие как безболевой инфаркт миокарда, нарушения сердечного ритма,
постуральная гипотензия, внезапная смерть, зачастую необратимы и фатальны. По
данным литературы, распространенность КАН составляет 17–66% у больных СД1 и
31–73% у пациентов с СД2 [9, 14]. Большой разброс обусловлен как
неоднородностью групп пациентов, так и различиями в критериях, используемых для
диагностики КАН [9, 14, 18].
Известно, что у больных с преддиабетом и
впервые выявленным СД2 КАН встречается до 10% случаев преимущественно в легких,
начальных формах [9]. В данной работе обследована наиболее тяжелая группа
пациентов, у которых уже имеет место ДСМН, а также СДС с неоднократными
оперативными вмешательствами. Именно у этих пациентов КАН различной степени
выраженности диагностирована в подавляющем большинстве случаев (95%; 89/94).
Выделение форм (стадий) КАН имеет
принципиальное значение, поскольку ранние стадии КАН обратимы, а именно
подтвержденные/выраженные ассоциированы с высоким риском сердечно-сосудистой
смертности [18]. Кроме того, в многоцентровых исследованиях на больших
популяциях больных с длительным периодом наблюдения показано, что наличие
подтвержденной КАН ассоциировано с прогрессированием как ретинопатии, так и
нефропатии у больных СД [10, 11]. В когорте пациентов с СДС продемонстрировано,
что ортостатическая гипотензия является фактором риска летального исхода в
ближайшие пять лет после ампутаций нижних конечностей [19, 20]. Случаи
подтвержденной/выраженной КАН также ассоциированы с удлинением сроков
заживления послеоперационных ран у больных СДС [12]. В данном исследовании
подтвержденные/тяжелые формы КАН имели место у 60% больных (57,4%; 54/94). Возможно,
это объясняет неудовлетворительный результат лечения СДС почти у 40% пациентов
(39,4%; 37/94), к которому были отнесены все случаи затяжного течения раневого
процесса (хронизация воспаления), а также повторных операций, ампутаций и
диагностированной стопы Шарко.
Особый интерес вызывает прогрессирование
КАН с течением времени у больных СД.
В ранее состоявшихся исследованиях подобный
вариант течения заболевания на протяжении длительного времени наблюдения
выявлен у 10–20% пациентов с СД. Данные относительно влияния метаболических
факторов на характер течения КАН в литературе противоречивы. Установлена связь
прогрессирования КАН с ранним началом СД2 (моложе 40 лет), уровнем HbA1c более
6,8%, ТГ более 1,7 ммоль/л, а также снижением скорости клубочковой фильтрации [21].
Показано, что агрессивное развитие КАН ассоциировано как с высоким риском
смерти от сердечно-сосудистой патологии, так и прогрессированием других
микрососудистых осложнений СД, а именно диабетической нефропатии. Однако
остается до конца не ясным значение подобного прогрессирования (агрессивного
течения) КАН для разных категорий больных СД [10, 11].
В нашем исследовании агрессивное течение
КАН выявлено более чем в 20% случаев (22,3%; 21/94). Прогрессирование
заболевания зарегистрировано не на протяжении длительного времени, а через 2
года наблюдения. Следовательно, больных с СДС следует отнести в группу высокого
риска как наличия клинически значимых форм КАН, так и ее агрессивного развития.
Подобный вариант развития КАН у больных с СДС
оказался ассоциирован с молодым возрастом (младше 40 лет) постановки диагноза «СД2»,
что согласуется с данными других исследований [11, 21]. Действительно, в
литературе имеются сведения о важности возраста пациентов на момент выявления
СД2 для прогноза течения заболевания в целом. Так, раннее начало СД2 ассоциировано
с более агрессивным развитием СД, необходимостью ранней инициации
комбинированной терапии пероральными сахароснижающими препаратами и
инсулинотерапии для компенсации параметров углеводного обмена, а также
прогрессивным течением микро- и макрососудистых осложнений [11, 21]. Такая
особенность развития заболевания у молодых пациентов еще раз подчеркивает
разнородность СД2 в целом.
Учитывая вышеупомянутые данные литературы,
отсутствие связи агрессивного течения КАН с параметрами углеводного и липидного
обмена у больных с СДС в нашем исследовании требует разъяснения. В нашей работе
больные были однородны по показателям метаболического обмена, и исходные, и
определенные через 2 года наблюдения параметры были далеки от целевых.
Последний факт может объяснить общую тенденцию к прогрессированию КАН (более
20% случаев) среди больных с СДС. В литературе влияние метаболических факторов
на течение КАН показано на тысячах наблюдений и за длительный период времени,
поэтому в выборках меньших размеров и за короткий период наблюдения сила влияния
указанных параметров может не быть достоверной.
Важным результатом нашей работы является демонстрация
влияния агрессивного развития КАН на прогрессирование диабетической нефропатии,
ДСМН, а также хронизацию воспалительного процесса и риск повторных оперативных
вмешательств и ампутаций у больных с СДС.
Хронизация воспаления у больных с СДС
остается неразрешенной проблемой и до настоящего времени. С одной стороны,
гипергликемия приводит к угнетению клеточного и гуморального иммунитета у
больных СД [22–24]. С другой стороны, ДСМН нижних конечностей со снижением
тактильной и болевой чувствительности обуславливает бессимптомное течение
микротравм [25]. Нарушение микроциркуляции (микроангиопатия) приводит к повреждению
барьерной функции кожи и слизистых, замедленному ответу на микробную инвазию,
что ухудшает заживление язв и послеоперационных ран у больных СД. Обусловленная
симпатической иннервацией вазодилатация играет защитную роль против инфекции,
инициируя воспалительный ответ. Повреждение ауторегуляции микроциркуляторного
кровотока кожи вследствие нарушенной иннервации снижает воспалительный ответ и
способствует прогрессированию и хронизации инфекции кожи и мягких тканей [25,
26].
Нарушение вазодилатации микроциркуляции в
ответ на повреждение, а также обкрадывание микроциркуляторного русла через
систему шунтирования по причине все той же КАН лежит в основе функциональной
ишемии нижних конечностей у больных с СДС [27]. Имеются данные о
неблагоприятном прогнозе для сохранения конечности нарушенного симпатического
ответа даже после успешной реваскуляризации и восстановления магистрального
кровотока у пациентов с СДС [28].
В нашей работе впервые показано увеличение
в 40 раз риска хронизации воспалительного процесса, замедления заживления и
необходимости в выполнении повторных операций и ампутаций у пациентов с
прогрессирующим повреждением кардиоваскулярной иннервации. В литературе
встречаются немногочисленные исследования, демонстрирующие влияние
периферической иннервации на воспалительный процесс у больных СД, однако
результаты противоречивы [12, 26]. В нашей работе наглядно продемонстрирована
связь агрессивного развития КАН в ближайшие 2 года после операции с
неблагоприятным исходом консервативного лечения послеоперационных ран у больных
с СДС. С одной стороны, этот факт приоткрывает завесу тайны высокой смертности
больных с СДС после операций на cтопах
либо с незаживающими язвами стоп в ближайшие 5 лет даже при отсутствии
распространенного атеросклеротического процесса. С другой стороны, имеет
неоценимое прикладное практическое значение, диктуя необходимость не только
применения высокотехнологичных методов заживления послеоперационных ран у
подобных пациентов, но и активного внедрения средств, замедляющих
прогрессирование КАН [29]. Следует еще раз подчеркнуть необходимость
комплексного подхода к лечению пациентов с СДС после оперативного лечения со
стороны специалистов, занимающихся как проблемами ран и раневых инфекций, так и
кардиальной патологией [20, 30].
В нашем исследовании к неблагоприятному
исходу также отнесены также все случаи вновь диагностированной стопы Шарко у
обследованных больных. Развитие нейроостеоартропатии с последующей стойкой
деформацией костно-суставного аппарата стоп способствует рецидивирующему
течению раневого процесса с повторными операциями. С другой стороны, большое
значение для формирований нейроостеоартропатии отводится повторяющейся
травматизации стопы, в т. ч. оперативным вмешательствам на стопе, которые
косвенно приводят к активации остеокластов, повышая местный уровень
провоспалительных цитокинов. Весомый
вклад в развитие нейроостеоартропатии вносит сенсомоторная нейропатия с
развитием слабости мышечно-связочного аппарата стоп, вывихов и подвывихов в
суставах стопы, и особенно автономная нейропатия, способствующая возникновению
артериовенозных шунтов. Открытие артериовенозных шунтов приводит к
интенсификации локального кровотока с повышением местного уровня конечных
продуктов гликирования, увеличением экспрессии цитокина RANKL и, как следствие,
к активации остеокластов и деминерализации кости [31]. Подобные механизмы
объясняют высокий риск развития нейроостеоартропатии у больных с СДС как после операций
на стопе, так и с прогрессированием КАН.
Выводы
КАН различной степени выраженности
диагностирована среди всех больных с СДС после оперативного лечения.
Распространенность подтвержденных (выраженных) форм КАН достигает почти 60%
случаев (57,4%; 54/94).
Течение КАН у больных с СДС после
оперативного лечения зачастую принимает агрессивный характер. Прогрессирование КАН
на протяжении 2 лет наблюдения зарегистрировано более чем у 20% пациентов
(22,3%; 21/94). Таким образом, больные с СДС после оперативного лечения на
стопах относятся к группе высокого риска выявления подтвержденных/выраженных
форм КАН и их прогрессирования в ближайшие 2 года. Агрессивное течение КАН у
больных с СДС после хирургического лечения ассоциировано с ранним началом СД2 (моложе
40 лет) на фоне нецелевых параметров углеводного и липидного обмена. Подобный
вариант развития КАН увеличивает риск прогрессирования других микрососудистых
осложнений СД, а именно ДСМН (в 14,6 раза) и диабетической нефропатии (в 22,4
раза).
В исследовании впервые выявлена
закономерность взаимного отягощения случаев прогрессирования КАН и
неблагоприятного течения раневого процесса у больных с СДС после хирургического
лечения на протяжении 2 лет наблюдения. Риск хронизации раневого процесса, повторных
оперативных вмешательств, в т. ч. ампутаций на стопах, у больных с
нейропатической формой СДС после оперативного лечения при агрессивном течении
КАН увеличивается в 40 раз.
Список литературы / Список литературы
- Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021. Сахарный диабет. 2021;24(3):204-221. https://doi.org/10.14341/DM12759. Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А. Эпидемиологическая характеристика сахарного диабета в Российской Федерации: клинико-статистический анализ по данным Федерального регистра сахарного диабета на 01.01.2021. Сахарный диабет. 2021;24(3):204-221. (на рус. языке) https://doi.org/10.14341/DM12759.
- Американская диабетическая терапия. Введение: Стандарты медицинской помощи при сахарном диабете-2022. Уход за диабетом. 2022;45(1 Дополнение):S1-S2. https://doi.org/10.2337/dc22-Sint .
- Бреговский В.Б., Карпова И.А. Анализ специализированной помощи больным с синдромом диабетической стопы в Санкт-Петербурге за 2010-2021 гг. Сахарный диабет. 2022;25(5):477-484. https://doi.org/10.14341/DM12914 .
- Ворохобина Н.В., Зеленина Т.А., Петрова Т.М. Использование метода оперативного лечения больных с гнойно-некротическими формами синдрома диабетической остановки с частотами рецидивов, риском ампутаций и выживаемостью. Индия в хирургии. 2009;7(4):39-44. Режим доступа:
https://www.elibrary.ru/item.asp?id=24358226 . Ворохобина Н.В., Зеленина Т.А., Петрова Т.М. Эффективный метод хирургического лечения больных с гнойно-некротическими формами синдрома диабетической остановки с частыми рецидивами, риском ампутаций и выживаемостью. Индия в хирургии. 2009;7(4):39-44. (In Russ.) Режим доступа:
https://www.elibrary.ru/item.asp?id=24358226 . - Армстронг Д.Г., Боултон А.Дж., Бас С.А. Диабетические язвы стопы и их рецидивы. N Engl J Med. 2017;24:2367-2375. https://doi.org/10.1056/NEJMra1615439 .
- Рубцов Ю.Е., Крюков Е.В., Халимов Ю.Ш. Сосудистое старение и сахарный диабет 2 типа. Эндокринология: новости, мнения, обучение. 2021;10(1):52-61. https://doi.org/10.33029/2304-9529-2021-10-1-52-61. Рубцов Ю.Е., Крюков Е.В.,
Халимов Ю.Ш. Сосудистое старение и сахарный диабет 2 типа. Эндокринология: новости, мнения, обучение. 2021;10(1):52-61. (На рус. языке)
https://doi.org/10.33029/2304-9529-2021-10-1-52-61. - Попов К.А., Токмакова А.Ю., Бондаренко И.З. Предикторы и диагнозы индивидуальной нервной иннервации у больных сахарным диабетом 1 и 2 типа. Сахарный диабет. 2017;20(3):185-193. https://doi.org/10.14341/8156. Попов К.А., Токмакова Все. Ю., Бондаренко И.З. Предикторы и диагностика сердечно-вегетативной нервной дисфункции у больных сахарным диабетом 1 и 2 типа. Сахарный диабет. 2017;20(3):185-193. (На рус. языке)
https://doi.org/10.14341/8156. - Строев Ю.И., Чурилов Л.П. От диабетической нейроангиопатии - к диабетической стопе: клиническая патофизиология грозного синдрома. Клиническая патофизиология. 2016;22(2):74-94. Режим доступа:
https://elibrary.ru/item.asp?id=26536380 . Строев Ю.И., Чурилов Л.П. От диабетической нейроангиопатии - к диабетической стопе: клиническая патофизиология грозного синдрома. Клиническая патофизиология. 2016;22(2):74-94. (In Russ.) Режим доступа: https://elibrary.ru/item . асп?идентификатор=26536380. - Зеленина Т.А., Салухов В.В., Земляной А.Б., Железняк С.Г., Клиценко О.А. Нарушение микроциркуляторного кровотока у больных сахарным диабетом 2 типа и кардиоваскулярной нервной нейропатией. Сахарный диабет. 2021;24(1):32-44. https://doi.org/10.14341/DM12372. Зеленина Т.А., Салухов В.В., Земляной А.Б., Железняк С.Г., Клиценко О.А. Нарушение микрососудистого кровотока у больных сахарным диабетом 2 типа и сердечно-сосудистой вегетативной нейропатией. Сахарный диабет. 2021;24(1):32-44. (на рус. языке)
https://doi.org/10.14341/DM12372. - Йен С.И., Чен С.С., Ляо К.М., Фани И.Мо. Кардиальная вегетативная нейропатия предсказывает прогрессирование диабетической ретинопатии у азиатской популяции с сахарным диабетом 2 типа. Graetes Arch Clin Exp Офтальмол. 2022;260(8):2491-2499. https://doi.org/10.1007/S00417-022-05597-7.
- Орлов С., Черней Д.З.И., Поп-Бусуй Р., Ловблом Л.Е., Фикосиелло Л.Х., Смайлз А.М. и соавт. Кардиальная вегетативная невропатия и раннее прогрессирующее снижение функции почек у пациентов с немакроальбуминурическим диабетом 1 типа. Клин Джем Сок Нефрол. 2015;10(7):1136-1144. https://doi.org/10.2215/CJN.11441114.
- Земляной А.Б., Зеленина Т.А., Салухов В.В. Прогноз заживления послеоперационных ран у больных с синдромом диабетической стопы. Медицинский вестник МВД. 2021;(5):48-54. https://doi.org/10.52341/2073808_2021_114_5_48. Земляной А.Б., Зеленина Т.А., Салухов В.В. Прогноз заживления послеоперационных ран у больных с гнойно-некротическими формами диабетической стопы после выписки из стационара. Медицинский вестник МВД. 2021;(5):48-54. (на рус. языке)
https://doi.org/10.52341/2073808_2021_114_5_48. - Зеленина Т., Салухов В., Волкова Е., Земляной А., Гирина М. Высокочастотная ультразвуковая допплерография может использоваться для скрининга диабетической кардиальной вегетативной нейропатии. Int J Endocrinol Metab Disord. 2019;5(2):1-8. https://doi.org/10.16966/2380-548X.160.
- Хэ Т., Ван Ч., Цзо А., Лю П., Чжао Р., Ли В. и др. Электрохимическую проводимость кожи можно использовать для скрининга сердечно-сосудистой нейропатии у китайцев с диабетом. J Диабет Res. 2017;2017:1-6. https://doi.org/10.1155/2017/8289740.
- Valk GD, de Sonnaville JJJ, Houtum WH, Heine RJ, Eijk JTM, Bouter LM et al. Оценка диабетической полинейропатии в повседневной клинической практике: воспроизводимость и достоверность исследования монофиламентов semmes weinstein и клинического неврологического обследования. Мышечный нерв. 1997; 20:116-118. https://doi.org/10.1002/(SICI)1097-4598(199701)20 : 13.0.CO ;2-2.
- Walsh JW, Hoffstad OJ, Sullivan MO, Margolis DJ Ассоциация диабетической язвы стопы и смерти в популяционной когорте из Соединенного Королевства. Диабет Мед. 2016;11:1493-1498. https://doi.org/10.1111/dme.13054.
- Равшани А., Равшани Ар., Франзен С., Элиассон Б., Свенссон А.-М., Мифтарадж М. и соавт. Смертность и сердечно-сосудистые заболевания при диабете 1 и 2 типа. N Engl J Med. 2017;376(15):1407−1418. https://doi.org/10.1056/NEJMoa1608664.
- Тесфайе С., Боултон А., Дайк П., Фримен Р., Хотовиц М., Кемплер П. и др. Диабетические невропатии: обновленные определения, диагностические критерии, оценка тяжести и лечение. Уход за диабетом. 2010;33:2285-2293. https://дои . орг/10.2337/dc10-1303.
- Самбатаро М., Самбадо Л., Спинетти Г., Сеганфреддо Э., Тревизиол Э., Маскон М. и соавт. Сердечно-сосудистая смертность и ортостатическая гипотензия у пациентов с диабетом 2 типа с поражениями нижних конечностей - Итальянская ассоциация пациентов с диабетом - секция проекта Тревизо. Диабет. 2019;68(Прил.1):621-С. https://doi.org/10.2337/db19-621-P.
- Ивануса С.Я., Рисман Б.В., Янишевский А.В., Шаяхметов Р.Э., Матвеев И.С. Опыт лечения синдрома диабетической стопы в общей хирургии Военно-медицинской академии им. С.М. Кирова. Медицинский вестник ГВКГ им. Н.Н Бурденко. 2021;(3):20-29. https://doi.org/10.53652/2782-1730-2021-2-3(5)-20-29 . Ивануса С.Я., Рисман Б.В., Янишевский А.В., Шаяхметов Р.Е., Матвеев И.С. Лечение синдрома диабетической стопы в клинике общей хирургии Военно-медицинской академии им. С.М. Кирова. Медицинский вестник Главного военного клинического госпиталя им. Н. Н. Бурденко. 2021;(3):20-29. (На рус. языке) https://doi.org/10.53652/2782-1730-2021-2-3(5)-20-29.
- Андерсен С.Т., Витте Д.Р., Андерсен Х., Лауритцен Т., Йоргенсен М.Е., Дженсен Т.С. и соавт. Факторы риска наличия и прогрессирования сердечно-сосудистой автономной невропатии при диабете 2 типа: ДОПОЛНЕНИЕ-Дания. Уход за диабетом. 2018;41(12):2586-2594. https://doi.org/10/2337/dc18-1411.
- Рисман Б.В., Ивануся С.Я., Янышевский А.В., Шаяхметов Р.Э. Современные подходы к осмотру синдрома диабетической стопы. Известия Российской Военно-медицинской академии. 2020;39(3):19-26. https://doi.org/10.17816/rmmar.393 . Рисман Б.В., Ивануса С.Я., Янишевский А.В., Шаяхметов Р.Е. Современные подходы в лечении синдрома диабетической стопы. Доклады Российской военно-медицинской академии. 2020;39(3):19-26. (на рус. языке) https://doi.org/10.17816/rmmar.393.
- Маилян М.Э., Пугачев М.И., Шустов С.Б., Салухов В.В., Ливарский П.А. Особенности интерлейкинового статуса у пациентов с сахарным диабетом 1 типа. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2022;14(2):23-34. https://doi.org/10.17816/mechnikov107281 . Маилян М.Е., Пугачев М.И., Шустов С.Б., Салухов В.В., Ливарский П.А. Особенности интерлейкинового статуса у больных сахарным диабетом 1 типа. Вестник Северо-Западного государственного медицинского университета имени И. И. Мечникова. 2022;14(2):23-34. (на русс.) https://doi.org/10.17816/mechnikov107281.
- Крюков Е.В., Кучмин А.Н., Уманская Е.П., Нагорный М.Б., Шевелев А.А. Основные патогенетические механизмы гиперкоагуляции при сахарном диабете и возможности ее медикаментозной коррекции. Вестник Российской Военно-медицинской академии. 2021;23(2):165-174. https://doi.org/10.17816/brmma64995. Крюков Е.В., Уманская Е.П., Кучмин А.Н., Нагорный М.Б., Шевелев А.А. Основные патогенетические механизмы гиперкоагуляции при сахарном диабете и возможности ее медикаментозной коррекции. Вестник Российской военно-медицинской академии. 2021;23(2):165-174. (На рус. языке) https://doi.org/10.17816/brmma64995.
- Зеленина Т.А., Земляной А.Б., Салухов В.В., Исмаилов Д.Д. Сахарный диабет и инфекционные заболевания. Медицинский вестник МВД. 2023;(1):30-39. https://doi.org/10.52341/20738080_2023_122_1_30. Зеленина Т.А., Земляной А.Б., Салухов В.В., Исмаилов Д.Д. Сахарный диабет и инфекционные заболевания. Медицинский вестник МВД. 2023;(1):30-39. (На рус. языке) https://doi.org/10.52341/20738080_2023_122_1_30.
- Рустит М., Краковски Ю.Л. Неинвазивная оценка функции микрососудов кожи у человека: обзор методов. Микроциркуляция. 2012;19(1):47-64. https://doi.org/s://doi:10.1111/j.1549-8719.2011.00129.x.
- Бреговский В.Б., Карпова И.А., Алексеева Е.С. Нарушения кожной микроциркуляции в естественных условиях при сахарном диабете: патофизиологический феномен или объект для лечения? Сахарный диабет. 2011;14(3):49-53. https://doi.org/10.14341/2072-0351-6224. Бреговский В.Б., Карпова И.А., Алексеева Е.С. Нарушения кожной микроциркуляции нижних конечностей при сахарном диабете: патофизиологический феномен или объект терапии? Сахарный диабет. 2011;14(3):49-53. (на рус. языке) https://doi.org/10.14341/2072-0351-6224.
- Schreuder SM, Nieuwdorp M., Koelemay MJW, Bipat S., Reekers JA Тестирование симпатической нервной системы стопы имеет высокую прогностическую ценность для ранней ампутации у больных сахарным диабетом с нейроишемической язвой. BMJ Open Diabetes Res Care. 2018;6(1):e000592. https://doi.org/10.1136/bmjdrc-2018-000592.
- Салухов В.В., Халимов Ю.Ш., Шустов С.Б., Кадин Д.В. Снижение сердечно-сосудистого риска у пациентов с сахарным диабетом 2-го типа: обзор основных заболеваний и выявление исследований. Сахарный диабет. 2018;21(3):193-205. https://doi.org/10.14341/DM9570. Салухов В.В., Халимов Ю.С., Шустов С.Б., Кадин Д.В. Снижение сердечно-сосудистого риска у больных сахарным диабетом 2 типа: обзор общепринятых стратегий и клинических исследований. Сахарный диабет. 2018;21(3):193-205. (на рус. языке) https://doi.org/10.14341/DM9570.
- Галстян Г.Р., Токмакова А.Ю., Бондаренко О.Н., Ситкин И.И., Пряхина К.Ю., Митиш В.А., Доронина Л.П. Заболевания артерий конечностей у пациентов с сахарным диабетом: состояние проблемы и перспективы лечения. Сахарный диабет. 2011;14(1):74-80. https://doi.org/10.14341/2072-0351-6253 . Галстян Г.Р., Токмакова А.Ю., Бондаренко О.Н., Ситкин И.И., Пряхина К.Ю., Митиш В.А., Доронина Л.П. Артериальные заболевания нижних конечностей у больных сахарным диабетом: современное состояние и перспективы терапии. Сахарный диабет. 2011;14(1):74-80. (на рус. языке) https://doi.org/10.14341/2072-0351-6253.
- Зайцева Е.Л., Каландия М.М., Токмакова А.Ю., Малышева Н.М., Никанкина Л.В., Галстян Г.Р. Роль нейрогуморальных факторов в персистенции асептического воспаления костной ткани у пациентов с диабетической нейроостеоартропатией. Сахарный диабет. 2022;25(5):485-449. https://doi.org/10.14341/DM20225. Зайцева Е.Л., Каландия М.М., Токмакова А.Ю., Малышева Н.М., Никанкина Л.В., Галстян Г.Р. Роль нейрогуморальных факторов в персистенции асептического воспаления костей у больных диабетической нейроостеоартропатией. Сахарный диабет. 2022;25(5):485-491. (на рус. языке) https://doi.org/10.14341/DM12961.
Другие новости
Как избавиться от вздутия живота - «Гастроэнтерология»
personРогнеда 21-01-24, 00:01Вздутие живота - распространенное состояние, при котором живот кажется наполненным и напряженным. Иногда он ощутимо...
Гастроэнтеролог Алисова объяснила, что делать, если вас
personFabe 06-09-23, 00:00В случае рвоты важно сохранять спокойствие и не паниковать. После рвоты медленно пейте маленькими глотками воду или...
Оценка деформации миокарда левого желудочка в режиме 2D
personМаланья 12-01-21, 00:00На сайте компании АО «Спарго Технологии» открыт новый раздел, в котором собрана полезная и......




