Иммунологическое обоснование комплексной терапии пациенток с ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазией легкой степени - «Гинекология»
Журнал "Медицинский совет" №5/2021
DOI: 10.21518/2079-701X-2022-16-5-118-127
Л.В. Ткаченко, https://orcid.org/0000-0002-1935-4277
Н.И. Свиридова, https://orcid.org/0000-0002-3175-4847
Т.В. Складановская, https://orcid.org/0000-0002-1427-610X
И.А. Гриценко, https://orcid.org/0000-0001-6761-2990
C.Г. Шишиморова, https://orcid.org/0000-0002-0729-7869
Волгоградский государственный медицинский университет; 400131, Россия, Волгоград, пл. Павших Борцов, д. 1
Введение. Развитию инвазивного рака шейки матки предшествуют цервикальные интраэпителиальные неоплазии различной степени тяжести, представляющие собой патологический процесс, при котором в толще многослойного плоского эпителия шейки матки появляются клетки с различной степенью атипии и нарушением дифференцировки.
Цель. Изучить влияние комплексной терапии пациенток с ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазией легкой степени на динамику показателей локального цитокинового статуса и параметров аутоиммунитета.
Материалы и методы. В исследование было включено 86 пациенток в возрасте от 35 до 40 лет с морфологически верифицированной цервикальной интраэпителиальной неоплазией легкой степени. Основную группу составили 52 пациентки, которым наряду с радиоволновой деструкцией шейки матки назначали иммуностимулирующий препарат с противовирусной активностью Гроприносин по 1000 мг 3 раза в сутки в течение 10 дней за 10–14 дней до деструкции и аналогичные 2 курса через 10–14 дней после нее. В группу сравнения вошли 34 пациентки, которым проводилась только радиоволновая деструкции шейки матки.
Результаты. Анализ исходов плоскоклеточных интраэпителиальных поражений низкой степени через 6 мес. показал, что в основной группе регрессия CIN I наблюдалась у 92,3% пациенток, персистенция – в 7,7% случаев, в то время как в группе сравнения регрессия CIN I отмечена в 73,5% случаев, персистенция – у 26,5% больных.
Выводы. Проведение комплексной терапии, включающей радиоволновую деструкцию и применение препарата с иммуностимулирующей и противовирусной активностью Гроприносин у пациенток с ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазией легкой степени, приводит к устранению исходного дисбаланса цитокинов и нормализации уровней аутоантител, способствуя снижению вероятности персистенции ВПЧ и прогрессии CIN.
Для цитирования: Ткаченко Л.В., Свиридова Н.И., Складановская Т.В., Гриценко И.А., Шишиморова С.Г. Иммунологическое обоснование комплексной терапии пациенток с ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазией легкой степени. Медицинский Совет. 2022;(5):118-127. https://doi.org/10.21518/2079-701X-2022-16-5-118-127
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Immunological substantiation of complex therapy in patients with mild HPV-associated cervical intraepithelial neoplasia
Liudmila V. Tkachenko, https://orcid.org/0000-0002-1935-4277
Natalia I. Sviridova✉, https://orcid.org/0000-0002-3175-4847
Tatyana V. Skladanovskaya, https://orcid.org/0000-0002-1427-610X
Irina A. Gritsenko, https://orcid.org/0000-0001-6761-2990
Svetlana G. Shishimorova, https://orcid.org/0000-0002-0729-7869
Volgograd State Medical University; 1, Pavshikh Bortsov Square, Volgograd, 400131, Russia
Introduction. As is known, the development of invasive cervical cancer is preceded by cervical intraepithelial neoplasia of varying severity, which is a pathological process in which cells with varying degrees of atypia and impaired differentiation appear in the thickness of the stratified squamous epithelium of the cervix.
Objective. To study the effect of complex therapy in patients with mild HPV-associated cervical intraepithelial neoplasia on the dynamics of local cytokine status and autoimmunity parameters.
Materials and methods. The study included 86 patients aged 35 to 40 years with morphologically verified mild cervical intraepithelial neoplasia. The main group consisted of 52 patients who, along with radio wave destruction of the cervix, were prescribed an immunostimulating drug with antiviral activity “Groprinosin-Richter” 1000 mg 3 times a day for 10 days 10–14 days before destruction and similar 2 courses after 10–14 days after it. The comparison group included 34 patients who underwent only radio wave destruction of the cervix.
Results. An analysis of the outcomes of low-grade squamous intraepithelial lesions after 6 months showed that in the main group, CIN I regression was observed in 92.3% of patients, persistence – in 7.7% of cases, while in the comparison group, CIN I regression was noted in 73,5% of cases, persistence – in 26.5% of patients.
Conclusions. Conducting complex therapy, including radio wave destruction and the use of a drug with immunostimulating and antiviral activity “Groprinosin-Richter” in patients with low-grade HPV-associated cervical intraepithelial neoplasia, leads to the elimination of the initial imbalance of cytokines and normalization of autoantibody levels, helping to reduce the likelihood of HPV persistence and CIN progression to invasive cervical cancer uterus.
For citation: Tkachenko L.V., Sviridova N.I., Skladanovskaya T.V., Gritsenko I.A., Shishimorova S.V. Immunological substantiation of complex therapy in patients with mild HPV-associated cervical intraepithelial neoplasia. Meditsinskiy sovet = Medical Council. 2022;(5):118-127. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-5-118-127
Conflict of interest: the authors declare no conflict of interest.
Введение
В условиях неблагоприятной демографической ситуации, складывающейся на территории Российской Федерации за последние годы, сохранение репродуктивного здоровья женщин является одним из приоритетных направлений акушерско-гинекологической службы системы здравоохранения.
Как известно, рак шейки матки (РШМ) остается одной из наиболее распространенных форм злокачественных новообразований у женщин. Это ведущая злокачественная опухоль в структуре женской онкологической заболеваемости и смертности в развивающихся и важнейшая медицинская и социальная проблема во всех экономически развитых странах [1, 2].
Ежегодно в мире диагностируется около 604 тыс. новых случаев РШМ и почти 342 тыс. летальных исходов от него. В Российской Федерации распространенность заболевания составляет 126,8 на 100 тыс. населения, а летальность в течение одного года с момента установления диагноза – 13,5% [3]. За последние 10 лет заболеваемость РШМ в России выросла на 25%, а смертность от РШМ – на 4,31%. Обращает на себя внимание тот факт, что в последние годы наблюдается тенденция к существенному росту доли женщин репродуктивного возраста, страдающих РШМ [1, 2]. Так, среди молодых женщин, умерших от онкологических заболеваний в возрасте 30–34 лет, практически каждая четвертая умерла от РШМ [1].
Известным является факт, что развитию инвазивного рака шейки матки предшествуют предраковые состояния – цервикальные интраэпителиальные неоплазии различной степени тяжести (Cervical Intraepithelial Neoplasia – CIN), представляющие собой патологический процесс, при котором в толще многослойного плоского эпителия шейки матки появляются клетки с различной степенью атипии и нарушением дифференцировки [4, 5].
Данные общемировой статистики в отношении частоты встречаемости цервикальной интраэпителиальной неоплазии внушают тревогу. Установлено, что ежегодно в мире диагностируется около 30 млн новых случаев CINI и более 10 млн случаев CINII-III [1]. Более благополучная ситуация отмечается сегодня в США, развитых странах Европы и Азии. Однако даже там имеет место отчетливая тенденция к росту диагностированных CIN и рака шейки матки [1, 6].
Установлено, что при отсутствии отягощающих факторов цервикальные интраэпителиальные неоплазии низкой степени в 30–60% случаев подвергаются регрессии в течение 3–5 лет, в то время как у 10–30% женщин, имеющих нормальную цитологическую картину цервикального эпителия и являющихся носителями ДНК ВПЧ высокого онкогенного риска, наблюдается прогрессирование CIN I до CIN III и карциномы in situ, а у 1,5% пациенток – развитие инвазивного рака шейки матки [1]. Вместе с тем, независимо от тяжести CIN и наличия ВПЧ высокого онкогенного риска, вероятность регрессии заболевания снижается на 21% каждые 5 лет [5, 7].
Как известно, факторами риска развития предраковых состояний и рака шейки матки являются: раннее начало половой жизни, частая смена половых партнеров, ранние и/или частые роды и аборты в анамнезе, сопутствующие урогенитальные инфекции и нарушения микробиоценоза влагалища, табакокурение, иммунодефицитные состояния, генетическая предрасположенность, длительный (более 5 лет) прием комбинированных оральных контрацептивов и др. [5, 8].
Общепризнанным этиологическим фактором возникновения РШМ и предшествующих ему дисплазий является инфицирование цервикальных тканей вирусом папилломы человека (ВПЧ) высокого онкогенного риска [1, 8–11]. Установлено, что ДНК ВПЧ высокого онкогенного риска (преимущественно 16-го и 18-го типов) обнаруживают в 30–80% образцов умеренной и тяжелой дисплазии многослойного плоского эпителия шейки матки и в 90% — инвазивного РШМ [1]. Существует две формы папиллома-вирусной инфекции (ПВИ) [1, 9, 11]: продуктивная, при которой ДНК вируса находится в инфицированной клетке в свободной эписомальной форме, и интегративная, или трансформирующая, при которой ДНК вируса встраивается в геном инфицированной клетки, утрачивая свою индивидуальность.
Доказанным является тот факт, что ВПЧ способен длительно персистировать в многослойном плоском эпителии. Установлено, что особенности иммунной защиты конкретного организма влияют не только на возможность реинфицирования, но и, главное, на исход длительной персистенции вируса папилломы человека. Согласно многочисленным исследованиям, практически у каждой третьей пациентки при персистенции ПВИ отмечается прогрессирование заболевания [9, 11, 12]. Персистирование вируса, приводящее к инициированию канцерогенеза, обусловлено, с одной стороны, онкогенностью ВПЧ и его уклонением от надзора иммунной системы посредством ограничения репликационного цикла эпителия, отсутствия виремии и цитолиза, а с другой стороны, способностью ВПЧ вызывать локальную иммуносупрессию за счет вирусных белков [13].
Учитывая тот факт, что с позиции клинической иммунологии реализация клеточной трансформации эпителия при ПВИ представляет собой вторичное иммунодефицитное состояние, основной целью ведения пациенток с ВПЧ-ассоциированными цервикальными интраэпителиальными неоплазиями является удаление инфицированных клеток эпителия вплоть до базального слоя с применением деструктивных методов лечения на фоне коррекции системных и локальных иммунологических нарушений [14–21].
Анализ доказательной научной базы по клинико-иммунологической эффективности препарата инозин пранобекс (Гроприносин-Рихтер, ОАО «Гедеон Рихтер») свидетельствует о его выраженной иммуностимулирующей активности в сочетании с неспецифическим противовирусным действием. Инозин пранобекс – синтетическое производное пурина, по своему химическому строению представляет собой комплекс, содержащий инозин и N,N-диметиламино-2-пропанол в молярном соотношении 1:3. Эффективность комплекса определяется присутствием инозина, при этом второй компонент (пранобекс) повышает его доступность для лимфоцитов. Инозин пранобекс стимулирует биохимические процессы в макрофагах, восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитов, а также стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов. Кроме того, стимулирует активность Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, интерферона-гамма (IFN-γ), интерлейкинов IL-1 и IL-2, снижает образование противовоспалительных цитокинов IL-4 и IL-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия инозина пранобекса обусловлен ингибированием вирусной РНК и дигидроптероатсинтетазы, участвующей в репликации вирусов; усилением подавленной вирусами синтеза мРНК лимфоцитов, что влечет за собой уменьшение синтеза вирусной РНК и трансляции вирусных белков, а также повышением продукции лимфоцитов, обладающих противовирусными свойствами альфа- и гамма-интерферонов.
Согласно данным многочисленных исследований, иммуностимулирующая и противовирусная терапия препаратом инозин пранобекс приводит к элиминации ПВИ и полной эпителизации шейки матки, значительно снижая частоту рецидивов и повышая эффективность деструктивных методов лечения ВПЧ-ассоциированных заболеваний [9, 11, 22–26].
Цель исследования: изучить влияние комплексной терапии пациенток с ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазией легкой степени на динамику показателей локального цитокинового статуса и параметров аутоиммунитета.
Материалы и методы
В исследование было включено 86 пациенток в возрасте от 35 до 40 лет с морфологически верифицированной цервикальной интраэпителиальной неоплазией легкой степени (CIN I), обратившихся в клинико-диагностическую поликлинику ГБУЗ «Волгоградский областной клинический перинатальный центр №2» за период с 11.2019 по 02.2021 г. Проведение данного исследования было одобрено региональным независимым этическим комитетом ГУ ВМНЦ. От каждой пациентки получено письменное добровольное информированное согласие на участие в данном исследовании и обработку персональных данных.
Критериями включения в исследование явились: возраст пациенток от 35 до 40 лет, наличие впервые гистологически верифицированной цервикальной интраэпителиальной неоплазии легкой степени, цитологически подтвержденный диагноз LSIL; отсутствие аномалий в мазках из цервикального канала; удовлетворительная кольпоскопическая картина (картина поражений шейки матки на фоне зоны трансформации I типа); наличие ВПЧ высокого канцерогенного риска (ВПЧ ВКР); согласие использовать барьерный метод контрацепции в течение всего периода исследования; информированное добровольное согласие пациенток на проведение необходимых лечебно-диагностических мероприятий.
Критериями исключения явились: наличие инфекции мочеполовой системы в фазе активного воспаления; наличие терапии иммуномодулирующими препаратами в течение последних 6 мес.; положительные тесты RW или ВИЧ; тяжелые формы экстрагенитальной патологии; нарушение свертываемости крови; злокачественные новообразования любой локализации; индивидуальная непереносимость используемых лекарственных препаратов; беременность; период грудного вскармливания.
Все пациентки, включенные в исследование, случайным образом были распределены на две группы. Основную группу составили 52 пациентки, которым наряду с активным ведением (применение радиоволновой деструкции шейки матки с использованием радиохирургического аппарата «Сургитрон») назначали иммуностимулирующий препарат с противовирусной активностью Гроприносин-Рихтер (по 1000 мг 3 раза в сутки в течение 10 дней за 10–14 дней до деструкции и аналогичные 2 курса через 10–14 дней после нее).
В группу сравнения вошли 34 пациентки, которым согласно клиническим рекомендациям (протоколам диагностики и ведения больных) «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» от 02.11.2017 г. была выбрана тактика активного ведения в объеме радиоволновой деструкции шейки матки.
Согласно протоколу исследования исходно и через 6 мес. всем пациенткам проводили: общеклиническое обследование, цитологическое исследование мазков с экто- и их эндоцервикса (жидкостная цитология с оценкой полученных препаратов в соответствии с классификацией Bethesda – The Bethesda System, TBS 2014), ВПЧ-тестирование (качественное и количественное (оценка вирусной нагрузки) генотипирование 12 типов ВПЧ ВКР методом полимеразной цепной реакции в реальном времени (ПЦР-РТ) с помощью набора реагентов «АмплиСенс ВПЧ ВКР скрин-титр-FL» в соответствии с рекомендациями производителя ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора (Москва)) и расширенную кольпоскопию [12]. Биопсия шейки матки с последующим гистологическим исследованием выполняли под кольпоскопическим контролем из наиболее измененных участков шейки матки с использованием радиохирургического аппарата «Сургитрон» на этапе включения в исследование и через 6 мес. (при наличии показаний в соответствии с клиническими рекомендациями) после деструкции.
Кроме того, исходно, через 3 и 6 мес. от начала наблюдения нами проведена динамическая оценка параметров местного иммунитета и аутоиммунитета.
Концентрацию цитокинов (IL-1β, IL-4, IL-10, TNF-α, IFN-γ) в цервиковагинальной слизи (забор осуществлялся на 7–9-й день менструального цикла) определяли методом твердофазного иммуноферментного анализа с применением набора реагентов ЗАО «Вектор-Бест» (Новосибирск) по инструкциям, приложенным к данным тест-системам. Анализ полученных данных проводился по стандартной калибровочной кривой с последующим определением концентрации изучаемых цитокинов в пг/мл [12].
Оценка параметров аутоиммунитета выполнялась методом твердофазного иммуноферментного анализа с использованием специальных наборов реагентов («ЭЛИ-П-Комплекс», производство медицинского иммунологического центра «Иммункулус», Москва). Данный набор применяется для полуколичественного определения регуляторных аутоантител класса IgG в сыворотке крови обследуемых пациенток. Среди изучаемых аутоантител наибольшее внимание уделяли уровню аутоантител к двухспиральной ДНК и белку S-100, являющимся маркерами процессов апоптоза [12, 20]. Оценка результатов, полученных в ходе настоящего исследования, проводилась в соответствии с алгоритмом, разработанным производителем набора реагентов (производство медицинского иммунологического центра «Иммункулус», Москва). Границы физиологического уровня аутоантител к используемым антигенам находятся в диапазоне от -20 до +10% от уровня средней индивидуальной иммунореактивности; пограничные (умеренные) отклонения уровня аутоантител: от +11 до + 20% и от -21 до -30%. Достоверными принято считать отклонения, которые находятся в диапазоне более +20% и менее -30% [12, 27, 28]. Контрольную группу для сопоставления параметров местного иммунитета и аутоиммунитета составили 30 здоровых женщин в возрасте от 35 до 40 лет.
Длительность наблюдения за пациентками составила 6 мес. Основой оценки эффективности лечения CIN I явился расчет доли пациенток с полной регрессией CIN I через 6 мес. после радиоволновой деструкции. Критерии полной регрессии CINI: отсутствие признаков CIN I при проведении расширенной кольпоскопии; негативация ДНК-ВПЧ; отрицательный результат цитологического исследования цервикального соскоба; отсутствие морфологических признаков CINI в биоптате.
Статистическая обработка полученных данных выполнялась с помощью программы Microsoft Excel, а также статистического пакета Statgraphics Centurion 18 (разработчик – Statgraphics Technologies Inc.), накопление и визуализация данных – в программе Microsoft Exel 2010 (разработчик Microsoft Inc.). Для количественных параметров выполнялась проверка гипотезы о нормальности распределения с использованием критерия Шапиро – Уилка. С учетом принятой гипотезы далее были определены: среднее значение (М), стандартное отклонение (SD). Данные представлены в виде SD. Значимость различий сопоставляемых средних величин определялась для независимых данных по t-критерию Стьюдента, для связанных групп использован парный t-критерий. Для качественных данных определялась частота встречаемости (%), для сравнения изучаемых независимых групп использовался критерий χ2 Пирсона, для связанных групп – критерий Мак-Немара. Статистически значимыми считались отличия при наименьшем уровне значимости p < 0,05. Для номинальных переменных рассчитывался риск с 95%-ным доверительным интервалом (95% ДИ) [12].
Результаты
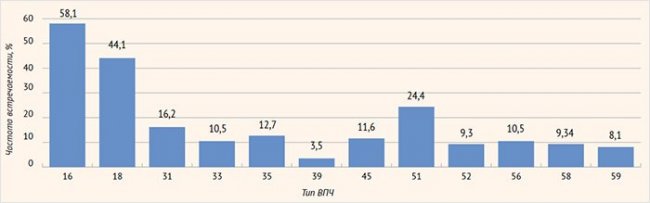
Анализ распределения типов ВПЧ у обследуемой когорты пациенток выявил, что среди высокоонкогенных типов преобладали: 16 (58,1%), 18 (44,1%), 31 (16,2%) и 51 (24,4%) (рис. 1). В ходе проведения распределения пациенток с CIN I по количеству одновременно выявленных типов ВПЧ установлено, что в подавляющем большинстве случаев (48,8%) диагностировали только один тип ВПЧ, в то время как у каждой третьей пациентки (32,6%) обнаружено два высокоонкогенных типа ВПЧ. Максимальное количество одновременно диагностируемых типов ВПЧ (6 типов) выявлено у трех пациенток.
Рисунок 1. Распространенность серотипов вируса папилломы человека высокого канцерогенного риска у пациенток с CIN I
В результате анализа данных количественного генотипирования установлено, что среди пациенток с цервикальной интраэпителиальной неоплазией легкой степени клинически значимая вирусная нагрузка (от 3 до 5 lg ВПЧ на 100 000 клеток) выявлена у 42 (48,8%) обследуемых, при этом повышенная концентрация ДНК ВПЧ (более 5 lg ВПЧ на 100 000 клеток) диагностирована у 33 (38,4%) больных. Таким образом, «значимая» вирусная нагрузка была выявлена у 75 (87,2%) пациенток.Частота встречаемости, %
При проведении расширенной кольпоскопии у обследуемой когорты пациенток выявлены аномальные кольпоскопические картины, характеризующиеся наличием слабовыраженных поражений многослойного плоского эпителия шейки матки (табл. 1), что в сочетании с наличием высокоонкогенных типов ВПЧ явилось показанием к выполнению биопсии.
Таблица 1. Результаты кольпоскопического исследования пациенток с CINI
| Кольпоскопический признак | Частота выявления, % |
Ацетобелый эпителий(тонкий, плоский или слегка приподнятый над поверхностью, с неровными, нечеткими краями; сохраняется недлительно) | 75 (87,2%) |
Мозаика(нежная, регулярная, расположена плоско, реакция на уксус слабая) | 64 (74,4%) |
Пунктация(нежная, регулярная, расположена плоско, реакция на уксус слабая) | 58 (67,4%) |
Лейкоплакия (кератоз)(плоская или слегка приподнятая над поверхностью) | 32 (37,2%) |
Йоднегативное окрашивание (частичное, нерезко выраженное) | 86 (100%) |
В соответствии с критериями включения все пациентки имели цитологически подтвержденный диагноз LSIL (при отсутствии аномальных изменений в мазках из цервикального канала), который коррелировал с морфологически верифицированной CIN I.
Согласно результатам иммунологического исследования у пациенток с цервикальной интраэпителиальной неоплазией установлено статистически значимое снижение (p < 0.001) концентрации IL-1β, на фоне незначительного (p > 0,05) повышения концентраций цитокинов IL-4, IL-10, TNF и IFN-γ (табл. 2). Данные изменения свидетельствуют о наличии выраженных дисфункциональных изменениях Th-1 клеточного иммунного ответа, характеризующегося дисбалансом секреции цитокинов. Это создает условия для персистенции папиллома-вирусной инфекции, что способствует прогрессии цервикальных интраэпителиальных неоплазий.
Таблица 2. Динамика концентрации цитокинов в цервикальной слизи у пациенток с CIN I
| Группы пациенток | Показатели, пг/мл | |||||
| IL-1β | IL-4 | IL-10 | TNF | IFN-γ | ||
| Контрольная группа (n = 30) | 1 246,54 (161,2) | 182,23 (19,77) | 170,41 (22,48) | 140,26 (18,03) | 208,44 (17,12) | |
| Основная группа (n = 52) | Исходно | 389,38 (29,04)* (p = 0,02) | 274,34 (36,01)(p = 0,06) * | 238,58 (26,12)(p = 0,06) * | 193,56 (22,14)(p = 0,06) * | 258,04 (20,22) (p = 0,09) * |
| Через 3 мес. | 2 063,71 (194,02) (p = 0,002) **, (p = 0,04) *** | 230,66 (28,46) (p = 0,08) **, (p = 0,08) *** | 160,12 (15,08) (p = 0,05) **, (p = 0,07) *** | 278,79 (32,13)(p = 0,06) **, (p = 0,09) *** | 2 451,38 (212,06) (p = 0,002) **, (p = 0,002) *** | |
| Через 6 мес. | 923,15 (48,42) (p = 0,02) **, (p = 0,04) *** | 242,18 (24,02) (p = 0,06) **,(p = 0,06) *** | 187,75 (31,14) (p = 0,06) **, (p = 0,1) *** | 189,65 (21,46)(p = 0,3) **, (p = 0,2) *** | 213,16 (14,05) (p = 0,08) **, (p = 0,09) *** | |
| Группа сравнения (n = 34) | Исходно | 458,64 (38,24) (p = 0,01) * | 290,62 (40,03)(p = 0,06) * | 216,31 (22,16)(p = 0,06) * | 188,05 (21,44) (p = 0,06) * | 270,72 (19,12) (p = 0,1) * |
| Через 3 мес. | 463,23 (34,65)(p = 0,3)** | 266,62 (20,17)(p = 0,2) ** | 202,16 (18,11) (p = 0,2) ** | 236,94 (21,15)(p = 0,3) ** | 335,69 (28,23)(p = 0,08) ** | |
| Через 6 мес. | 588,92 (51,04)(p = 0,1) ** | 289,18 (33,02)(p = 0,2) ** | 210,24 (30,18) (p = 0,2) ** | 165,69 (16,08)(p = 0,2) ** | 264,32 (12,28)(p = 0,4) ** | |
* Различия в сравнении с показателями контрольной группы (t-критерий Стьюдента).
** Различия в сравнении с показателями до лечения (парный t-критерий Стьюдента).
*** Статистически значимые различия в сравнении с показателями группы сравнения (t-критерий Стьюдента).
Согласно данным проведенного исследования, у 75 (87,2%) пациенток с цервикальной интраэпителиальной неоплазией слабой степени, имеющих клинически значимую или повышенную вирусную нагрузку, установлен выраженный дисбаланс параметров аутоиммунитета. Обращает на себя внимание статистически значимое снижение (p < 0,001) уровней аутоантител к двуспиральной ДНК (-36,28 (2,04)%) в сравнении с женщинами контрольной группы (-4,12 (1,06)%), а также выраженный дисбаланс профилей аутоантител к белку S-100, который играет значимую роль в регуляции и упорядочении процессов апоптоза (рис. 2). Кроме того, следует отметить тот факт, что у 11 (12,8%) обследуемых, концентрация ДНК ВПЧ которых была расценена как малозначимая, диагностировано пограничное (умеренное) отклонение уровней аутоантител к двуспиральной ДНК (-28,81 (1,74)%) в сочетании с незначительным дисбалансом профилей аутоантител к белку S-100. Полученные данные свидетельствуют о том, что определение содержания уровней аутоантител к двуспиральной ДНК и белку S-100 в сыворотке крови методом «ЭЛИ-П-тест» может быть использовано в качестве маркеров прогнозирования развития цервикальной интраэпителиальной неоплазии.
Рисунок 2. Динамика изменений содержания аутоантител у пациенток с CIN I

В соответствии с протоколом исследования все пациентки случайным образом были распределены на две группы: основная группа (n = 52), в которой наряду с активным ведением (применение радиоволновой деструкции шейки матки с использованием радиохирургического аппарата «Сургитрон») назначали иммуностимулирующий препарат с противовирусной активностью Гроприносин-Рихтер (по 1000 мг 3 раза в сутки в течение 10 дней за 10–14 дней до деструкции и аналогичные 2 курса через 10–14 дней после нее); группа сравнения (n = 34), в которой согласно клиническим рекомендациям (протоколам диагностики и ведения больных) «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» была выбрана тактика активного ведения в объеме радиоволновой деструкции шейки матки. В соответствии с клиническими рекомендациями «Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки» динамическое наблюдение пациенток после хирургического лечения LSIL проводилось посредством цитологического исследования микропрепаратом шейки матки и ВПЧ-тестирования через 6 мес. [27]. Динамическая оценка показателей цитокинового статуса и параметров аутоиммунитета осуществлялась через 3 и через 6 мес. от начала лечения.
Через 2 мес. после окончания иммунопротивовирусной терапии препаратом Гроприносин-Рихтер выявлено статистически значимое (p < 0,001) увеличение в цервикальной слизи концентрации цитокина INF-γ до 2 451,38 (212,06) пг/мл, а также повышение концентрации IL-1β до 2 063,71 (194,02) пг/мл на фоне незначительного увеличения (p > 0,05) концентрации IL-4, IL-10, в то время как в группе сравнения статистически значимых изменений концентрации цитокинов отмечено не было. Полученные данные свидетельствуют об устранении исходных дисфункциональных изменений Th-1-клеточного иммунного ответа у пациенток основной группы.
В ходе динамической оценки параметров аутоиммунитета по истечении трех месяцев от начала лечения у пациенток основной группы отмечена нормализация содержания уровней аутоантител в 80,7% случаев (χ2 = 9,4, p < 0,001), статистически значимое улучшение показателей уровня аутоантител – у 16 (19,3%) пациенток (χ2 = 4,4, р = 0,04). Полученные данные свидетельствовали об активации процессов апоптоза у данной когорты пациенток и снижении риска прогрессии CIN I до предраковых состояний, а также инвазивного рака шейки матки. Обращает на себя внимание отсутствие значимых изменений иммунореактивности (p > 0,05) практически у каждой третьей пациентки группы сравнения (32,4%), что позволяет думать о сохраняющейся персистенции папиллома-вирусной инфекции у данной когорты пациенток.
Цитологическое исследование, проведенное через 6 мес. от начала лечения, показало отсутствие патологических изменений у 48 (92,3%) пациенток основной группы, и лишь в 7,7% случаев были выявлены признаки, характерные для LSIL (в последующем гистологически верифицированные как CIN I), в то время как в группе сравнения нормальные результаты цитологического исследования диагностированы у 25 (73,5%), а заключение LSIL установлено в 26,5% случаев, что было чаще, чем в основной группе (χ2 = 5,6; p = 0,02; ОР 3,4; 95% ДИ 1,15–10,2).
Согласно результатам количественного генотипирования ВПЧ ВКР через 6 мес. от начала лечения полная элиминация ВПЧ диагностирована у 48 (92,3%) пациенток основной группы, что было чаще, чем в группе сравнения (χ2 = 5,6; p = 0,02; ОР 1,25; 95% ДИ 1,1–1,6). Клинически малозначимая вирусная нагрузка установлена у 3 (5,8%) больных, и лишь у одной пациентки (1,9%) с верифицированным сочетанием шести типов ВПЧ сохранялась клинически значимая вирусная нагрузка.
Обращает на себя внимание тот факт, что в группе сравнения ПЦР полная элиминация ВПЧ выявлена у 25 (73,5%), клинически малозначимая вирусная нагрузка диагностирована в 11,8% случаев, в то время как клинически значимая и повышенная вирусная нагрузка установлена у 5 (14,7%) обследуемых (χ2 = 5,1; p = 0,02), что свидетельствует о персистирующем течении ПВИ у данной когорты пациенток и сохраняющемся риске прогрессии плоскоклеточных интраэпителиальных неоплазий.
При выполнении расширенной кольпоскопии у 4 (7,7%) пациенток основной группы и 9 (26,5%) обследуемых группы сравнения сохранялись аномальные кольпоскопические картины, характеризующиеся наличием слабовыраженных изменений многослойного плоского эпителия, верифицированные впоследствии морфологически как CIN I (χ2 = 5,6; p = 0,02; ОР 3,4; 95% ДИ 1,15–10,2).
Данные иммунологического исследования, проведенного через 6 мес. от начала лечения в основной группе, выявили статистически значимое (р < 0,001) снижение концентрации цитокина IFN-γ, сопоставимое с показателями контрольной группы (табл. 2), что, вероятно, можно объяснить подавлением репликации вируса папилломы человека высокоонкогенного риска и устранением локальных воспалительных изменений в многослойном плоском эпителии шейки матки. Выявленные изменения цитокинового статуса пациенток группы сравнения в динамике свидетельствовали о сохраняющемся нарушении работы клеточных механизмов иммунитета, следствием чего является персистенция ПВИ с последующим прогрессированием неопластических процессов.
Спустя 6 мес. от начала лечения нормализация уровней аутоантител отмечена у 48 (92,3%) пациенток, что было чаще, чем в группе сравнения (73,5%) (χ2 = 5,6; p = 0,02; ОР 3,4; 95% ДИ 1,15–10,2), а статистически значимое улучшение параметров аутоиммунитета диагностировано в 7,7% случаев (χ2 = 4,97; p = 0,04; ОР 0,51; 95% ДИ 0,35–0,74). Полученные данные свидетельствуют об устранении исходного дисбаланса показателей иммунореактивности до значений, сопоставимых с показателями контрольной группы (рис. 2).
Кроме того, обращает на себя внимание достоверное повышение среднего содержания профилей аутоантител к двуспиральной ДНК (-7,78 (1,46)%) и белку S-100 (0,26 (0,15)%) у пациенток основной группы (p < 0,001) (рис. 2). Результаты лечения больных группы сравнения свидетельствуют о сохраняющемся умеренном снижении уровней аутоантител к двуспиральной ДНК на фоне статистически незначимого повышения профилей аутоантител к белку S-100 (p > 0,05) (рис. 2). Данный факт позволяет думать о недостаточной эффективности радиоволновой монодеструкции пациенток с CIN I, ассоциированной с ВПЧ-ВКР, и, как следствие, высоком риске персистенции ВПЧ с последующим развитием неопластических процессов в эпителии шейки матки.
Анализ исходов плоскоклеточных интраэпителиальных поражений низкой степени через 6 мес. показал, что в основной группе регрессия CIN I наблюдалась у 92,3% пациенток, персистенция – в 7,7% случаев, в то время как в группе сравнения регрессия CIN I отмечена в 73,5% случаев, персистенция – у 26,5% больных.
Обсуждение
Несмотря на совершенствование методов диагностики и профилактики рака шейки матки, его частота во всем мире неуклонно растет, что требует оптимизации тактики ведения пациенток с угрозой развития злокачественной трансформации многослойного плоского эпителия шейки матки [1, 5, 9, 26].
Как известно, цервикальные интраэпителиальные неоплазии различной степени тяжести предшествуют развитию инвазивного рака шейки матки, который остается одной из наиболее распространенных форм злокачественных новообразований женщин, ассоциированных с вирусом папилломы человека [1, 5, 18, 19]. В связи с этим в последнее десятилетие пристальное внимание ученых приковано к проблеме папиллома-вирусной инфекции [1, 5, 8, 9, 11, 15, 19, 24, 26].
Многочисленные исследования убедительно свидетельствуют о наличии тесной связи между манифестацией ВПЧ и изменениями в иммунной системе [1, 5, 8, 9, 10, 15, 19, 24, 26]. Достоверно установлено, что после инфицирования клеток многослойного плоского эпителия ВПЧ происходит активация врожденного иммунного ответа. Однако ВПЧ модулирует врожденный иммунный ответ для обеспечения персистенции [11, 13, 26]. Опосредованная ВПЧ дисрегуляция иммунного ответа в период персистенции вируса может способствовать подавлению иммунитета и рассматриваться в качестве необходимого условия для прогрессирования рака шейки матки, ассоциированного с ВПЧ [1, 11, 13, 26].
Выраженность и характер иммунной реактивности от степени диспластических изменений в многослойном плоском эпителии шейки матки обуславливают необходимость включения препаратов с противовирусной и иммуностимулирующей активностью в комплекс лечения пациенток с ВПЧ-ассоциированной CIN.
Как известно, тактика лечения женщин репродуктивного возраста с CIN, ассоциированной с ВПЧ, основана на применении деструктивных методов лечения (хирургический этап) в сочетании с адъювантной противовирусной и иммуностимулирующей терапией (медикаментозный этап) [13, 19, 26]. Результаты исследований свидетельствуют о том, что хирургический этап лечения позволяет иссечь (эксцизия) или разрушить (абляция, вапоризация) патологическую ткань или ее каркас, что способствует решению двух важных задач: обеспечения условий для физиологической эпителизации шейки матки и подавления активности ВПЧ на локальном уровне [13, 26].
Однако воздействие на местном уровне не означает подавление вирусной активности в организме, без которого риск рецидивов папиллома-вирусной инфекции возрастает многократно [13, 26]. Важно отметить, что препараты чистых интерферонов (ИФН) и их индукторов могут быть неэффективны для лечения папиллома-вирусной инфекции ввиду резистентности ВПЧ-инфицированных клеток к ИФН, находящейся в прямой зависимости от уровня онкобелков E6 и E7 [26]. Известным является факт, что онкобелки E6 и E7 нейтрализуют противовирусную активность эндогенного и экзогенного ИФН путем избирательного блокирования генов, индуцируемых ИФН [11, 26].
Результаты проведенного нами исследования свидетельствуют об эффективности комплексной терапии ВПЧ-ассоциированных CIN I, включающей радиоволновую деструкцию и применение препарата Гроприносин-Рихтер с иммуностимулирующей и противовирусной активностью. Следует отметить, что через 6 мес. от начала лечения в основной группе регрессия CIN I наблюдалась у 92,3% пациенток, персистенция – в 7,7% случаев, в то время как в группе сравнения регрессия CIN I отмечена в 73,5% случаев, персистенция – у 26,5% больных. Кроме того, применение препарата Гроприносин-Рихтер способствовало сокращению сроков и повышению качества эпителизации шейки матки, что согласуется с данными других авторов [9].
Выводы
Проведение комплексной терапии, включающей радиоволновую деструкцию и применение препарата с иммуностимулирующей и противовирусной активностью Гроприносин-Рихтер у пациенток с ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазией легкой степени, приводит к устранению исходного дисбаланса цитокинов и нормализации уровней аутоантител, способствуя снижению вероятности персистенции ВПЧ и прогрессии цервикальной интраэпителиальной неоплазии.
Список литературы / References
- Киселев В.И., Муйжнек Е.Л., Ашрафян А.Л., Сухих Г.Т. Новая парадигма прогрессирования цервикальных неоплазий: от фундаментальных знаний - к практической гинекологии. Акушерство и гинекология. 2019;(1):5-12. https://doi.org/10.18565/2019.1.5-12.
- Ашрафян Л.А., Киселев В.И., Кузнецов И.Н., Серова О.Ф., Узденова З.Х., Герфанова Е.В. Рак шейки матки: проблемы профилактики и скрининга в Российской Федерации. Доктор.Ру. 2019;(11):50-54. https://doi.org/10.31550/1727-2378-2019-166-11-50-54
- Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.). Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии Минздрава РФ»; 2020. 239 с. Режим доступа: https://glavonco.ru/cancer_register/Помощь 2019.pdf.
- Савельева Г.М., Сухих Г.Т., Манухин И.Б., Радзинский В.Е. (ред.). Гинекология. Национальное руководство. М.: ГЭОТАР-Медиа; 2017. 1048 с. Режим доступа: https://www.cpkmed.ru/materials/El_Biblio/AktualDoc/akusherstvo-i-ginekologija/9.pdf.
- Байрамова Г.Р., Баранов И.И., Ежова Л.С., Трофимов Д.Ю., Припутневич Т.В., Амирханян А.С., Старинская А.М. Плоскоклеточные интраэпителиальные поражения шейки матки: возможности ранней диагностики и тактики ведения пациенток. Доктор.Ру. 2019;(11):61-67. https://doi.org/10.31550/1727-2378-2019-166-11-61-67.
- Ochs K., Meili G., Deibold J., Arndt V., Gunthert A. Incidence trends of cervical cancer and its precancerous lesions in women of Central Switzerland from 2000 until 2014. From Med. (Lausanne). 2018;5:58. https://doi.org/10.3389/fmed.2018.00058.
- Khieu M., Butler S.L. High Grade Squamous Intraepithelial Lesion. StatPearls. Treasure Island (FL): StatPearls Publishing; 2019. Available at: https://www.ncbi.nlm.nih.gov/books/NBK430728.
- Прилепская В.Н., Сухих Г.Т. (ред.). Диагностика, лечение и профилактика цервикальных неоплазий. М.: МЕДпресс-информ; 2020. 80 с.
- Абакарова П.Р., Прилепская В.Н. ВПЧ-ассоциированные заболевания шейки матки. Возможности комплексной терапии. Гинекология. 2017;19(5):4-9. Режим доступа: https://gynecology.orscience.ru/2079-5831/article/view/30007.
- Ткаченко Л.В., Свиридова Н.И., Шишиморова С.Г. Анализ структуры носительства вируса папилломы человека у пациенток с цервикальной интраэпителиальной неоплазией легкой степени. Вестник ВолгГМУ. 2020;1(73):116-119. https://doi.org/10.19163/1994-9480-2020-1(73)-116-119.
- Тихомиров А.Л., Сарсания С.И., Филатова Г.А. Вирус папилломы человека: от понимания иммуногенеза к рациональной тактике ведения. Гинекология. 2018;(3):5-11. https://doi.org/10.26442/2079-5696_2018.3.5-11.
- Ткаченко Л.В., Свиридова Н.И., Шишиморова С.Г., Делеске И.А. Динамика показателей цитокинового статуса и аутоиммунитета у пациенток с латентными формами папилломавирусной инфекции. Акушерство и гинекология. 2020;(9):225-232. https://doi.org/10.18565/aig.2020.9.225-232.
- Прилепская В.Н., Абакарова П.Р., Довлетханова Э.Р., Гусаков К.И., Назарова Н.М., Межевитинова Е.А. ВПЧ-ассоциированные заболевания шейки матки (цервикальная интраэпителиальная неоплазия). Акушерство и гинекология. Алгоритмы диагностики и лечения. 2021;(Прил. 12):13-18. Режим доступа: https://aig-journal.ru/articles VPCh-ASSOCIIROVANNYE-ZABOLEVANIYa-ShEIKI-MATKI-CERVIKALNAYaINTRAEPITELIALNAYa-NEOPLAZIYa-CIN.html.
- Межевитинова Е.А., Донников А.Е., Прилепская В.Н. Дисплазия шейки матки. Роль цитокинотерапии в повышении эффективности лечения. Акушерство и гинекология: новости, мнения, обучение. 2019;7(4):66-71. Режим доступа: https://cyberleninka.ru/article/n/displaziya-shei-ki-matkirol-tsitokinoterapii-v-povyshenii-effektivnosti-lecheniya.
- Боровиков И.О., Куценко И.И., Горринг Х.И. Опыт применения иммуномодулирующего препарата в терапии папилломавирусной инфекции гениталий у женщин. Акушерство и гинекология. 2018;(3):122-128. https://doi.org/10.18565/aig.2018.3.122-128.
- Абакарова П.Р., Прилепская В.Н., Межевитинова Е.А., Донников А.Е. Локальная цитокинотерапия в комплексном лечении ВПЧ-ассоциированных заболеваний шейки матки. Гинекология. 2019;21(1):28-32. https://doi.org/10.26442/20795696.2019.1.190284.
- Дубровина С.О., Ардинцева О.А., Красильникова Л.В., Варичева М.В., Африкьян О.А. К вопросу о диагностике, профилактике и терапии патологии шейки матки. Гинекология. 2018;20(5):33-36. https://doi.org/10.26442/2079-5696_2018.5.33-36.
- Зароченцева Н.В., Джиджихия Л.К. Цервикальные интраэпителиальные неоплазии: современный взгляд на проблему и пути решения. Акушерство и гинекология: новости, мнения, обучение. 2016;(4):92-101. Режим доступа: https://acu-gin-journal.ru/ru/jarticles_acu/263.html?SSr= 27013489f112ffffffff27c__07e604010c1b2a-42cf.
- Адамян Л.В., Аполихина И.А., Артымук Н.В., Ашрафян Л.А., Баранов И.И., Байрамова Г.Р. и др. Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки: клинические рекомендации. М.; 2020. 59 с. Режим доступа: http://disuria.ru/_ld/10/1047_kr21N86N87MZ.pdf.
- Гизингер О.А., Радзинский В.Е. Вирус папилломы человека: патогенез и коррекция иммунных нарушений. Доктор.Ру. Гинекология. 2021;118(6):80-86. https://doi.org/10.31550/1727-2378-2021-20-6-80-86.
- Довлетханова Э.Р., Абакарова П.Р. Современные возможности диагностики и лечения ВПЧ-ассоциированных заболеваний гениталий. Медицинский совет. 2020;(3):107-113. https://doi.org/10.21518/2079-701X-2020-3-107-113.
- Lasek W., Janyst M., Wolny R., Zapała Ł., Bocian K., Drela N. Immunomodulatory effects of inosine pronabex on cytokine production by human lymphocytes. Acta Pharm. 2015;65(2):171-180. Available at: https://pubmed.ncbi.nlm.nih.gov/26011933.
- Majewska A., Lasek W., Janyst M., Młynarczyk G. In Vitro inhibition of HHV-1 Replication by inosine pronabex and interferon-α. Acta Pol Pharm. 2016;73(3):637-644. Available at: https://pubmed.ncbi.nlm.nih.gov/27476281.
- Косенко И.А., Костевич Г.В., Артемьева Т.П., Жук Е.Г., Василевский А.П., Серова Т.Н., Литвинова Т.М. К вопросу о патогенезе, диагностике и лечении вирус-ассоциированной патологии шейки матки. Медицинские новости. 2016;(2):7-18. Режим доступа: https://www.mednovosti.by/journal. aspx?article=7546.
- Давыдов А.И., Лебедев В.А., Шахламова М.Н. Гигантская кондилома Бушке - Левенштейна: выбор послеоперационной терапии. Вопросы гинекологии, акушерства и перинатологии. 2017;16(4):76-80 https://doi.org/10.20953/1726-1678-2017-4-76-80.
- Давыдов А.И., Шахламова М.Н. Лебедев В.А. Цервикальная интраэпителиальная неоплазия, ассоциированная с папилломавирусной инфекцией: патогенетическое обоснование лечения пациенток в репродуктивном периоде. Вопросы гинекологии, акушерства и перинатологии. 2018;17(3):66-72. https://doi.org/10.20953/1726-1678-2018-3-66-72.
- Адамян Л.В., Артымук Н.В., Ашрафян Л.А., Баранов И.И., Байрамова Г.Р., Белокриницкая Т.Е. и др. Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака: клинические рекомендации (протоколы диагностики и ведения больных). М.; 2017. 54 c. Режим доступа: http://rpc.karelia.ru/docs/FilePath_399.pdf.
- Полетаев А.Б. Физиологическая иммунология (естественные аутоантитела и проблемы наномедицины). М.: Миклош; 2015. 219 c.
Другие новости
В Великобритании оценят эффективность адалимумаба в терапии
personМирослава 18-10-24, 21:35Предварительные данные свидетельствуют, что пациенты с COVID-19, уже получающие ингибиторы ФНО для лечения других...
Утверждены условия страховых выплат медработникам,
personЛеонтий 18-10-24, 21:34Если это станет причиной временной нетрудоспособности, единовременная выплата страховой суммы составит 68 811 рублей....
Медики назвали оптимальное время для интима - «Гинекология»
personАнисим 20-03-23, 00:00Проведено соответствующее исследование. Сексуальная жизнь является важнейшей частью отношений в паре. Однако вопрос о...