Синдром сгущения желчи у новорожденных и детей раннего возраста. Факторы риска, терапия, прогноз. Разбор клинического случая - «Гастроэнтерология»
Журнал "Медицинский совет" №18/2020
DOI: 10.21518/2079-701X-2020-18-134-141
А.Н. Горяйнова1, Е.В. Беленович2, А.А. Худякова2,Ю.А. Бронникова2, Л.В. Чурилова2
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница им. З.А. Башляевой; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
Синдром сгущения желчи, или билиарный сладж, вызывающий обструкцию общего желчного протока и нарушение пассажа желчи в двенадцатиперстную кишку, занимает второе место среди «хирургических желтух» у новорожденных и детей раннего возраста. Ранняя диагностика синдрома необходима для своевременного проведения консервативной терапии, позволяющей избежать оперативного вмешательства и таких осложнений, как острый панкреатит, острый холецистит, желчнокаменная болезнь. К факторам риска синдрома сгущения желчи относятся недоношенность, экстремально низкая масса при рождении, длительное парентеральное питание, назначение диуретиков, цефалоспоринов III поколения. В случае угрозы билиарного сладжа показано проведение УЗИ органов брюшной полости в динамике и выявление характерных для этого синдрома признаков: дилатации общего желчного протока более 3 мм, наличие неоднородного осадка в желчном пузыре и общем желчном протоке. В статье дается клинический разбор случая синдрома сгущения желчи у девочки, родившейся с экстремально низкой массой и гестационным возрастом 29 нед. Состояние новорожденной при рождении очень тяжелое. Тяжесть состояния обусловлена синдромом дыхательных расстройств 1-го типа, сразу же интубирована, начата ИВЛ. В возрасте 1 мес. 10 дней девочка переведена из отделения реанимации и интенсивной терапии в отделение для новорожденных. По данным УЗИ желчный пузырь овальной формы, размерами 26 х 6 мм, объемом 0,5 мл, имеется лабильный перегиб в области тела и шейки, стенки утолщены до 2 мм, слоистые, повышенной эхогенности, в просвете гиперэхогенное содержимое (замазкообразная желчь), что позволило сделать вывод о наличии синдрома сгущения желчи. Сразу же после УЗИ назначена урсодезоксихолевая кислота 20 мг/кг/сут, спустя 10 дней доза препарата была увеличена до 30 мг/кг/сут. Спустя две недели ребенок был выписан домой в удовлетворительном состоянии без признаков синдрома сгущения желчи. Знание факторов риска билиарного сладжа позволяет своевременно назначить инструментальное обследование, обеспечить раннюю диагностику и назначение консервативной терапии, исключить хирургические методы лечения.
Для цитирования: Горяйнова А.Н., Беленович Е.В., Худякова А.А., Бронникова Ю.А., Чурилова Л.В. Синдром сгущения желчи у новорожденных и детей раннего возраста: факторы риска, терапия, прогноз. Разбор клинического случая. Медицинский Совет. 2020;(18):134-141. https://doi.org/10.21518/2079-701X-2020-18-134-141
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
Bile thickening syndrome in newborns and young children: risk factors, therapy, prognosis. А clinical case study
Aleksandra N. Goryaynova1, Elena V. Belenovich2, Anastasiya A. Khudyakova2,Yuliya A. Bronnikova2, Lyudmila V. Churilova2
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Bashlyaeva City Children’s Clinical Hospital; 28, Geroev Panfilovtsev St., Moscow, 125373, Russia
Children with chronic diseases, such as neurological, neuromuscular, respiratory, in particular cystic fibrosis, hereditary, metabolic, oncological, and congenital heart defects often suffer from malnutrition, often accompanied by stunted growth. The main reason leading to a change in nutritional status is inadequate intake of nutrients and energy with increased nutrient requirements or various eating problems. Lack of nutrient status correction and continued malnutrition contribute to major body changes that worsen disease progression, increase the risk of death and reduce patients’ quality of life. To fully cover the body’s nutrient needs, the use of specialized enteric nutrition is a priority. Sufficient clinical experience has been accumulated, confirming the high effectiveness of the use of enteral nutrition formulas in children with malnutrition through gastrointestinal feeding. It has been proved that this method of delivery of food is safe for patients, improves nutritional status, simplifies care, as well as reduces the duration of hospitalization, the frequency of respiratory and infectious complications and, consequently, the cost of treatment and rehabilitation. The article presents the assortment of “Nutriсia” formulas for enteral nutrition, which allows a differentiated approach to nutrition of patients depending on the clinical situation. Nutritional problems in patients with neurological disorders and ways of their correction are described in detail. The advantage of using domestic enteric nutrition through feeding tube for the correction of nutritional deficiencies. Timely assigned nutritional support is a highly effective method of correction of nutritional deficiencies or preventing their development in children with chronic diseases.
For citation: Goryaynova A.N., Belenovich E.V., Khudyakova A.A., Bronnikova Yu.A., Churilova L.V. Bile thickening syndrome in newborns and young children: risk factors, therapy, prognosis. А clinical case study. Meditsinskiy sovet = Medical Council. 2020;(18):134-141. (In Russ.) https://doi.org/10.21518/2079-701X-2020-18-134-141
Conflict of interest: the author declare no conflict of interest.
ВВЕДЕНИЕ
Синдром сгущения желчи – это экстрапеченочная обструкция билиарного тракта билиарным сладжем (слизистыми или желчными пробками) без признаков врожденной билиарной мальформации, без дефекта синтеза желчных кислот и без повреждения гепатоцитов [1]. Экстрапеченочные отделы билиарного тракта включают общий печеночный проток, общий желчный проток, пузырный проток и желчный пузырь. Как следует из определения синдрома сгущения желчи, для него не характерно развитие гепатоцитолиза и повышение гепатоспецифичного фермента аланинаминотрансферазы. Ведущим клиническим симптомом является появление ахоличного стула вследствие нарушения пассажа желчи в двенадцатиперстную кишку.
Синдром сгущения желчи (Inspissated bile syndrome, или синдром «грязной желчи») относится к редким причинам холестаза: у детей раннего возраста встречается в среднем в 1,36–6,2% всех вероятных причин конъюгированной (прямой) гипербилирубинемии [2, 3]. Среди основных вариантов «хирургических желтух» на долю синдрома сгущения желчи приходится 8,2% [4], лидирующее положение занимает билиарная атрезия (81,1%), третье место принадлежит аномалии развития общего желчного протока (7%). В подавляющем большинстве случаев синдром характерен для детей первых трех месяцев жизни, может развиваться без предрасполагающих факторов и существовать только как радиологический диагноз, когда УЗИ выявляет осадок в желчном пузыре и общем желчном протоке [3, 5].
ЭТИОЛОГИЯ, ПАТОГЕНЕЗ, ФАКТОРЫ РИСКА, ПРОГНОЗ
Считается, что билиарный сладж (синдром сгущения желчи) был впервые описан в 70-х гг. прошлого века благодаря появлению ультразвукового исследования [6]. Однако еще в 1916 г. были приведены примеры обструкции общего желчного протока пробками из густой, вязкой желчи [7]. Образование сладжа зависит от физико-химического взаимодействия компонентов желчи (сложного раствора с многими составляющими), нарушения функции слизистой желчного пузыря и его моторики [6, 8]. В состав сладжа в первую очередь входят кристаллы моногидрата холестерина и билирубината кальция, взвешенные (или преципитированные) в слизи желчного пузыря. Кроме основных компонентов, сладж может включать другие соли кальция, протеин-липидные комплексы, муцин и ксенобиотики, в частности цефтриаксон [8]. Цефтриаксон экскретируется в мочу, но значительное его количество (от 30 до 60%) экскретируется в желчь как бивалентный анион [9], и в желчном пузыре его концентрация повышается в 20–150 раз [10]. Подобно билирубину, цефтриаксон может выпадать в осадок в виде комплексного соединения «кальций + цефтриаксон». Среди пациентов, получавших цефтриаксон, образование билиарного сладжа отмечается в 25–46% случаев [11].
Синдром сгущения желчи может разрешиться спонтанно (в 48,1% случаев, по данным E. Fitzpatrick et al.) или на фоне терапии урсодезоксихолиевой кислотой (УДХК), в 6,6% случаев имеет место образование камней в общем желчном протоке или в желчном пузыре, около 4% детей требуют оперативного вмешательства [3]. Билиарный сладж может иметь такие осложнения, как билиарные колики, острый панкреатит, острый холецистит [6].
Ведущими факторами риска синдрома сгущения желчи в 47% случаев являются гемолиз, сепсис и недоношенность.
Однако, кроме них, играют роль следующие [5, 6, 12–19]:
Низкая масса при рождении
Парентеральное питание
Дегидратация (назначение диуретиков)
Гемотрансфузии
Кистозный фиброз
Врожденные заболевания сердца
Интракраниальные, интраабдоминальные и ретроперитонеальные кровоизлияния
Парез кишечника
Длительное голодание, быстрая потеря массы
Цефалоспорины III поколения (цефотаксим и цефтриаксон)
Терапия октреотидом
Трансплантация костного мозга или других органов
Среди перечисленных факторов риска особое место занимает парентеральное питание: доказано, что уже через 3 нед. полного парентерального питания билиарный сладж выявляется не менее чем у 6% пациентов, через 4–6 нед.– у 50%, после 6 нед. – у 100% [20].
МЕТОДЫ ДИАГНОСТИКИ БИЛИАРНОГО СЛАДЖА
Для подтверждения синдрома сгущения желчи или выявления его ранних признаков используются инструментальные методы, в первую очередь УЗИ. Основными признаками синдрома сгущения желчи являются умеренная дилатация интрапеченочных отделов билиарного тракта, увеличение диаметра общего желчного протока (иногда до 12,3 мм), густая вязкая желчь (осадок низкой эхогенности) в желчном пузыре и желчных протоках (рис. 1) [3, 5].
Рисунок 1. Синдром сгущения желчи. Дилатация общего желчного протока. Билиарный сладж в общем желчном протоке [21]
Figure 1. Bile thickening syndrome. Dilatation of the common bile duct. Biliary sludge in the common bile duct [21]
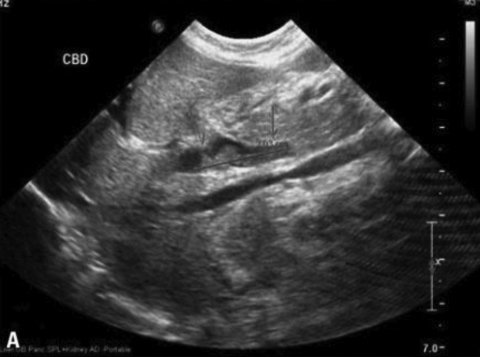
Диаметр общего желчного протока у детей первых 3 мес. жизни не должен превышать 1–1,2 мм. Как показали результаты УЗИ, проанализированных E. Fitzpatrick в 2010 г. у 878 детей первых трех месяцев жизни с холестазом, дилатация общего желчного протока более 1,2 мм (от 1,2 до 12,3 мм) была обнаружена в 9% случаев. На долю детей с синдромом сгущения желчи в этой группе приходилось 71,1%. Доказано, что дилатация общего желчного протока более 3 мм характерна для синдрома сгущения желчи (чувствительность 100% и специфичность 87%). Ниже мы приводим ультразвуковые признаки изменения желчи, полностью подтверждающие дословный перевод термина “Inspissated bile syndrome” – синдром «грязной желчи» (исследование проведено врачом отделения лучевой диагностики больницы им. З.А. Башляевой Ю.А. Бронниковой). На фотографиях с монитора (рис. 2А) видно, что содержимое желчного пузыря неоднородно, при внимательном осмотре обращает внимание осадок в области дна. Использование более чувствительного датчика и увеличение изображения на экране монитора (рис. 2B) позволяет более четко рассмотреть наличие осадка в желчном пузыре и подтвердить наличие синдрома сгущения желчи [22, 23].
Рисунок 2. УЗИ органов брюшной полости. Синдром сгущения желчи у девочки с врожденным пороком сердца
Figure 2. Abdominal ultrasound imaging. Bile thickening syndrome in a girl with congenital heart disease
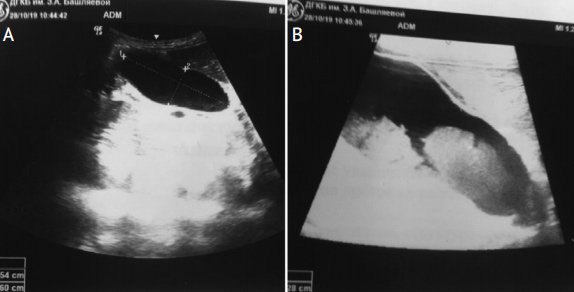
А – в области дна желчного пузыря и частично стенок взвесь со слабой эхогенностью; В – изображение выполнено с помощью более чувствительного датчика, хорошо определяется неоднородная взвесь в просвете желчного пузыря (выполнено Ю.А. Бронниковой, врачом отделения лучевой диагностики больницы им. З.А. Башляевой).
В диагностически трудных случаях для подтверждения синдрома сгущения желчи проводится магнитнорезонансная холангиография [1]. В пользу синдрома сгущения желчи свидетельствуют маленький желчный пузырь, диффузная дилатация интрапеченочных и экстрапеченочных желчных протоков, резкое сужение общего желчного протока после зоны дилатации (рис. 3).
Рисунок 3. Синдром сгущения желчи
Figure 3. Bile thickening syndrome
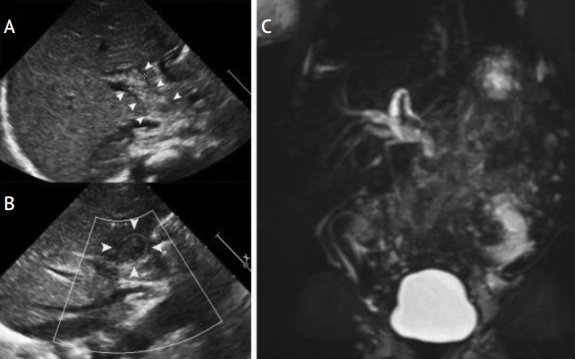
УЗИ (А, В): умеренная дилатация интрапеченочных желчных протоков, дилатированный общий желчный проток, заполненный неоднородной эхогенной массой. Магнитно-резонансная холангиография (С): маленький желчный пузырь, умеренная дилатация интра- и экстрапеченочных желчных протоков, внезапный обрыв общего желчного протока, отсутствие пассажа желчи в двенадцатиперстную кишку [1].
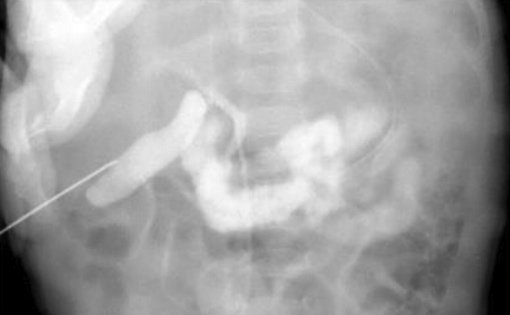
Для диагностики синдрома сгущения желчи используется также и интраоперативная холангиография через пунктированный желчный пузырь, позволяющая выявить полную обструкцию общего желчного протока с дилатацией пузырного протока и печеночного протока (рис. 4).
Рисунок 4. Синдром сгущения желчи. Чрескожная холецистохолангиография через пунктированный желчный пузырь. Дилатация и обрыв общего желчного протока и умеренная дилатация интрапеченочных желчных протоков [24, 25]
Figure 4. Bile thickening syndrome. Percutaneous cholecystocholangiography via a gallbladder puncture. Dilatation and rupture of the common bile duct and moderate dilatation of the intrahepatic bile ducts [24, 25]
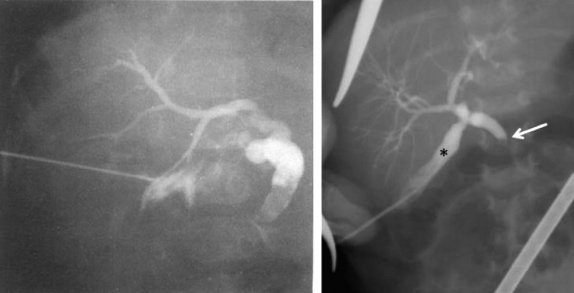
Терапия синдрома сгущения желчи у детей раннего возраста включает хирургические и консервативные методы. В оперативном лечении, позволяющем восстановить пассаж желчи в двенадцатиперстную кишку, нуждаются менее 4% детей с синдромом сгущения желчи (рис. 4). Исторически первым хирургическим вмешательством была лапаротомия с последующей ирригацией через доступ в общий желчный проток или желчный пузырь, выполненная W.E. Ladd в 1935 г. [7, 26].
В настоящее время существуют два основных варианта оперативного лечения билиарного сладжа: открытый хирургический дренаж с последующим лаважем желчных протоков физиологическим раствором и урсодезоксихолевой кислотой (УДХК) и чрескожная пункция желчного пузыря под контролем УЗИ с проведением холецистографии и дренированием желчных протоков [1, 4, 13, 21, 25–30]. С целью предупреждения утечки желчи нередко используется чрескожная транспеченочная пункция желчного пузыря [13, 21, 26, 30]
Показаниями для консультации хирургом и решения вопроса об оперативном лечении ребенка с синдромом сгущения желчи являются:
Дилатация общего желчного протока более 3 мм [1, 3]
Персистирующая желтуха и изменения в биохимическом анализе крови: нарастание уровня ферментов АЛТ и АСТ, щелочной фосфатазы, общего и прямого билирубина, ГГТП [1, 25]
Отсутствие эффекта от проводимой консервативной терапии
Оперативное лечение позволяет полностью восстановить пассаж желчи в двенадцатиперстную кишку (рис. 5).
Рисунок 5. Полное восстановление пассажа желчи в двенадцатиперстную кишку после успешного оперативного лечения билиарного сладжа: изменение окраски стула в течение 5 дней [25]
Figure 5. Complete restoration of the bile passage into the duodenum after successful surgical treatment of biliary sludge: stool discoloration within 5 days [25]

Недостатками оперативного вмешательства являются осложнения и необходимость длительного доступа (в среднем 26 дней) к желчным протокам для их дренирования и лаважа [13]. Одним из частых осложнений (до 50% случаев) считается смещение катетера, требующее его переустановки [13], кроме этого, возможны кровотечения, билиарный перитонит и другие инфекции [26].
Консервативная терапия синдрома сгущения желчи у новорожденных и детей раннего возраста. Принципы консервативной терапии синдрома сгущения желчи в первую очередь включают анализ проводимой медикаментозной терапии и исключение из нее средств, способных вызвать сгущение желчи. Новорожденным, находящимся на искусственном вскармливании, рекомендуется назначение адаптированных смесей, обогащенных среднецепочечными триглицеридами. Обязательным является назначение УДХК 20–30 мг/кг/сут, жирорастворимых витаминов (табл. 1) [6, 19, 24].
Таблица 1. Дозы жирорастворимых витаминов у новорожденных и детей раннего возраста c холестазом (C. Dani et al., 2015 г.) [31]
Table 1. Doses of fat-soluble vitamins in newborns and young children with cholestasis (C. Dani et al., 2015) [31]
A | 5000–25000 ед/сут |
D | 800–5000 ед/сут |
E | 15–25 ед/кг/сут |
K | 2,5–5 мг дважды в неделю, возможен ежедневный прием |
В качестве альтернативы инвазивному хирургическому вмешательству рекомендуется использование полиненасыщенных жирных кислот (рис. 6), например 20%-ной жировой эмульсии для парентерального питания SMOFlipid [32]. В 1000 мл SMOFlipid содержится 60 г очищенного масла соевых бобов, 60 г среднецепочечных триглицеридов, 50 г очищенного оливкового масла, 30 г рыбьего жира, обогащенного омега-3 полиненасыщенными жирными кислотами (α-линоленовой, эйкозапентаеновой и докозагексаеновой).
Теоретическая осмолярность эмульсии составляет 380 мосм/кг, биоусвояемость – 100%, по размерам частиц и биологическим свойствам SMOFlipid идентична эндогенным хиломикронам. Каждые 200 г жира в литре 20%-ной эмульсии SMOFlipid содержат 0,6 г α-линоленовой, 0,6 г эйкозапентаеновой и 0,1 г докозагексаеновой кислот. W.Y. Jun et al. [32] рекомендуют одновременное назначение УДХК 20 мг/кг/сут и жировой эмульсии 1,5 г/кг/сут в течение 3 нед. Скорость внутривенного введения жировой эмульсии 1 мл/ч [32].
Рисунок 6. Пассаж желчи в двенадцатиперстную кишку после 3-недельной консервативной терапии УДХК и 20%-ной жировой эмульсией SMOFlipid [32]
Figure 6. Bile passage into the duodenum after 3 weeks of conservative therapy with UDCA and SMOFlipid 20% lipid emulsion [32]
Полиненасыщенные жирные кислоты могут назначаться внутрь в капсулах (препарат Omacor, W.Y. Jun et al.) как замена внутривенному введению жировой эмульсии. Каждая капсула Omacor содержит 460 мг этилового эфира эйкозапентаеновой и 380 мг этилового эфира докозагексаеновой кислоты. Согласно рекомендациям [32], новорожденным и детям раннего возраста с синдромом сгущения желчи рекомендуется по ½ капсулы Omacor 4 раза в день в течение 3–4 мес. Авторы исследования [32] считают, что омега-3 полиненасыщенные жирные кислоты могут играть роль холеретиков. Механизм действия полиненасыщенных жирных кислот включает улучшение клиренса липидов, индукцию окисления печеночных жирных кислот, модуляцию воспаления и метаболизм желчных кислот [33–35].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Девочка Г. родилась на 29-й нед. гестации с массой 900,0 г и оценкой по шкале Апгар 3/5 баллов. Неонатальный и кардиоскрининг отрицательные, группа крови 0(I) первая, Rh (+), фенотип CcDEe, Kell отрицательный.
Матери ребенка 23 года, беременность первая, протекавшая с токсикозом в первом триместре и гестозом. Роды оперативные (экстренное кесарево сечение из-за нарастающей гипоксии плода), в ягодичном предлежании. Околоплодные воды светлые. Группа крови матери 0(I), Rh (+). Во время беременности у матери ребенка выявлен высокий титр антител класса IgG к токсоплазме и CMV.
Состояние новорожденной при рождении очень тяжелое. Тяжесть состояния обусловлена синдромом дыхательных расстройств 1-го типа, сразу же интубирована, начата ИВЛ. Спустя 6 мин. после начала ИВЛ переведена в отделение реанимации и интенсивной терапии. Там эндотрахеально введен сурфактант. На 6-е сут. жизни была переведена на осциллаторную ИВЛ, на которой находилась до 23 сут. жизни. В отделении реанимации отмечалось однократное повышение СРБ до 220,9 мг/л, постоянно регистрировалось повышение щелочной фосфатазы (от 871 до 1500 ед/л), АлАт и АсАт были в пределах нормы.
В возрасте 1 мес. 10 дней девочка переведена из отделения реанимации и интенсивной терапии в отделение для новорожденных №2 ДГКБ им. З.А. Башляевой в состоянии средней степени тяжести с диагнозом «Недоношенность 29 нед. Постконцептуальный возраст 35–36 нед. Бронхолегочная дисплазия, новая форма, среднетяжелое течение. ДН 0–1-й степени. Гипоксическиишемическое поражение ЦНС I–II степени, синдром угнетения безусловно-рефлекторной деятельности, синдром вегетовисцеральной дисфункции. Врожденная пневмония, реконвалесцент. Функционирующие фетальные коммуникации: открытый артериальный проток. Открытое овальное окно. НК-0. Анемия недоношенных. Неонатальная тромбоцитопения. Транзиторная неонатальная гипогликемия».
Вес при поступлении в отделение 2000,0 г. Кожные покровы розовые, стул окрашен.
Терапия в отделении для новорожденных больницы им. З.А. Башляевой
- Лечебно-охранительный режим (находится в условиях термокроватки)
- Энтеральное кормление(соска/зонд) каждые 3 ч по 45–50 мл сцеженным грудным молоком, докорм смесью «ПреНАН»
- Элькар 30% по 5 капель 3 раза в сутки per os
- Витамин Д3 по 2 капли (1000 МЕ) х 1 раз в сутки. Мальтофер 5 мг/кг/сут (4 капли х 1 раз в сутки)
- Витамин Е 10% 2 капли х 1 раз в сутки
- Фолиевая кислота50 мкг х 1 раз в сутки
В больнице им. З.А. Башляевой состояние средней тяжести, назначенный объем питания усваивает, кожные покровы розовые, стул окрашен. Однако, учитывая наличия факторов риска синдрома сгущения желчи (экстремально низкая масса при рождении, гестационный возраст 29 нед.) и имеющиеся ранее в отделении реанимации признаки холестаза (постоянное повышение щелочной фосфатазы), для исключения билиарного сладжа на 11-й день госпитализации проведено УЗИ органов брюшной полости.
По данным УЗИ желчный пузырь овальной формы, размером 26 х 6 мм, объемом 0,5 мл. Имеется лабильный перегиб в области тела и шейки, стенки утолщены до 2 мм, слоистые, повышенной эхогенности, в просвете гиперэхогенное содержимое (замазкообразная желчь). Наличие замазкообразной желчи позволило сделать вывод о наличии синдрома сгущения желчи. Сразу же после УЗИ назначена урсодезоксихолевая кислота (УДХК) 20 мг/кг/сут. В этот же день взята кровь для проведения биохимического анализа крови. В биохимическом анализе крови выявлено незначительное повышение уровня общего билирубина и щелочной фосфатазы (табл. 2). Оставлена назначенная доза УДХК (20 мг/кг/сут).
Таблица 2. Биохимический анализ крови на 11-й день госпитализации
Table 2. Biochemical blood test on Day 11 of hospitalization
Общий билирубин | 27 мкмоль/л | 1,7–21 |
Прямой билирубин | 5 мкмоль/л | 0–5 |
АсАт | 36 ед/л | 0–35 |
АлАт | 15 ед/л | 0–45 |
ЛДГ | 576 ед/л | 0–430 |
Щелочная фосфатаза | 788 ед/л | 0–727 |
Глюкоза | 5,3 ммоль/л | 1,9–5,5 |
ГГТП | 179 ед/д | 0–200 |
СРБ | 9 мг/л | 0–10 |
Спустя 10 дней от начала терапии УДХК на 21-й день госпитализации ребенка в больницу им. З.А. Башляевой повторно проведено УЗИ органов брюшной полости.
Результаты повторного УЗИ
Желчный пузырь овальной формы, размерами 30 х 5 мм, объемом 0,4 мл. Имеется лабильный перегиб в области тела и шейки. Стенки неравномерной толщины, максимум до 1,5 мм, повышенной эхогенности, в просвете желчного пузыря гиперэхогенные включения до 3 мм в диаметре, без акустической дорожки, контуры неровные, нечеткие (замазкообразная желчь). Общий желчный проток диаметром до 5 мм, прослеживается на расстоянии до 20 мм, стенки неровные, нечеткие, просвет гипоэхогенный.
Полученные результаты (наличие в просвете желчного пузыря гиперэхогенных включений без акустической дорожки с нечеткими контурами, увеличение диаметра общего желчного протока до 5 мм) позволили подтвердить наличие синдрома сгущения желчи. Следует обратить внимание, что окраска стула в день повторного проведения УЗИ была обычной, но, учитывая отрицательную динамику по данным УЗИ, в этот же день доза УДХК была увеличена до 30 мг/кг/сут.
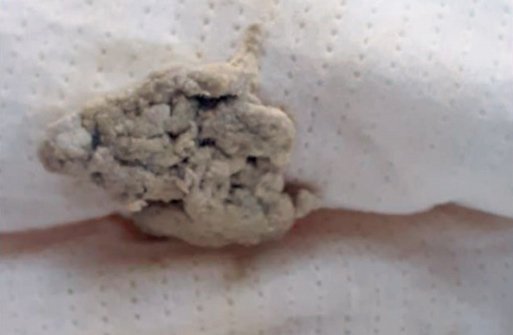
На следующий день после проведения УЗИ и увеличения дозы УДХК у ребенка появился ахоличный стул (рис. 7). В этот же день был взят биохимический анализ крови (табл. 3).
Таблица 3. Биохимический анализ крови на 21-й день госпитализации
Table 3. Biochemical blood test on Day 21 of hospitalization
Общий билирубин | 46 мкмоль/л | 1,7–21 |
Прямой билирубин | 21 мкмоль/л | 0–5 |
АсАт | 50 ед/л | 0–35 |
АлАт | 21 ед/л | 0–45 |
ЛДГ | 608 ед/л | 0–430 |
Щелочная фосфатаза | 744 ед/л | 0–727 |
Глюкоза | 4,6 ммоль/л | 1,9–5,5 |
ГГТП | 189 ед/д | 0–200 |
СРБ | 37,7 мг/л | 0–10 |
В биохимическом анализе крови выявлена отрицательная динамика: конъюгированная гипербилирубинемия (общий билирубин 46 мкмоль/л, прямой билирубин 31 мкмоль/л), сохранялось повышение щелочной фосфатазы. В связи с появлением ахоличного стула, увеличением диаметра общего желчного протока более 3 мм (в нашем случае до 5 мм), нарастанием холестаза, несмотря на проводимую терапию УДХК, девочка была осмотрена детским хирургом для решения вопроса о необходимости оперативного лечения.
Рисунок 7. Ахоличный стул у девочки 2 мес. с синдромом сгущения желчи
Figure 7. Acholic stool in a 2-month-old girl with bile thickening syndrome
Учитывая отсутствие синдрома гепатоцитолиза, незначительное повышение общего билирубина, снижение щелочной фосфатазы по сравнению с предыдущим анализом и нормальный уровень ГГТП, было принято решение о продолжении консервативной терапии (УДХК) и наблюдении за ребенком в динамике. На второй день после увеличения дозы УДХК появилось окрашивание стула, на третий день окраска стала более интенсивной.
Терапия УДХК была продолжена в дозе 30 мг/кг/сут. Спустя две недели ребенок был выписан домой в удовлетворительном состоянии без признаков синдрома сгущения желчи. Представленный клинический случай демонстрирует раннюю диагностику синдрома сгущения желчи и его благоприятный исход у 2-месячного ребенка на фоне терапии УДХК без оперативного вмешательства.
ЗАКЛЮЧЕНИЕ
Синдром сгущения желчи относится к редким причинам холестаза у новорожденных и детей раннего возраста, в некоторых случаях требующим оперативного вмешательства. Знание факторов риска билиарного сладжа позволяет своевременно назначить инструментальное обследование, в первую очередь УЗИ, обеспечить раннюю диагностику синдрома сгущения желчи и назначение консервативной терапии, исключить хирургические методы лечения.
Список литературы / References
- G1. Chen S.M., Liao Y.Y., Lin C.P. Inspissated bile syndrome: A rare cause of neonatal cholestasis. Pediatr Neonatol. 2020;61(4):449-450. https://doi.org/10.1016/j.pedneo.2020.03.002.
- Gottesman L.E., Del Vecchio M.T., Aronoff S.C. Etiologies of conjugated hyperbilirubinemia in infancy: a systematic review of 1692 subjects. BMC Pediatrics. 2015;15:192. https://doi.org/10.1186/s12887-015-0506-5.
- Fitzpatrick F., Jardine R., Farrant P., Karani J., Davenport M., Mieli-Vergani G., Baker A. Predictive Value of Bile Duct Dimensions Measured by Ultrasound in Neonates Presenting With Cholestasis. J Pediatr Gastroenterol Nutr. 2010;51(1):55-60. https://doi.org/10.1097/MPG.0b013e3181d1b226.
- Davenport M., Betalli P., D’Antiga L., Cheeseman P., Mieli-Vergani G., Howard E.R. The spectrum of surgical jaundice in infancy. J Pediatr Surg. 2003;38(10):1471-1479. https://doi.org/10.1016/s0022-3468(03)00498-6.
- Gubernick J.A., Rosenberg H.K., Ilaslan H., Kessler A. US approach to jaundice in infants and children. Radiographics. 2000;20(1):173-195. https://doi.org/10.1148/radiographics.20.1.g00ja25173.
- Ko C.W., Sekijim J.H., Lee S.P. Biliary sludge. Ann Intern Med. 1999; 130(4 Pt. 1):301-311. https://doi.org/10.7326/0003-4819-130-4-199902160-00016.
- Ladd W.E. Congenital obstruction of the bile ducts. Annals of Surgery. 1935;102(4):742-751. https://doi.org/10.1097/00000658-193510000-00021.
- Ko C.W., Murakami C., Sekijima J.H., Kim M.H., McDonald G.B., Lee S.P. Chemical composition of gallbladder sludge in patients after marrow transplantation. Am J Gastroenterol. 1996;91(6):1207-1210. Available at: https://pubmed.ncbi.nlm.nih.gov/8651172.
- Kim Y.S., Kestell M.F., Lee SP. Gall-bladder sludge: lessons from ceftriaxone. J Gastroenterol Hepatol. 1992;7(6):618-621. https://doi.org/10.1111/j.1440-1746.1992.tb01496.x.
- Park H.Z., Lee S.P., Schy A.L. Ceftriaxone-associated gallbladder sludge. Identification of calcium-ceftriaxone salt as a major component of gallbladder precipitate. Gastroenterology. 1991;100(6):1665-1670. https://doi.org/10.1016/0016-5085(91)90667-A.
- Shiffman M.L., Keith F.B., Moore E.W. Pathogenesis of ceftriaxone-associated biliary sludge. in vitro studies of calcium-ceftriaxone binding and solubility. Gastroenterology. 1990;99(6):1772-1778. https://doi.org/10.1016/0016-5085(90)90486-k.
- Володин Н.Н., Мухина Ю.Г., Чубарова А.И. (ред.). Неонатология. В: Володин Н.Н., Мухина Ю.Г. (ред.). Детские болезни. М.: Династия; 2011. Т. 1. 512 с.
- Bollu B.K., Dawrant M.J., Thacker K., Thomas G., Chenapragadda M., Gaskin K., Shun A. Inspissated bile syndrome; Safe and effective minimally invasive treatment with percutaneous cholecystostomy in neonates and infants. J Pediatr Surg. 2016;51(12):2119-2122. https://doi.org/10.1016/j.jpedsurg.2016.09.053.
- Miloh T., Rosenberg H.K., Kochin I., Kerkar N. Inspissated bile syndrome in a neonate treated with cefotaxime: sonographic aid to diagnosis, management, and follow-up. J Ultrasound Med. 2009;28(4):541-544. https://doi.org/10.7863/jum.2009.28.4.541.
- Rozmanic V., Banac S., Ivosevic D., Cace N. Biliary colic and sonographic evidence of pseudocholelithiasos 36 h after treatment with ceftriaxone. J Paediatr Child Health. 2006;42(10):658-661. Available at: https://www.researchgate.net/publication/6818041_Biliary_colic_and_sonographic_evidence_of_pseudocholelithiasos_36_h_after_treatment_with_ceftriaxone.
- Schaad U.B., Tschäppeler H., Lentze M.J. Transient formation of precipitations in the gallbladder associated with ceftriaxone therapy. Pediatr Infect Dis. 1986;5(6):708-710. https://doi.org/10.1097/00006454-198611000-00026.
- Bor O., Dinleyici E.C., Kebapci M., Aydogdu S.D. Ceftriaxone-associated biliary sludge and pseudocholelithiasis during childhood: a prospective study. Pediatr Int. 2004;46(3):322-344. https://doi.org/10.1111/j.1328-0867.2004.01884.x.
- Klar A., Branski D., Akerman Y., Nadjari M., Berkun Y., Moise J. et al. Sludge ball, pseudolithiasis, cholelithiasis and choledocholithiasis from intrauterine life to 2 years: a 13-year follow- up. J Pediatr Gastroenterol Nutr. 2005;40(4):477-480. https://doi.org/10.1097/01.mpg.0000151749.01631.21.
- Jain A., Poddar U., Elhence P., Tripathi A., Shava U., Yachha S.K. Cholestasis in a neonate with ABO haemolytic disease of newborn following transfusion of ABO group-specific red cells compatible with neonatal serum: inspissated bile syndrome. Blood Transfus. 2014;12(4):621-623. https://doi.org/10.2450/2014.0099-14.
- Messing B., Bories C., Kuntslinger F., Bernier J.J. Does total parenteral nutrition induce gallbladder sludge formation and lithiasis? Gastroenterology. 1983;84(5 Pt. 1):1012-1019. Available at: https://pubmed.ncbi.nlm.nih.gov/6403401.
- Chang S.H., Joo S.M., Yoon C.S., Lee K.H., Lee S.M. Percutaneous Transhepatic Biliary Drainage in a Two-Month-Old Infant with Inspissated Bile Syndrome. Yonsei Med J. 2018;59(7):904-907. https://doi.org/10.3349/ymj.2018.59.7.904.
- Hernanz-Schulman M., Ambrosino M.M., Freeman P.C., Quinn C.B. Common bile duct in children: sonographic dimensions. Radiology. 1995;195(1):193-195. https://doi.org/10.1148/radiology.195.1.7892467.
- Carroll B.A., Oppenheimer D.A., Muller H.H. High-frequency real-time ultrasound of the neonatal biliary system. Radiology. 1982;145(2):437-440. https://doi.org/10.1148/radiology.145.2.7134449.
- Heaton N.D., Davenport M., Howard E.R. Intraluminal biliary obstruction. Arch Dis Child. 1991;66(12):1395-1398. https://doi.org/10.1136/adc.66.12.1395.
- Berger S., Schibli S., Stranzinger E., Cholewa D. One-stage laparoscopic surgery for inspissated bile syndrome: case report and review of surgical techniques. Springerplus. 2013;2:648. https://doi.org/10.1186/2193-1801-2-648.
- Sideeka N, Shaikh R, Chaudry G. Single Procedure Saline Lavage for Treatment of Inspissated Bile. Case Rep Radiol. 2020;2020:8816599. https://doi.org/10.1155/2020/8816599.
- Gunnarsdóttir A, Holmqvist P, Arnbjörnsson E, Kullendorff CM. Laparoscopic aided cholecystostomy as a treatment of inspissated bile syndrome. J Pediatr Surg. 2008;43(4):e33-e55. https://doi.org/10.1016/j.jpedsurg.2007.12.068.
- Gao Z.G., Shao M., Xiong Q.X., Tou J.F., Liu W.G. Laparoscopic cholecystostomy and bile duct lavage for treatment of inspissated bile syndrome: a single-center experience. World J Pediatr. 2011;7(3):269-271. https://doi.org/10.1007/s12519-011-0321-5.
- Lieber J., Piersma F.E., Sturm E. et al. Surgical treatment of inspissated bile syndrome using a 2-stage pure laparoscopic approach: a case report. J Pediatr Surg. 2012; 47(12):e47-50. https://doi.org/10.1016/j.jpedsurg.2012.09.043.
- Helin R., Bhat R., Rao B. Ultrasound-guided percutaneous cholecystostomy for acute neonatal biliary obstruction. Neonatology. 2007;91(4):266-270. https://doi.org/10.1159/000098174.
- Dani C., Pratesi S., Raimondi F., Romagnoli C. Italian guidelines for the management and treatment of neonatal cholestasis. Ital J Pediatr. 2015;:41:69. https://doi.org/10.1186/s13052-015-0178-7.
- Jun W.Y., Cho M.J., Han H.S., Bae S.H. Use of Omega-3 Polyunsaturated Fatty Acids to Treat Inspissated Bile Syndrome: A Case Report. Pediatr Gastroenterol Hepatol Nutr. 2016;19(4):286-290. https://doi.org/10.5223/pghn.2016.19.4.286.
- Jonkers I.J., Smelt A.H., Princen H.M., Kuipers F., Romijn J.A., Boverhof R. et al. Fish oil increases bile acid synthesis in male patients with hypertriglyceridemia. J Nutr. 2006;136(4):987-991. https://doi.org/10.1093/jn/136.4.987.
- Bae S.H., Park H.S., Han H.S., Yun I.J. Omega-3 polyunsaturated fatty acid for cholestasis due to bile duct paucity. Pediatr Gastroenterol Hepatol Nutr. 2014;17(2):121-124. https://doi.org/10.5223/pghn.2014.17.2.121.
- Nandivada P., Carlson S.J., Chang M.I., Cowan E., Gura K.M., Puder M. Treatment of parenteral nutrition-associated liver disease: the role of lipid emulsions. Adv Nutr. 2013;4(6):711-717. https://doi.org/10.3945/an.113.004770.
Другие новости
«Магнит» запустил онлайн-аптеку - «Гастроэнтерология»
personГлеб 18-10-24, 21:33Вопросы профилактики и лечения остеопороза у детей являются актуальной проблемой педиатрии......
Novartis опровергла информацию СМИ о ситуации вокруг
personНиколай 18-10-24, 21:37В компании отметили, что ранее опубликованная в СМИ информация не соответствует текущему положению дел....
Двенадцать представителей ГК «Протек» вошли в ТОП-1000
personСидор 28-09-23, 00:00Е.П. Панченко; Национальный медицинский исследовательский центр кардиологии имени......






