COVID-19-ассоциированная флебопатия как актуальная проблема современной флебологии - «Аллергология»
Журнал "Амбулаторная хирургия" №2/2022
DOI: 10.21518/1995-1477-2022-19-2
В.Ю. Богачев1,2, https://orcid.org/0000-0002-3940-0787
Б.В. Болдин1, https://orcid.org/0000-0003-4488-9123
П.Ю. Туркин1,2, https://orcid.org/0000-0002-6262-4770
О.В. Дженина2, https://orcid.org/0000-0003-3811-5156
1 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; 117997, Россия, Москва, ул. Островитянова, д. 1
2 Первый флебологический центр; 117447, Россия, Москва, ул. Дмитрия Ульянова, д. 31
Введение. SARS-CoV-2 сопровождается развитием дисфункции венозного эндотелия, которая может привести к развитию персистирующей флебопатии нижних конечностей, снижающей качество жизни пациентов.
Цель. Оценить эффективность фармакологической терапии пациентов с постковидной флебопатией.
Материалы и методы. 178 пациентов (125 женщин), средний возраст 34,8 ± 3,2 года, перенесшие SARS-CoV-2, по поводу впервые возникших веноспецифических жалоб получали микронизированную очищенную флавоноидную фракцию (МОФФ) 1 000 мг в сутки в течение 90 дней. Мониторинг жалоб осуществляли с помощью 10-сантиметровой визуальной аналоговой шкалы и опросника CIVIQ-20. Всем пациентам было выполнено ультразвуковое обследование венозной системы обеих нижних конечностей и фотоплетизмография. 30 больным до и после лечения проведено лабораторное биохимическое исследование с определением уровней маркеров эндотелиальной дисфункции.
Результаты. Через 90 дней флеботропной терапии отмечено значимое уменьшение выраженности всех веноспецифических жалоб, за исключением расширения внутрикожных вен. Глобальный индекс качества жизни повысился с 64,4 ± 11,2 до 86,6 ± 9,1% (p < 0,001). Отмечено улучшение показателей фотоплетизмографии (ФПГ). Время возвратного кровенаполнения и сила мышечно-венозной помпы голени значимо (p < 0,05) увеличились, соответственно, на 4,3 сек и 3,5%. У 30 пациентов, которым было проведено биохимическое исследование в первых образцах крови, полученных из большой подкожной вены, обнаружено существенное увеличение концентрации IL-1 (7,8 ± 0,7 пг/мл), IL-6 (18,7 ± 1,8 пг/мл), VEGF (187,8 ± 11,6 пг/мл), TNF (7,8 ± 0,9 пг/мл), гистамина (22,4 ± 11,4 нмоль/л) и hsСРБ (5,4 ± 0,3 мг/л), что свидетельствует о формировании провоспалительного фенотипа венозного эндотелия. Через 90 дней приема МОФФ эти показатели значимо уменьшились. Уровни IL-1 и IL-6 снизились на 3,2 и 10,4 пг/мл соответственно, значения VEGF и TNF упали на 114,6 пг/мл и 2,9 пг/мл. Отмечена постепенная нормализация показателей гистамина и hsСРБ до 6,1 ± 4,1 нмоль/л и 1,1 ± 0,9 мг/л.
Выводы. Полученные данные свидетельствуют, что появление веноспецифических симптомов и синдромов у пациентов, перенесших SARS-CoV-2, может быть обусловлено развитием флебопатии, коррекция которой требует применения фармакологических препаратов с актуальными механизмами действия.
Благодарности. Авторы благодарят руководителя лаборатории «АрхиМед» И.Н. Малышеву и ее сотрудников за помощь в проведении лабораторных исследований.
Для цитирования: Богачев В.Ю., Болдин Б.В., Туркин П.Ю., Дженина О.В. COVID-19-ассоциированная флебопатия как актуальная проблема современной флебологии. Амбулаторная хирургия. 2022;19(2):13-20. https://doi.org/10.21518/1995-1477-2022-19-2
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
COVID- 19-associated phlebopathy as a current problem of modern phlebology
Vadim Yu. Bogachev1,2, https://orcid.org/0000-0002-3940-0787
Boris V. Boldin1, https://orcid.org/0000-0003-4488-9123
Pavel Yu. Turkin1,2, https://orcid.org/0000-0002-6262-4770
Olga V. Dzhenina2, https://orcid.org/0000-0003-3811-5156
1 Pirogov Russian National Research Medical University; 1, Ostrovityanov St., Moscow, 117997, Russia
2 First Phlebological Center; 31, Dmitry Ulyanov St., Moscow, 117447, Russia
Introduction. SARS-CoV-2 is accompanied by the development of venous endothelial dysfunction, which can lead to the development of persistent phlebopathy of the lower limbs, reducing the quality of life of patients.
Objective. To evaluate the efficacy of pharmacological therapy in patients with postcocclusive phlebopathy.
Materials and methods. 178 patients (125 women), mean age 34.8 ± 3.2 years, who underwent SARS-CoV-2, for their first veno-specific complaints received micronized purified flavonoid fraction (MPFF) 1,000 mg per day for 90 days. Complaints were monitored using a 10-cm visual analog scale and the CIVIQ-20 questionnaire. All patients underwent ultrasound examination of the venous system of both lower extremities and photoplethysmography. Laboratory biochemical examination with determination of endothelial dysfunction marker levels was performed in 30 patients before and after treatment.
Results. After 90 days of phlebotropic therapy, there was a significant reduction in the severity of all venous- specific complaints, except for intradermal vein dilation. The global quality of life index increased from 64.4 ± 11.2 to 86.6 ± 9.1% (p < 0.001). There was an improvement in photoplethysmography (PPG) scores. Return blood-flow time and tibial venous muscle pump strength increased significantly (p < 0.05) by 4.3 s and 3.5%, respectively. The 30 patients who underwent biochemical examination in the first blood samples obtained from the great saphenous vein showed a significant increase in IL-1 concentration (7.8 ± 0, 7 pg/ml), IL-6 (18.7 ± 1.8 pg/ml), VEGF (187.8 ± 11.6 pg/ml), TNF (7.8 ± 0.9 pg/ml), histamine (22.4 ± 11.4 nmol/L) and hsCRB (5.4 ± 0.3 mg/L), indicating that a proinflammatory phenotype of venous endothelium was formed. After 90 days of MOFF administration, these indices significantly decreased. The levels of IL-1 and IL-6 decreased by 3.2 and 10.4 pg/ml, respectively, the values of VEGF and TNF decreased by 114.6 pg/ml and 2.9 pg/ml. There was a gradual normalization of histamine and hsCRB to 6.1 ± 4.1 nmol/L and 1.1 ± 0.9 mg/L.
Conclusions. The data obtained indicate that the appearance of veno-specific symptoms and syndromes in patients who have undergone SARS-CoV-2 may be due to the development of phlebopathy, the correction of which requires the use of pharmacological drugs with relevant mechanisms of action.
Acknowledgments. The authors would like to thank I.N. Malysheva, head of the ArchiMed laboratory, and her staff for their assistance in the laboratory tests.
For citation: Bogachev V.Yu., Boldin B.V., Turkin P.Yu., Dzhenina O.V. COVID-19-associated phlebopathy as a current problem of modern phlebology. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2022;19(2):13-20. (In Russ.) https://doi.org/10.21518/1995-1477-2022-19-2
Conflict of interest: the authors declare no conflict of interest.
Введение
Функциональные нарушения венозного оттока, известные как флебопатии, представляют собой большую и весьма разнородную с точки зрения патогенеза нозологическую группу, относящуюся к C0s-клиническому классу международной классификации CEAP, встречаемость которого во взрослой популяции варьирует от 13 до 31% [1, 2]. Как следует из названия, флебопатии представляют собой функциональные расстройства венозного оттока, связанные с нарушением упруго-эластических свойств венозной стенки, но без ее патоморфологической перестройки. Принципиальной особенностью флебопатий служит обратимость патологического процесса на фоне адекватного лечения и устранения провоцирующих факторов. Наиболее хорошо изучены гипотоническая и гормоноиндуцированная форма флебопатий [3–7]. Вместе с тем существуют и другие, менее известные их разновидности, такие как метаболическая, гиподинамическая и др. [8]. В последние годы большой интерес привлекают последствия новой коронавирусной инфекции, которые затрагивают различные органы и системы, в т. ч. и сосудистое русло [9, 10]. Многочисленные исследования свидетельствуют, что в результате т. н. цитокинового шторма в острой фазе COVID-19 развивается эндотелиальная дисфункция, которая проявляется широким спектром различных симптомов и синдромов, в т. ч. и со стороны венозной системы нижних конечностей, которые могут персистировать длительное время уже после элиминации вируса [11, 12]. В связи с этим разработаны различные программы постковидной реабилитации, направленные на восстановление нормальной функции жизненно важных органов и систем [13–15]. В данной публикации мы представляем наш опыт по диагностике и лечению последствий новой коронавирусной инфекции для венозной системы нижних конечностей, которые можно объединить термином постковидная флебопатия.
Цель. Оценить эффективность фармакологической терапии пациентов с постковидной флебопатией.
Материалы и методы
Под нашим наблюдением с 2019 по 2022 г. находилось 178 пациентов (125 женщин) в возрасте от 25 до 55 лет (средний возраст 34,8 ± 3,2 года), перенесших новую коронавирусную инфекцию легкого и среднетяжелого течения. Во всех случаях диагноз был верифицирован на основании ПЦР, результатов компьютерной томографии и иммунологических тестов. Срок обращения в наш центр после перенесенного COVID-19 колебался от 6 до 12 мес. (8,4 ± 2,3 мес.), а основным поводом явились ранее отсутствовавшие жалобы на периодически возникающее чувство тяжести в икроножных мышцах, снижение толерантности к статическим нагрузкам, вечерние отеки голеней, усиление поверхностного венозного рисунка, а также внезапное появление большого количества ретикулярных вен и телеангиэктазов. Все пациенты отметили прямую причинно-следственную связь указанных жалоб с перенесенным COVID-19.
Выраженность и динамику жалоб у пациентов оценивали с помощью 10-сантиметровой визуальной аналоговой шкалы (ВАШ), а также на основании веноспецифического опросника CIVIQ-20. Для расчета глобального индекса качества жизни (GIS) использовали калькулятор сайта [16, 17].
C целью получения объективной информации о флебологическом статусе проводили ультразвуковое исследование на платформах экспертного класса, а также выполняли фотоплетизмографию на аппарате VasAssist (Huntleigh Diagnostics Ltd, Великобритания). Кроме этого, у 30 пациентов, которые на фоне субъективных жалоб отметили появление ретикулярных вен и телеангиэктазов в образцах крови, полученных из локтевой вены и ствола большой подкожной вены на голени, определяли уровни интерлейкинов 1 и 6 (IL-1, IL-6), сосудистого эндотелиального фактора роста (VEGF), фактора некроза опухоли (TNF), гистамина и С-реактивного белка в высокочувствительном диапазоне (hsСРБ).
Ультразвуковое обследование выполняли согласно протоколу FOVUS в вертикальном и горизонтальном положениях пациента с проведением дыхательной и компрессионных проб. Для улучшения визуализации низкоскоростных потоков крови использовали функцию B-flow [18].
Фотоплетизмографию (ФПГ) проводили синхронно на обеих нижних конечностях в положении пациента сидя через 15 мин после отдыха. После установки инфракрасного датчика в стандартной точке по внутренней поверхности голени на 10 см выше медиальной лодыжки в автоматическом режиме измеряли время возвратного кровенаполнения (ВВК) и силу мышечно-венозной помпы (СМПВ). Для объективизации результатов измерения проводили трижды с интервалом 15 мин и вычислением средних значений.
Забор крови для лабораторных исследований проводили с помощью вакуумной пробирки в горизонтальном положении пациента и в портативном рефрижераторе отправляли полученные образцы в референтную лабораторию.
С целью коррекции веноспецифических жалоб всем пациентам была назначена микронизированная очищенная флавоноидная фракция (МОФФ) 1 000 мг в сутки. В качестве сопутствующей терапии некоторые пациенты получали назначенные раннее поливитаминные комплексы, анксиолитики, гипотензивные и другие препараты, не влияющие на флебологический статус. Дополнительными методами реабилитации выступали плавание, длительные пешие прогулки, гимнастические упражнения для улучшения функции дыхания и венозного оттока из нижних конечностей.
Контроль эффективности терапии осуществляли дистанционно в режиме видеоконференции, а повторное клиническое, инструментальное и лабораторное обследование проводили через 3 мес. от начала терапии.
Обработку результатов исследования проводили с использованием пакета SPSS (IBM SPSS Statistics for Windows, Version 20.0 Armonk, NY, USA) с помощью методов описательной статистики. В зависимости от характера данных статистический анализ для количественных показателей, распределенных по нормальному закону, включал в себя расчет среднего значения, стандартного отклонения, минимальное и максимальное значения и медианы. Для количественных показателей, не распределенных по нормальному закону, вычисляли среднее значение, стандартное отклонение, минимальное и максимальное значение, а также медиану, первый и третий квартили. Для оценки качественных или количественных показателей, принимающих небольшое число возможных значений, использовали абсолютную и относительную частоту встречаемости каждого из возможных значений. При сравнении параметров до и после проведенного лечения для количественных показателей, распределенных по нормальному закону, использовали критерий Стьюдента для парных выборок; для количественных показателей, не распределенных по нормальному закону, – критерий Уилкоксона, для качественных показателей, принимающих только два возможных значения, – критерий Мак-Немура. Все используемые статистические критерии были двусторонние, с уровнем значимости 0,05.
Результаты
Частота жалоб пациентов и их выраженность в баллах до начала лечения и через 3 мес. после его завершения представлена в табл. 1 и 2.
Таблица 1. Жалобы и количество пациентов, включенных в исследование (n = 178)
Жалобы | Д-0 | Д-90 | p |
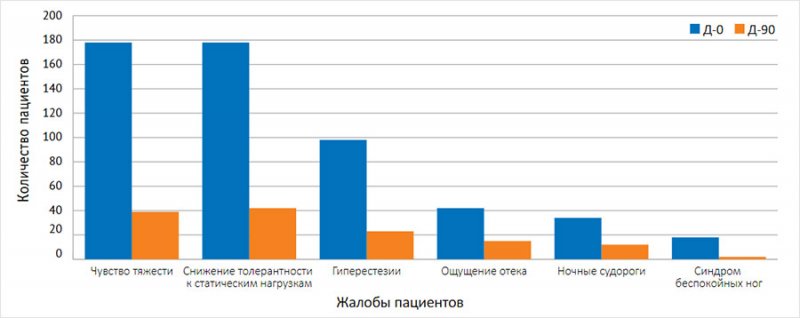
Чувство тяжести в икроножных мышцах | 178/100% | 38/21,3% | <0,001 |
Снижение толерантности к статическим нагрузкам | 178/100% | 54/30,3% | <0,001 |
Гиперестезии | 98/55,1 | 41/23,0% | 0,034 |
Ощущение отека голеней | 42/23,6% | 22/12,4% | 0,026 |
Ночные судороги в икроножных мышцах | 34/19,1% | 3/1,7% | <0,001 |
Синдром беспокойных ног | 18/10,1% | 8/4,5% | <0,05 |
Появление ретикулярных вен и телеангиэктазов | 36/20,2% | 36/20,2% | Без изменений |
Вечерний отек голеней | 11/6,2% | 3,9% | <0,05 |
Таблица 2. Оценка выраженности жалоб по 10-балльной визуальной аналоговой шкале до и после лечения
Жалобы | Д-0 | Д-90 | p |
Чувство тяжести в икроножных мышцах (n = 178) | 8,4 ± 1,4 | 3,8 ± 0,8 | <0,001 |
Снижение толерантности к статическим нагрузкам (n = 178) | 8,6 ± 0,9 | 3,2 ± 1,2 | <0,001 |
Гиперестезии (n = 98) | 7,4 ± 2,1 | 4,4 ± 1,8 | 0,034 |
Ощущение отека голеней (n = 42) | 7,1 ± 2,5 | 3,1 ± 0,6 | 0,026 |
Ночные судороги в икроножных мышцах (n = 34) | 9,2 ± 0,8 | 4,8 ± 1,6 | 0,003 |
Синдром беспокойных ног (n = 18) | 8,8 ± 1,2 | 3,6 ± 2,1 | <0,05 |
Появление ретикулярных вен и телеангиэктазов (n =3 6) | 10 | 10 | Без изменений |
Вечерний отек голеней (n =11) | 8,4 ± 0,6 | 3,4 ± 1,8 | <0,05 |
При ультразвуковом исследовании у всех пациентов, обсуждаемых в данной публикации, не было выявлено признаков перенесенного тромбоза и тромбофлебита в системе нижней полой вены, а также патологических веновенозных рефлюксов и варикозной трансформации поверхностных вен.
При исходной ФПГ время возвратного кровенаполнения составило 24,3 ± 1,8 сек, а сила мышечно-венозной помпы – 9,7 ± 1,8%. По завершении курса флеботропной терапии ВВК увеличилось до 28,6 ± 2,3 сек, а сила МВП – до 13,2 ± 2,9%. Различия между указанными показателями достоверны (p < 0,05).
Динамика веноспецифических жалоб на фоне лечения представлена на рисунке.
Рисунок. Жалобы пациентов до и после лечения (n = 178)
Глобальный индекс качества жизни после проведенного лечения повысился с уровня 64,4 ± 11,2% до 86,6 ± 9,1% (p < 0,001).
Результаты лабораторных исследований образцов крови, полученных из локтевой и большой подкожной вены до и после лечения, представлены в табл. 3.
Таблица 3. Уровни маркеров воспаления и эндотелиальной дисфункции в образцах крови (n = 30)
Биохимические маркеры | Локтевая вена | Большая подкожная вена голени | ||||
Д-0 (n = 30) | Д-90 (n = 30) | p | Д-0 (n = 30) | Д-90 (n = 30) | p | |
IL-1 (пг/мл) | 4,8 ± 2,1 | 4,2 ± 1,9 | NS | 7,8 ± 0,7 | 4,6 ± 1,6 | <0,001 |
IL-6 (пг/мл) | 3,9 ± 2,7 | 3,8 ± 1,4 | NS | 18,7 ± 1,8 | 8,3 ± 1,4 | <0,001 |
VEGF (пг/мл) | 61,3 ± 12,3 | 56,3 ± 11,8 | NS | 187,8 ± 11,6 | 73,2 ± 5,4 | 0,002 |
TNF (пг/мл) | 4,4 ± 0,9 | 3,4 ± 2,7 | 7,8 ± 0,9 | 4,9 ± 1,3 | <0,001 | |
Гистамин (нмоль /л) | 4,3 ± 1,4 | 4,6 ± 1,4 | NS | 22,4 ± 11,4 | 6,1 ± 4,1 | 0,004 |
hsCРБ (мг/л) | 2,8 ± 0,9 | 2,4 ± 1,2 | NS | 5,4 ± 0,3 | 1,1 ± 0,9 | <0,001 |
Обсуждение
Одним из ключевых патогенетических механизмов, присущих новой коронавирусной инфекции, выступает эндотелиальная дисфункция, которая в ряде случаев может приобретать персистирующий характер и сопровождаться флебопатией с появлением специфических симптомов и синдромов, снижающих качество жизни пациентов, и, вероятно, инициирующих патоморфологическую перестройку венозной системы нижних конечностей [19, 20]. Признаками COVID-19-ассоциируемой флебопатии служит дебют веноспецифических симптомов и синдромов на обеих нижних конечностях в отсутствии выявляемых рутинными диагностическими методами грубых органических поражений вен нижних конечностей.
Появление веноспецифических симптомов можно объяснить развитием эндотелиальной дисфункции с активацией специфических для хронических заболеваний вен механизмов повреждения микроциркуляторного русла и сосудистой стенки [21].
Наше исследование показало, что в постковидном периоде в венах нижних конечностей формируется провоспалительный фенотип эндотелия с продолжающейся экспрессией ключевых участников цитокинового шторма IL-1 и IL-6, hsСРБ, гистамина, VEGF и TNF, инициация которых была осуществлена в острую фазу SARS-CoV-2 [22, 23].
IL-1 и IL-6 служат медиаторами острого и хронического воспаления, активирующими лимфоциты и нейтрофилы, индуцирующие хемотаксис лейкоцитов и макрофагов, а также стимулирующие пролиферацию эндотелиальных клеток. Их активными продуцентами выступают активированные эндотелиоциты, а также погибшие макрофаги и моноциты. Повышенный уровень интерлейкинов наблюдают как при системной, так и при локальной воспалительной реакции. В нашем исследовании уровень интерлейкинов в крови, полученной из локтевой вены, находился в пределах референсных значений, что свидетельствовало об отсутствии системной воспалительной реакции. В то же время отмечено значимое повышение IL-1 и IL-6 в образцах крови, полученных из ствола большой подкожной вены на голени, что характерно для активного лейкоцитарно-эндотелиального взаимодействия, веноспецифичность которого косвенно подтверждает эффективность МОФФ, прием которой позволил значимо (p < 0,001) снизить уровни IL-1 и IL-6 в периферической венозной крови с 7,8 ±0,7 пг/мл и 18,7 ± 1,8 пг/мл до 4,6 ± 1,6 пг/мл и 8,3 ± 1,4 пг/мл соответственно.
C-реактивный белок (СРБ) – гликопротеин острой фазы воспаления, стимулирующий синтез ряда провоспалительных цитокинов, таких как IL-1, TNF и IL-6. СРБ участвует в активации комплемента (группы белков, являющихся частью иммунитета), моноцитов, стимулировании экспрессии молекул адгезии ICAM-1, VCAM-1, Е-селектина на поверхности эндотелия. Результаты исследований последних лет свидетельствуют, что в патологическом ремоделировании артериальной и венозной сосудистой стенки активную роль играет специфическое вялотекущее воспаление, маркером которого выступает СРБ в высокочувствительном диапазоне. Доказано, что стабильно повышенный уровень СРБ служит предиктором артериальных рестенозов и окклюзий, а также рецидивирующих венозных тромбозов и тромбофлебитов. Нормальное значение СРБ составляет 1,0 мг/л. В нашем исследовании в крови, полученной из БПВ, отмечен исходно высокий уровень hsCРБ – 5,4 ± 0,3 мг/л, который после проведения курса консервативной терапии снизился до 1,1 ± 0,9 мг/л (p < 0,001), что свидетельствует о купировании веноспецифического воспаления, инициированного COVID-19.
Гистамин-тканевой гормон и нейротрансмиттер, регулирующий жизненно важные функции организма и играющий значительную роль в воспалении и патогенезе ряда заболеваний. Гистамин накапливается в гранулах тучных клеток и базофилов, где находится в связанном инактивированном состоянии. При различных патологических процессах, в т. ч. и при веноспецифическом воспалении, гистамин высвобождается из гранул и его содержание в крови и тканевой жидкости повышается. Актуальным для постковидной флебопатии служит воздействие гистамина на сосудистые Н1-рецепторы, приводящее к расширению капилляров, повышению проницаемости их стенок, сладжированию форменных элементов крови и отеку паравазальных тканей. У пациентов, имеющих симптомы постковидной флебопатии, исходный уровень гистамина в венозной крови нижних конечностей в пять раз превышал базальные значения и составил 22,4 ± 11,4 нмоль/л. Снижение уровня гистамина до 6,1 ± 4,1 нмоль/л отражает постепенное купирование веноспецифического воспаления и нормализацию состояния микроциркуляторного русла. Влияние на уровень гистамина МОФФ, вероятно, оказывает опосредовано через подавление лейкоцитарно-эндотелиального воспаления, приводящего к дегрануляции базофилов и мастоцитов.
TNF, который продуцируют активированные макрофаги, во многом дублирует действия IL-1. В частности, TNF активирует лейкоциты, увеличивает образование макрофагами и нейтрофилами перекиси водорода и других свободных радикалов. С высоким уровнем TNF связывают развитие флебитов и тромбофлебитов. В данной работе на фоне приема МОФФ уровень TNF в крови, полученной из большой подкожной вены, снизился с 7,8 ± 0,9 пг/мл до 4,9 ± 1,3 пг/мл (p < 0,001). При этом базальный уровень TNF в крови локтевой вены существенных изменений не претерпел.
Сосудистый эндотелиальный фактор роста (VEGF) – гликопротеин, связывающийся только с эндотелиальными клетками и стимулирующий их пролиферацию. Помимо ангиогенного действия, VEGF значительно усиливает проницаемость сосудов. Активный синтез VEGF свидетельствует о повреждении эндотелия и запуске механизма неоангиогенеза, о чем и свидетельствует бурное появление ретикулярных вен и телеангиэктазов на фоне новой коронавирусной инфекции. Проведенное лечение привело к значимому снижению уровня VEGF в периферической венозной крови с 187,8 ± 11,6 пг/мл до 73,2 ± 5,4 пг/мл (p = 0,002). Можно предположить, что прием МОФФ у пациентов с постковидным синдромом может уменьшить частоту поражения внутрикожных вен.
Таким образом, для пациентов, перенесших новую коронавирусную инфекцию и отмечающих в постковидном периоде появление различных веноспецифических симптомов и синдромов, наряду с мероприятиями, направленными на коррекцию нарушений со стороны жизненно важных органов и систем, в программу реабилитации целесообразно вводить веноактивные препараты, которые демонстрируют свою эффективность при флебопатиях различного генеза. В данной работе была использована МОФФ, которую ранее успешно использовали при гормон-ассоциированных и гипотонических флебопатиях [24, 25]. Доказанный механизм МОФФ у этой категории пациентов заключается в способности подавлять на ранних стадиях лейкоцитарно-эндотелиальную реакцию и блокировать синтез провоспалительных цитокинов [26], что в очередной раз продемонстрировало данное исследование. Большой коллективный опыт применения, доказанный in vitro и in vivo, механизм действия и высокая фармакологическая безопасность послужили основанием для включения МОФФ в последние клинические рекомендации Европейского венозного форума (EVF) и Европейского общества сосудистых хирургов (ESVS) для назначения пациентам с C0s по CEAP [27, 28].
Вместе с тем в исследованиях последних лет для восстановления функции венозного эндотелия у пациентов, перенесших новую коронавирусную инфекцию, активно обсуждаются возможности сулодексида и эсцина [29–34]. В перспективе, после проведения экспериментальных и клинических исследований, эти препараты также могут быть включены в программу лечения постковидной флебопатии.
Выводы
Новая коронавирусная инфекция легкого и среднетяжелого течения в ряде случаев может провоцировать развитие флебопатии, проявляющейся комплексом специфических симптомов и синдромов. Данное состояние определяет целесообразность проведения флеботропной фармакологической терапии, направленной на восстановление эндотелия, нормализацию упруго-эластических свойств венозной стенки и микроциркуляторного русла, а также коррекцию веноспецифических жалоб, снижающих качество жизни пациентов. Регламент флеботропной терапии и ее продолжительность следует определять индивидуально с учетом динамики ключевых жалоб пациентов, а также, по возможности, результатов инструментальных, а в некоторых случаях и лабораторных показателей, характеризующих дисфункцию венозного эндотелия.
Список литературы / References
- Rabe E., Guex J.-J., Puskas A., Scuderi A., Fernandez Quesada F. Epidemiology of chronic venous disorders in geographically diverse populations: results from the Vein Consult Program. Int Angiol. 2012;31(2):105-115. Available at: https://pubmed.ncbi.nlm.nih.gov/22466974.
- Salim S., Machin M., Patterson B.O., Onida S., Davies A.H. Global epidemiology of chronic venous disease: a systematic review with pooled prevalence analysis. Ann Surg. 2021;274(6):971-976. https://doi.org/10.1097/SLA.0000000000004631.
- Andreozzi G., Signorelli S., Di Pino L., Garozzo S., Cacciaguerra G., Leone A., Martini R. Varicose symptoms without varicose veins: the hypotonic phlebopathy, epidemiology and pathophysiology. The Acireale project. Minerva Cardioangiol. 2000;48(10):277-285. Available at: https://pubmed.ncbi.nlm.nih.gov/11195857.
- Богачев В.Ю. Гормоноиндуцированная флебопатия. Новая проблема современной флебологии. Ангиология и сосудистая хирургия. 2002;(3):50-54. Режим доступа: https://www.angiolsurgery.org/magazine/2002/3/7.htm.
- Цуканов Ю.Т., Цуканов А.Ю. Клиническая оценка тяжести флебопатии на основе детализации симптома тяжести. Ангиология и сосудистая хирургия. 2003;(1):67-70. Режим доступа: https://www.angiolsurgery.org/magazine/2003/1/8.htm.
- Цуканов Ю.Т., Цуканов А.Ю., Баженов В.Н. Влияние оральных контрацептивов на магистральных диаметр вен нижних конечностей в ортостазе и их коррекция. Ангиология и сосудистая хирургия. 2008;(1):75-77. Режим доступа: https://www.angiolsurgery.org/magazine/2008/1/10.htm.
- Цуканов Ю.Т., Цуканов А.Ю., Баженов В.Н., Корниенко И.Ф., Василевич В.В. Медикаментозная коррекция негативных флеботропных эффектов гормонозаместительной терапии у женщин. Ангиология и сосудистая хирургия. 2009;(3):87-91. Режим доступа: https://www.angiolsurgery.org/magazine/2009/3/13.htm.
- Serra R., Andreucci M., De Caridi G., Massara M., Mastroroberto P., de Franciscis S. Functional chronic venous disease: A systematic review. Phlebology. 2017;32(9):588-592. https://doi.org/10.1177/0268355516686451.
- Ali M., Spinler S. COVID-19 and thrombosis: From bench to bedside. Trends Cardiovasc Med. 2021;31(3):143-160. https://doi.org/10.1016/j.tcm.2020.12.004.
- Castro R., Frishman W. Thrombotic Complications of COVID-19 Infection: A Review. Cardiol Rev. 2021;29(1):43-47. https://doi.org/10.1097/CRD.0000000000000347.
- Del Turco S., Vianello A., Ragusa R., Caselli C., Basta G. COVID-19 and cardiovascular consequences: Is the endothelial dysfunction the hardest challenge? Thromb Res. 2020;196:143-151. https://doi.org/10.1016/j.thromres.2020.08.039.
- Nägele M., Haubner B., Tanner F., Ruschitzka F., Flammer A. Endothelial dysfunction in COVID-19: Current findings and therapeutic implications. Atherosclerosis. 2020;314:58-62. https://doi.org/10.1016/j.atherosclerosis.2020.10.014.
- Anaya J.M., Rojas M., Salinas M.L., Rodríguez Y., Roa G., Lozano M. et al. Post-COVID syndrome. A case series and comprehensive review. Autoimmun Rev. 2021;20(11):102947. https://doi.org/10.1016/j.autrev.2021.102947.
- Garg P., Arora U., Kumar A., Wig N. The “post-COVID” syndrome: How deep is the damage? J Med Virol. 2021;93(2):673-674. https://doi.org/10.1002/jmv.26465.
- Pavli A., Theodoridou M., Maltezou H.C. Post-COVID Syndrome: Incidence, Clinical Spectrum, and Challenges for Primary Healthcare Professionals. Arch Med Res. 2021;52(6):575-581. https://doi.org/10.1016/j.arcmed.2021.03.010.
- Launois R., Mansilha A., Jantet G. International psychometric validation of the Chronic Venous Disease quality of life Questionnaire (CIVIQ-20). Eur J Vasc Endovasc Surg. 2010;40(6):783-789. https://doi.org/10.1016/j.ejvs.2010.03.034.
- Kuet M.L., Lane T.R., Anwar M.A., Davies A.H. Comparison of disease-specific quality of life tools in patients with chronic venous disease. Phlebology. 2014;29(10):648-653. https://doi.org/10.1177/0268355513501302.
- Балахонова Т.В., Ершова А.И., Ежов М.В., Барбараш О.Л., Берштейн Л.Л., Богачев В.Ю. и др. Фокусированное ультразвуковое исследование сосудов. Консенсус российских экспертов. Кардиоваскулярная терапия и профилактика. 2022;(7):3333. https://doi.org/10.15829/1728-8800-2022-3333.
- Bonaventura A., Vecchié A., Dagna L., Martinod K., Dixon D.L., Van Tassell B.W. et al. Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID-19. Nat Rev Immunol. 2021;21(5):319-329. https://doi.org/10.1038/s41577-021-00536-9.
- Zhang J., Tecson K.M., McCullough P.A. Endothelial dysfunction contributes to COVID-19-associated vascular inflammation and coagulopathy. Rev Cardiovasc Med. 2020;21(3):315-319. https://doi.org/10.31083/j.rcm.2020.03.126.
- Nicolaides A., Kakkos S., Baekgaard N., Comerota A., de Maeseneer M., Eklof B. et al. Management of chronic venous disorders of the lower limbs. Guidelines According to Scientific Evidence. Part I. Int Angiol. 2018;37(3):181-254. https://doi.org/10.23736/S03929590.18.03999-8.
- Kempuraj D., Selvakumar G.P., Ahmed M.E., Raikwar S.P., Thangavel R., Khan A. et al. COVID-19, Mast Cells, Cytokine Storm, Psychological Stress, and Neuroinflammation. Neuroscientist. 2020;26(5-6):402-414. https://doi.org/10.1177/1073858420941476.
- Tajbakhsh A., Gheibi Hayat S.M., Taghizadeh H., Akbari A., Inabadi M., Savardashtaki A. et al. COVID-19 and cardiac injury: clinical manifestations, biomarkers, mechanisms, diagnosis, treatment, and follow up. Expert Rev Anti Infect Ther. 2021;19(3):345-357. https://doi.org/10.1080/14787210.2020.1822737.
- Rabe E., Agus G., Roztocil K. Analysis of the effects of micronized purified flavonoid fraction versus placebo on symptoms and quality of life in patients suffering from chronic venous disease: from a prospective randomized trial. Int Angiol. 2015;34(5):428-436. Available at: https://pubmed.ncbi.nlm.nih.gov/25972136.
- Kakkos S.K., Nicolaides A.N. Efficacy of micronized purified flavonoid fraction (Daflon®) on improving individual symptoms, signs and quality of life in patients with chronic venous disease: a systematic review and meta-analysis of randomized double-blind placebo-controlled trials. Int Angiol. 2018;37(2):143-154. https://doi.org/10.23736/S0392-9590.18.03975-5.
- Mansilha A., Sousa J. Pathophysiological mechanisms of chronic venous disease and implications for venoactive drug therapy. Int J Mol Sci. 2018;19(6):1669. https://doi.org/10.3390/ijms19061669.
- Nicolaides A., Kakkos S., Baekgaard N., Comerota A., de Maeseneer M., Eklof B. et al. Management of Chronic Venous Disorders of the Lower Limbs. Guidelines According to Scientific Evidence. Part II. Int Angiol. 2020;39(3):175-240. https://doi.org/10.23736/S03929590.20.04388-6.
- De Maeseneer M.G., Kakkos S.K., Aherne T., Baekgaard N., Black S., Blomgren L. et al. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2022 Clinical Practice Guidelines on the Management of Chronic Venous Disease of the Lower Limbs. Eur J Vasc Endovasc Surg. 2022;63(2):184-267. https://doi.org/10.1016/j.ejvs.2021.12.024.
- Gallelli L., Zhang L., Wang T., Fu F. Severe Acute Lung Injury Related to COVID-19 Infection: A Review and the Possible Role for Escin. J Clin Pharmacol. 2020;60(7):815-825. https://doi.org/10.1002/jcph.1644.
- Idris S., Mishra A., Khushtar M. Phytochemical, ethanomedicinal and pharmacological applications of escin from Aesculus hippocastanum L. towards future medicine. J Basic Clin Physiol Pharmacol. 2020;31(5). https://doi.org/10.1515/jbcpp-2019-0115.
- Asiimwe I.G., Pushpakom S.P., Turner R.M., Kolamunnage-Dona R., Jorgensen A.L., Pirmohamed M. Cardiovascular drugs and COVID-19 clinical outcomes: a systematic review and meta-analysis of randomized controlled trials. Br J Clin Pharmacol. 2022;88(8):3577-3599. https://doi.org/10.1111/bcp.15331.
- Gonzalez-Ochoa A.J., Raffetto J.D., Hernández A.G., Zavala N., Gutiérrez O., Vargas A., Loustaunau J. Sulodexide in the Treatment of Patients with Early Stages of COVID-19: A Randomized Controlled Trial. Thromb Haemost. 2021;121(7):944-954. https://doi.org/10.1055/a-1414-5216.
- Богачев В.Ю., Болдин Б.В., Туркин П.Ю. Экстракт конского каштана. Update-2022. Consilium Medicum. 2022;(1):15-21. Режим доступа: https://consilium.orscience.ru/2075-1753/article/view/106361/80806.
- Bednarz K., Borek A., Drzymala F., Rachwal K., Gabryel B. Pharmacological protection of vascular endothelium in acute COVID-19. J Physiol Pharmacol. 2022;73(2). https://doi.org/10.26402/jpp.2022.2.01.
Другие новости
Опыт применения индуктора интерферона в профилактике гриппа
personМира 18-11-23, 00:00Время обеда в аптеке с одной кассой не регламентировано. Но что делать, если только начина......
В России выявлено 29 018 новых случаев коронавируса -
personHill 18-10-24, 21:38Л.С. Круглова, Н.В. Грязева; Центральная государственная медицинская академия Введение. Атопический......
Анализ факторов прогноза выживаемости российской популяции
personMurray 18-10-24, 21:37Ответьте на вопросы викторины и станьте участниками розыгрыша призов от компании «Сотекс»....